海洋青霉属真菌次生代谢活性物质研究进展与创新方向*
何若男,陈雅欣, 汪浔洁,曾 颖,陈仲巍,江友威
(1 厦门医学院药学系,福建 厦门 361023;2 海洋生物医药资源福建省高校工程研究中心,福建 厦门 361023)
青霉属是海洋最大的真菌属之一,是海洋环境中常见的优势属。青霉菌属(Penicillium)隶属于子囊菌门(Ascomycota)、散囊菌纲(Eurotiomycetes)、散囊菌目(Eurotiales)、丝裂孢科(Trichocomaceae)。其自菌丝单个地发生分生孢子梗,或不常成束,于顶部附近分枝。青霉状,末端生小梗,分生孢子梗无色或成团时带色,单胞,多呈球形或卵圆形,成干燥向基的链。青霉属含次生代谢产物丰富,主要由聚酮类、生物碱、萜类、大环内酯等组成,较多表现为抗菌、细胞毒、抗病毒、抗肿瘤的活性,同时研究发现其次生代谢产物还有一些新用途。迄今为止,已有青霉属的综述,但无海洋来源青霉属综述,而海洋中真菌的研究相对陆地较少,因此,其具备极大的探索和开发价值。
1 海洋青霉属真菌次级代谢产物生物活性
1.1 抗菌活性
现今,多重耐药菌的频繁发现与快速传播对人类健康造成了严峻的威胁。当前抗菌药物发现的重要来源仍是微生物,在其中具备有显著抗菌活性的海洋真菌青霉属中寻找抗菌活性药物成为一种趋势。在海洋沉积物研究中,对Penicilliumsp. ZZ380采用OSMAC策略将其进行了三次扩大培养,通过色谱分离等技术获得48个化合物,其中有10个新发现的生物碱类化合物pyrrospirones C-J(1~8)、penicipyrrodiether A(9)和penicipyrroether A(10)[1]。对48个化合物进行抗菌活性评估显示,其中1、2、4、7、9和10对耐甲氧西林金黄色葡萄球菌(MRSA)具有较强的抗菌作用,其MIC值分别为4.0、3.0、2.0、2.0、1.7、5.0 μg/mL,且 1、5、7和10对大肠杆菌具有较强的抑制活性,其MIC值分别为5.0、3.0、4.0、3.0 μg/mL。从东阿拉伯海分离得到的Penicilliumsp. ArCSPf的真菌乙酸乙酯提取物,通过进一步研究发现其活性最高的组分对耐甲氧西林金黄色葡萄球菌和蜡样芽孢杆菌具有显著的抗菌活性:其抑菌圈直径分别为21 mm和19 mm[2]。从广西海洋的沉积物中获得的Penicilliumsp. H1,其次生代谢物质中分离得三种二萜糖苷类化合物(11~13)[3]。其中化合物11和12具有抑菌活性,对香蕉枯萎病菌MIC值分别为32.0 和16.0 μg/mL。从海洋红藻Laurenciaobtusa(钝形凹顶藻)中分离的内生真菌P.aculeatum(棘孢青霉)的发酵提取物中获得了两种新的磺酰基代谢物——pensulfonoxy和pensulfonamide[4]。其发酵提取物对大肠杆菌展现出有效的抗菌抑制活性,而pensulfonamide则对白色念珠菌展现出抗真菌活性,抑菌圈直径分别为 20.5 和 18.0 mm。
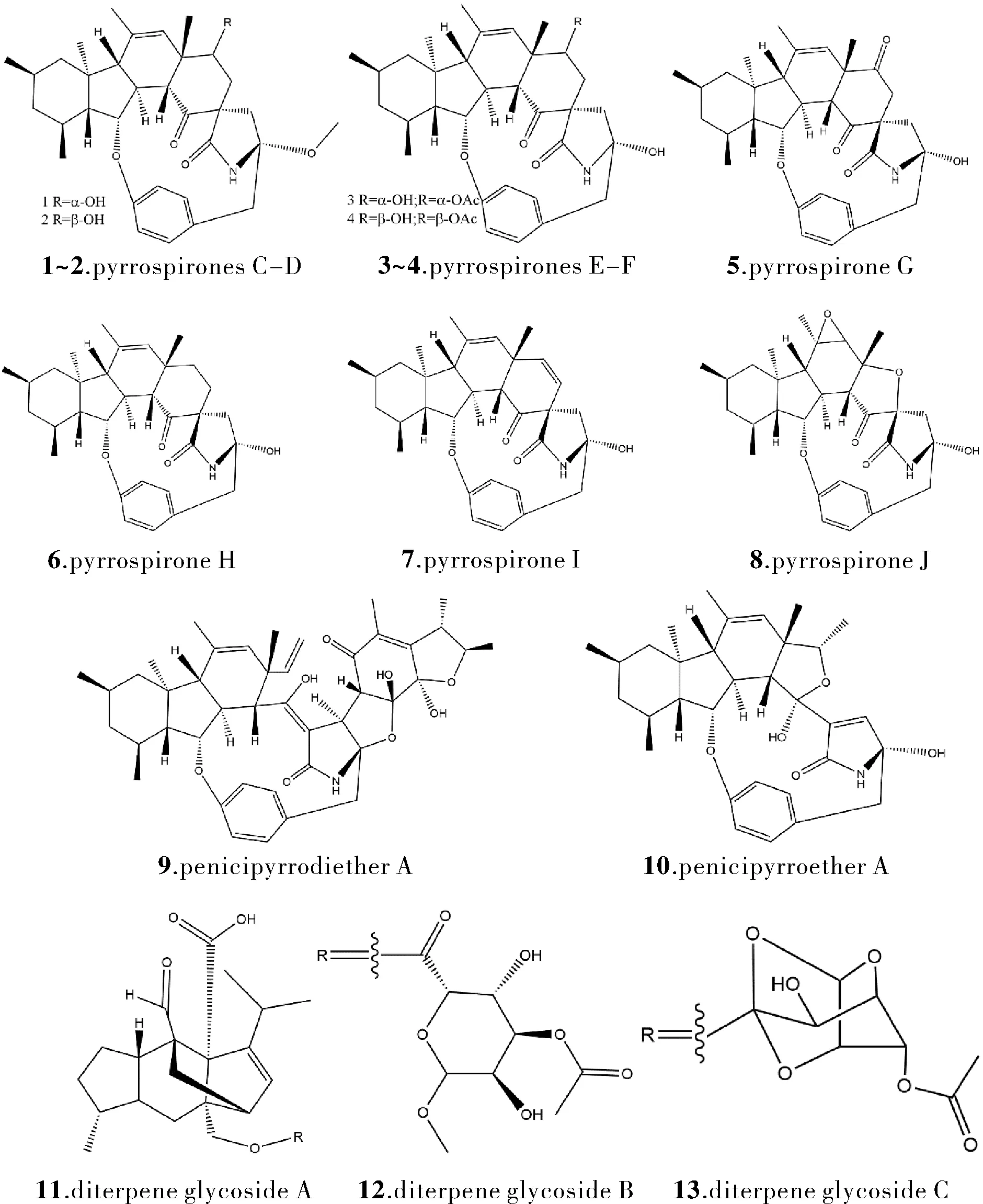
图1 化合物1~13的结构
1.2 细胞毒活性及抗肿瘤活性
细胞毒活性往往展现在抑制细胞生长周期、抑制普通肿瘤细胞、癌细胞增殖等方面。纵观普通良性肿瘤、癌症等疾病治疗方案的历史发展与衍变,不难看出,细胞毒类药物是常见肿瘤性疾病治疗、癌症治疗以及严重关节炎、化疗方案的重要组成部分。来自海洋的诸多青霉属真菌已被发现具有显著细胞毒活性,为寻找抗肿瘤的药物而挖掘极端环境来源的青霉菌属真菌次生代谢产物,也正成为一种趋势[5]。从一个海洋双壳类标本中分离出Penicilliumsp. ZZ901d对其次生代谢物质采取核磁共振光谱分析、高分辨质谱数据、旋光值、电子捕获检测器计算和单晶X射线衍射的技术手段,完成了9个苯醌衍生物(14~22)和1个蒽醌(23)的鉴定[6]。化合物14~23通过SRB分析评价其抑制神经胶质瘤M87MG和C6细胞增殖的活性。化合物16~19的IC50分别为44.65~55.99 μM、 23.24~37.26 μM、60.81~60.93 μM、30.22~34.78 μM。自西太平洋深海水中分离出的Penicilliumsp. allii-sativi发现两种新的(24,25)和一种已知的(26)混源萜类化合物,其中andrastone A (24)含有一种不寻常的环戊-1,3-二酮[7]。经实验发现andrastone A通过激活半胱天冬酶-3和调节RXRα的转录激活功能,选择性地对HepG2这一肿瘤细胞展现出显著抑制作用,IC50值为7.8 μM。从深海P.solitum(壳青霉)MCCC 3A00215 中分离出一种新型聚酮化合物、两种新型生物碱和 22 种已知化合物[8]。其中已知化合物viridicatol (27) 对于PANC-1、Hela 和 A549 三株细胞表现出抗肿瘤活性,IC50值约为 20 μM。
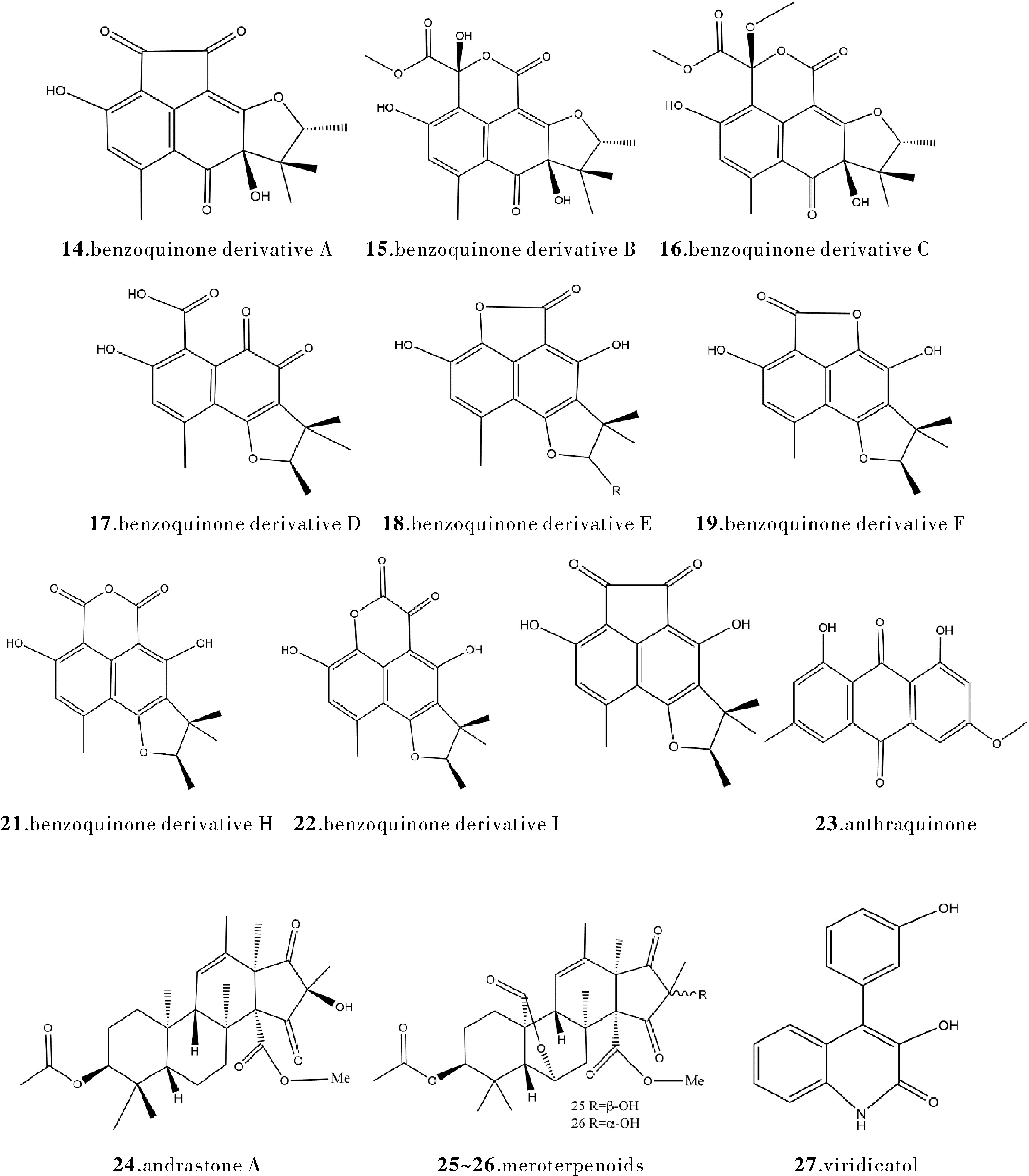
图2 化合物14~27的结构
1.3 抗病毒活性
相比于细菌,病毒是一种更为简单的生物,仅有作为遗传物质的少许RNA或DNA以及蛋白质包裹膜,因此抗菌药物往往并不能在抗病毒上起作用。曾发现抗病毒活性次生产物的海洋青霉属,对于抗病毒药物研究提供了又一新方向。在深海沉积物研究中,自Penicilliumsp. DT-F29 中分离得的4个已知类似物brefeldin A (28)、12α-hydroxybrefeldin A (29)、7-epi-brefeldin A(30)、7-dehydrobrefeldin A(31)和4个新的brefeldin A类似物,brefeldin A 类似物是一个生物活性代谢物家族,由十六元大环内酯及其衍生物组成,分别命名为7,7-dimethoxybrefeldin C(32)、6β-hydroxybrefeldin C (33)、4-epi-15-epi-brefeldin A (34)、4-epi-8 α-hydroxy-15-epi-brefeldin C (35)[9]。其中,分离出的brefeldin A (28)被检测出具有抗病毒的生物活性。从地中海海绵 Ircinia fasciculata 样品中培养的一株P.chrysogenum (产黄青霉)中分离得到的sorbicillactone A(36), 它具有独特的双环内酯结构, 此外,该化合物在病毒测试系统中表现出显著的活性,特别是在保护人类 T 细胞免受 HIV-1 的细胞病变作用的能力[10]。对于红树林底部海水沉积物的青霉菌的研究中,从青霉菌P.polonicum(波兰青霉) H92中分离得到的次生代谢产物有3-甲氧基纯绿青霉素(37)和Fructigenine A(38),二者对流感病毒神经氨酸酶具有不同程度的抑制活性,具有抗病毒活性[11]。
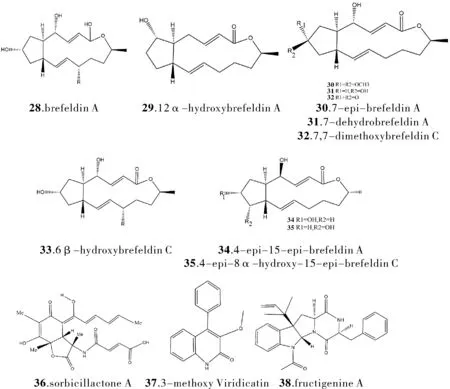
图3 化合物28~38的结构
1.4 其 他
除上述活性之外,海洋来源的青霉属真菌已有研究报道的次生代谢物活性还包括:抑制细胞分化、抑制酶活性、抑制细胞因子等。从西大西洋深海热液喷口环境中分离的P.chrysogenum(产黄青霉) SCSIO 07007发现三种新的化合物,包括两种新的3,4,6-三取代的α-吡喃酮衍生物(39,40)一种新的吲哚基二酮哌嗪衍生物(41)[12]。其中,新化合物39和40对甲状旁腺素1B显示出明显的抑制活性,IC50值分别为9.32和27.8 μg/mL,实验还表明它们可能是二型糖尿病(T2DM)疗法的新先导药物。从海洋真菌P.rudallense(红曲青霉菌)菌株的培养物中分离出四个新的萜类化合物,austalides V-X(42~44)和半萜类苯酞衍生物(45),以及八个已知的萜类化合物类似物(46~53)[13]。其中化合物42、43、46~48和51表现出强有力的破骨细胞分化抑制活性,其ED50值为1.9~2.8 μM。从新药发现的观点来看,RANKL信号通路可作为抑制破骨细胞过度分化的一个有前途的靶点,为发现医疗许多以破骨细胞过度分化为特征的成人骨疾病的药物提供依据。从源自深海的P.thomii(托姆氏青霉菌) YPGA3发酵分离物中发现一种新的甲萜类化合物austalide(54),以及七种已知类似物(55~61)、两种新的labdane型二萜类化合物(62和63)和一种已知衍生物(64)[14]。其中化合物55和64的IC50值分别为910 μM、525 μM,均展现出α-葡萄糖苷酶抑制活性。从海洋沉积物来源的青霉菌中分离并鉴定出三种新的稀有环戊烯二萜(65~67)以及十三种已知化合物[15]。运用蛋白质印迹和免疫荧光技术手段,得知其作用机制为化合物65抑制了NF-kB激活途径,也表明了化合物65可作为潜在的抗炎剂在体外抑制炎症介质和细胞因子[16]。
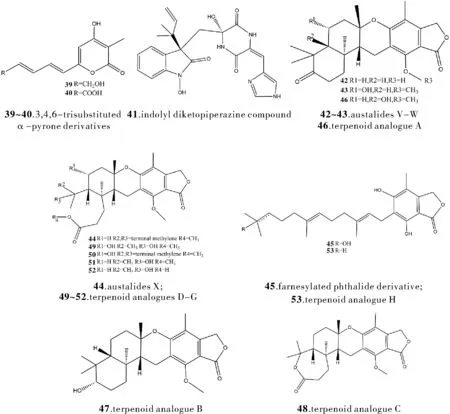
图4 化合物39~67的结构
2 海洋青霉属真菌次生代谢产物开发现状与创新方向
市场上已经存在大量真菌或细菌来源的药物,如岩藻毒素和许多含有麦角生物碱的产品,也有分别来自青霉属——产黄青霉(P.chrysogenum) 及灰黄青霉(P.griseofulvum) 的广谱抗菌青霉素及抗真菌的灰黄霉素[17]。碳青霉烯类抗菌药物作为新一代抗生素,具有抗菌谱广且抗菌活性强的特点,特别是对多重耐药革兰阴性杆菌(如产超广谱β—内酰胺酶(ESBL)肠杆菌科细菌)具有着强抗菌活性,广泛应用于多重耐药菌感染、需氧菌混合厌氧菌感染等的临床治疗[18]。据已有报道分离自青霉属真菌的代谢产物高达 1200 余种,其多在抗菌、抗病毒、抗肿瘤、抗氧化和抗心血管疾病等方面展现活性[19]。然而,市场上海洋来源的真菌次生物质相关药物仍旧非常稀有。此外,诸多海洋真菌次生物质的特点是具有恰当的口服生物利用度及恰当的物理化学性质,能够吻合配制有效药物的标准。与合成药物相比,大多数真菌蛋白质和肽显示出着更弱的人类细胞毒性及更少更弱的副作用。与此同时,分子系统发育学和基因组学的出现,佐以高度复杂的分析手段和生物各项技术的革命性发展,加速了真菌次生物质代谢组学的开发,为活性物质代谢研究提供了支持[20]。
通过查阅已发表研究得知,海洋来源的青霉属真菌次生物质的相关文献已有近800篇,当前对青霉属真菌次生物质的挖掘主要集中于自特殊环境(如海底、红树林、火山口)中分离得新青霉菌种,进而获得结构新颖的次生物质并对其进行活性评价[21]。关于海洋真菌及其次级代谢产物研究的技术路线一般是:海洋样品的菌株分离纯化与保藏→菌种鉴定与筛选→特定条件下发酵培养→产物提取→发酵产物的逐级分离纯化→采取现代波谱技术对单体化合物进行结构解析(见图5)。但该方式的样品获得相对困难且工作量较大,产物分离具有随机性,由此发展出一系列新型方法技术。
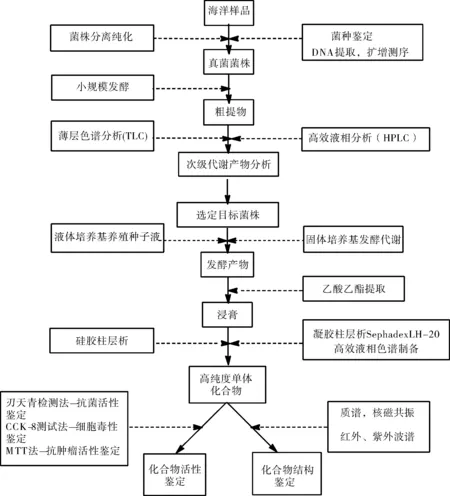
图5 传统分离纯化的技术路线
2.1 宏基因组法
目前常用的传统分离纯化方法是稀释涂布法和琼脂扦插法,此两种方法分离工作量大,分离所得大多数菌种均为常见已知菌种,且传统分离方法下生产快的菌种对生长慢的菌种有抑制作用,此后便出现了一种依托宏基因组技术对某种特殊环境进行测序,旨在不培养的情况下分析是否存在新种的方法[22]。宏基因组法,即一种依托高通量测序技术(NGS)发展而诞生的方法,其研究的基本问题是对某一环境中的微生物群落进行物种组成的鉴定,以数据分析手段从海量高通量测序数据中获取样本近乎全部的基因信息(全基因组测序数据),以此为依据进一步分析样本微生物的物种组成及功能结构给生命科学的研究发展带来了前所未有的机遇[23]。在海洋微生物分离筛选中,该法得到优势展现与应用。
Zimmermann等[25]共同采取18S rRNA V4区的宏条形码技术以及显微镜观察法,对捷克的奥德拉河与尼萨河的沉积物物种多样性和丰度进行了比较,比较得知宏基因组测序技术能够更好地反映出环境样品微生物多样性[24]。该法可以鉴别一些因形状相似或太小而难以发现的微生物,且更加便捷迅速,在快速评估某一区域的微生物多样性以及群落整体结构中显示出较大的优势。当前已在海洋微生物鉴定中广泛使用,但在青霉属中应用较少。当然,该法也存在一些不足之处,诸多引物、扩增区域、PCR条件、扩增效率、数据库和读长解析等因素都会对分子鉴定准确度带来影响。
2.2 共培养
共培养在传统方法中是指在无菌状态下,把一些特定种类的不同微生物于好氧或厌氧条件下混合培育,随着技术的发展,现今共培养法是指研究者通过生物信息与高通量技术筛选两种技术结合,有目的地将特定微生物混合培养,由此挖掘微生物来源具有新活性的天然产物或提高微生物代谢[26]。在自然条件下,不同微生物之间的生态学关系繁杂,种群间普遍存在营养与空间的双重竞争,因此在共培养模式下,可以模拟再现微生物间包括协同代谢、竞争抑制、诱导代谢等相互作用,它们之间的直接相互作用或许会使得某些微生物沉默基因诱导表达[27]。当前,共培养不仅应用于包括医药、农业、工业及食品在内的领域,其在海洋真菌活性物质挖掘中也得到了显著应用。
Meng等[28]在对Penicilliumcitrinum和Beauveria-feline(真菌白僵菌)共培养后,自该共培养代谢物中分离鉴定了具备新颖结构的两个酚类化合物(68~69),二者在这两株真菌单独培养的代谢物中未检测到,它们对金黄色葡萄球菌和大肠杆菌的MIC 值分别为2.0、4.0 μg/mL和8.0、8.1 μg/mL,表现出良好的抗性。Carlson等[29]将一株Streptomyces(链霉菌属)sp. B033 和四株细菌共培养,获得了卡那霉素(70),并发现此类细菌对提高Streptomycessp. B033 产生卡那霉素的能力有显著作用。
因此,通过共培养的方式,能够在一定条件下促使微生物新陈代谢路径的改变,增加其活性次生代谢产物的多样性或提升目标产物的量,已经成为挖掘新型海洋微生物来源活性物质的重要手段,具有重大的应用前景和研究意义。
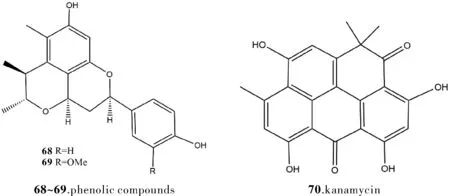
图6 化合物68~70的结构
2.3 基因组挖掘与沉默基因簇激活表达
伴随着基因组学技术的发展应用, Brakhage[30]提出,各个环境因素以及相关酶抑制剂能够影响微生物中的多种调控蛋白,对正常的基因组表达进行干扰,也能激活某些沉默的基因簇,进而使微生物代谢能力及部分代谢途径发生改变,最终得到更多结构新颖、活性多样的天然产物。当前较少以改变培养方案或组合生物合成方式研究青霉属真菌次生物质合成的代谢通路,关键酶及关键基因,这给予我们提示:若在其高级分子水平上进一步促进、抑制相关代谢路径,修饰关键基因等研究,或将提供更优产物路径,进而扩大探寻新次生物质范围,以此获取更多先导药物化合物。此外,近年来出现一种通过强启动子启动特定沉默基因簇,进而直接对某一特定沉默基因簇进行表达的新方法,该法使得海洋真菌中获取新颖结构化合物的效率大大提升。
Tan等[31]对Streptomycessp. SCSIO 02999 采取改变其转录速率以此改变该菌种基因表达,激活了相关TPMA 的生物合成基因簇,并敲除了一个正调控基因以及两个负调控基因,使 TPMA(71)完成了生物合成并从代谢产物中分离测出一个新的磺酸化 TPMC(72)。Lim等[32]通过分析链霉菌 S. roseosporus 基因组,在一个 I 型 PKS 沉默基因簇的上游插入启动子,激活此基因簇,并在该菌的代谢产物中分离测出一个新的大环内酰胺类化合物 auroramycins(73),该化合物对耐药细菌VRE 和MRSA的抑制活性较强。
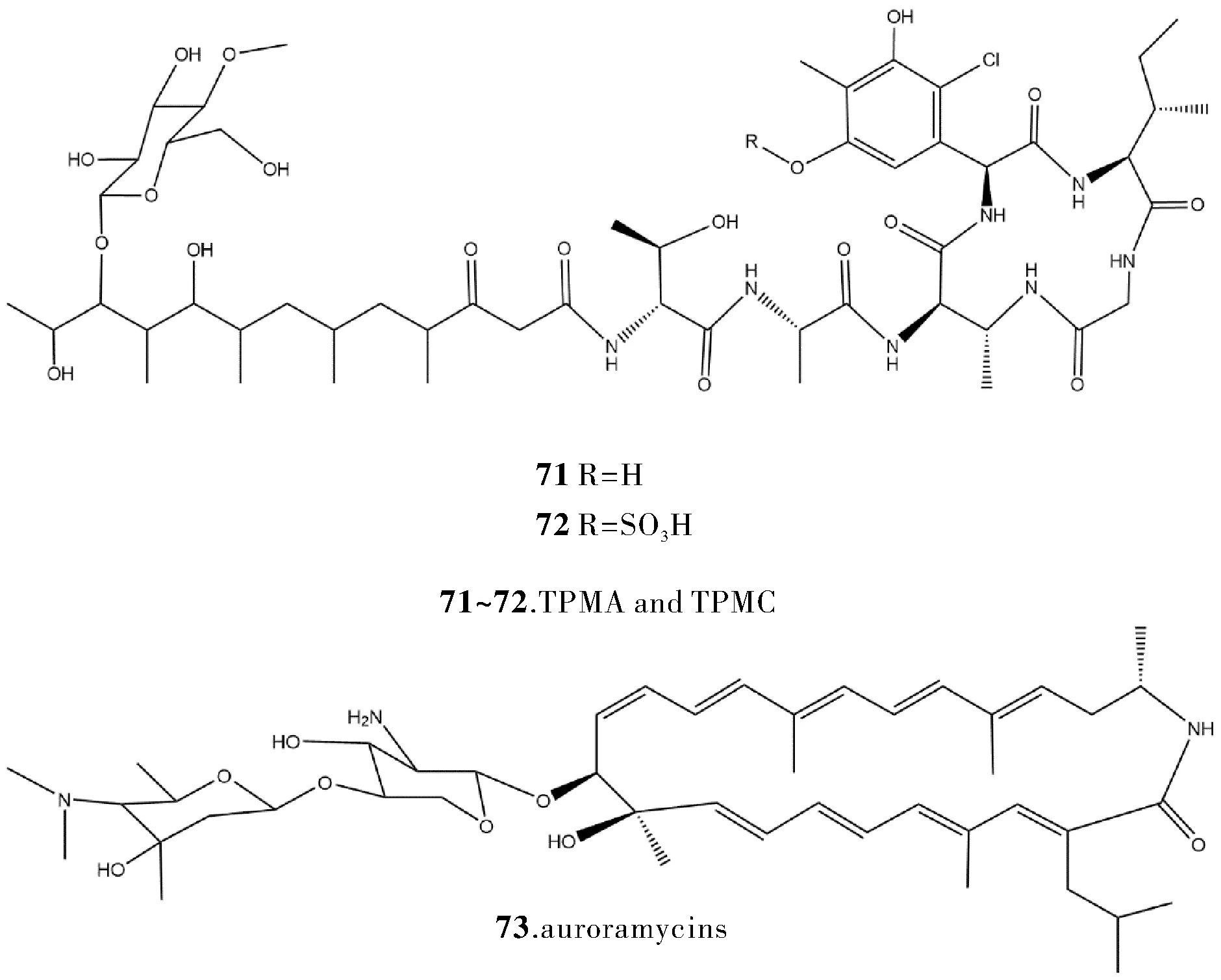
图7 化合物71~73的结构
该法在海洋真菌,包括青霉属中的应用前景重大,但相关研究较少,可为日后的研究提供方向。
此外,近些年,随着包括多肽固相合成和计算机模拟演算等技术的持续突破,有望帮助我们探索包括海洋青霉活性物质在细胞膜的作用机制、活性物质合成途径、活性分子吸收与代谢机制、群体感应系统调控机理等领域,以便为更高效地开发靶向药物并规模化生产做铺垫。同时,对于海洋真菌代谢途径的深入研究,也使得激活海洋真菌的沉默基因成为当前的研究热点,进一步深入挖掘不失为另一条高效新路径[33-34]。
3 结 语
近年来,海洋青霉属次级代谢活性物质虽然在抗菌、抗氧化、细胞毒及抗肿瘤、抗病毒等方面取得了一些进展,但还没有新的相关重大活性物质或药物出现。随着传统的表观遗传学修饰和OSMAC法的发展,以及近年来发展出诸如宏基因组法、沉默基因组激活、共培养等新策略的出现,为海洋青霉属真菌活性物质研发提供了诸多便利。同时,也解决了分离过程繁琐以及生物活性物质含量较低的问题。随着药物修饰技术的发展开始在海洋药物研究中进行应用,这为研究海洋青霉属活性物质提供了各式作用机理,并研发出了更多生物活性、更高医用价值的药物,乃至靶向药物,使其得以为大规模生产提供引导。
综上,我国幅员辽阔,坐拥渤海、南海、黄海、东海等广阔海域,伴随生物化学技术不断发展和进步,我国在海洋青霉属活性产物的研究与应用上还有着巨大潜力和广阔前景。

