颅内高信号血管征与颈内或大脑中动脉重度病变患者发生脑缺血事件相关
张迎生,云宗金,徐鹏程,丁新苑
脑动脉粥样硬化性狭窄是中国人群发生急性脑缺血事件的重要原因之一,重度脑血管狭窄或闭塞患者往往脑缺血症状更重,预后更差[1],其中颈内动脉及大脑中动脉狭窄或闭塞是导致急性前循环缺血事件重要原因之一[2-4],临床上如何对此类患者发生急性脑缺血事件进行早期预测及干预尤为重要。在颈内动脉和大脑中动脉近端严重狭窄或闭塞后,在磁共振检查时,可在液体衰减反转恢复(fluid attenuated inversion recovery,FLAIR)序列图像上发现病变血管供血区域出现高信号血管征(hypenintense vessel sign,HVS)。既往研究认为HVS分布区域存在低灌注状态,容易导致梗死体积的增加和病情进展[5-13]。鉴于此,本研究通过比较症状性和非症状性颈内动脉或大脑中动脉重度狭窄或闭塞患者之间HVS分布情况,旨在探讨HVS是否与此类患者发生急性脑缺血事件相关并同时探讨其危险因素。
材料与方法
1.临床资料
连续搜集2019年1月-2021年5月在本院就诊的96例颈内或大脑中动脉重度病变患者的临床和影像资料。其中,症状性狭窄或闭塞68例,无症状性28例。详细记录入组患者的性别、年龄、既往史和实验室检查结果。计算体质指数(body mass index,BMI)和血浆促动脉硬化指数(atherogenic index of plasma,AIP),AIP的计算方法为甘油三酯(triglyceride,TG)与高密度脂蛋白(high density lipoprotein cholesterol,HDL-c)比值的对数,即Log(TG/HDL-c)[14]。
入组标准:所有患者行头颅MRI检查,其中急性脑梗死患者发病后24~96 h内完成头颅MRI检查;经头颅MRA或头颈CTA证实颈内动脉或大脑中动脉M1段重度狭窄或闭塞。急性脑梗死及短暂性脑缺血发作(transient ischemic attack,TIA)诊断依据《中国急性缺血性脑卒中诊治指南2018》[15]。症状性脑动脉狭窄或闭塞标准依据《症状性颅内外动脉粥样硬化性大动脉狭窄管理规范》定义为病变血管同侧大脑中动脉供血区急性梗死或短暂性脑缺血发作[2]。排除标准:既往发生脑缺血事件;入院后进行静脉溶栓或取栓患者;急性大脑中动脉闭塞患者;非大动脉粥样硬化性梗死如心源性梗死等;非动脉粥样硬化所致的血管狭窄,如夹层动脉瘤、放疗、烟雾病和血管炎等;同时合并其它部位脑动脉中重度狭窄或闭塞;头颅MR图像质量不佳;临床及影像资料不完整。
2.检查方法
使用Siemens Avanto 1.5T磁共振成像仪,常规行横轴面平扫。T2-FLAIR序列扫描参数:TI 2371.5 ms,TR 8000 ms;DWI参数:TE 93 ms,TR 4500 ms,b=0和1000 s/mm2;3D-TOF MRA扫描参数:TE 7.0 ms,TR 26.0 ms。
CTA扫描使用GE 64排螺旋CT机,扫描范围为主动脉弓至头颈部,扫描参数:100 kV,300 mA,层厚0.625 mm,层距0.625 mm,螺距0.984。使用高压注射器注射碘帕醇注射液80 mL,触发阈值设定为150 HU。将扫描原始数据传输至工作站进行图像后处理。
3.病变分析和评估标准
所有图像由2位高年资主治以上神经内科医师共同进行阅片分析,意见有分歧时经讨论达成一致意见。
根据脑动脉是否狭窄及狭窄程度分为4级:无狭窄;狭窄率<50%为轻度狭窄;50%≤狭窄率<70%为中度狭窄;狭窄率≥70%或闭塞为重度病变。
颅内HVS判断标准为FLAIR 序列图像上,大脑中动脉供血区域邻近脑灰质表面有斑点状、管状或蛇纹状高信号(图1)。按照改良Alberta卒中项目早期CT评分方法(modified Alberta Stroke Program Early Computerized Tomgraphy Score,mASPECTS),对HVS的分布情况进行评分:以基底节消失平面为界,将大脑中动脉供血区分为岛叶(I)和M1~M6区,共7个区域,每个区域记1分,总分为7分,某个区域内如出现HVS则减去1分(图1)[16]。

图1 大脑中动脉M1段重度狭窄患者,男,69岁,左侧肢体活动障碍1天。a)FLAIR图像显示右侧I、M2和M5区可见HVS(箭);b)FLAIR图像显示右侧I、M2和M5区可见HVS(箭),HVS-mASPECTS评分为4分;c)DWI示右侧侧脑室旁急性梗死灶(箭);d)MRA图像显示右侧M1段重度狭窄(箭)。
急性脑梗死的判断标准:DWI上呈高信号,ADC图上呈低信号。分水岭梗死包括皮质型、内分水岭型和混合型[17]。
4.统计学分析
使用SPSS 17.0软件包进行统计学分析。计量资料先进行正态性检验,符合正态分布的资料以均数±标准差表示,两组间比较采用t检验,多组之间比较采用方差分析;计数资料采用构成比(%)表示,两组之间比较采用χ2检验或Fisher 精确检验。将两组之间比较P<0.10的自变量带入logistic回归方程,进行多因素回归分析。采用受试者工作特征(receiver operating characteristic,ROC)曲线和曲线下面积(area under curve,AUC)分析HVS-mASPECTS评分对重度颈内或大脑中动脉病变患者发生脑缺血事件的预测价值。以P<0.05为差异具有统计学意义。
结 果
1.临床资料
入组96例患者中男55例,女41例,年龄43~91岁,平均年龄(65.80±9.75)岁。症状性颈内或大脑中动脉病变患者68例,其中急性梗死60例,短暂性脑缺血发作8例;非症状性狭窄28例。两组之间临床资料的比较结果见表1。
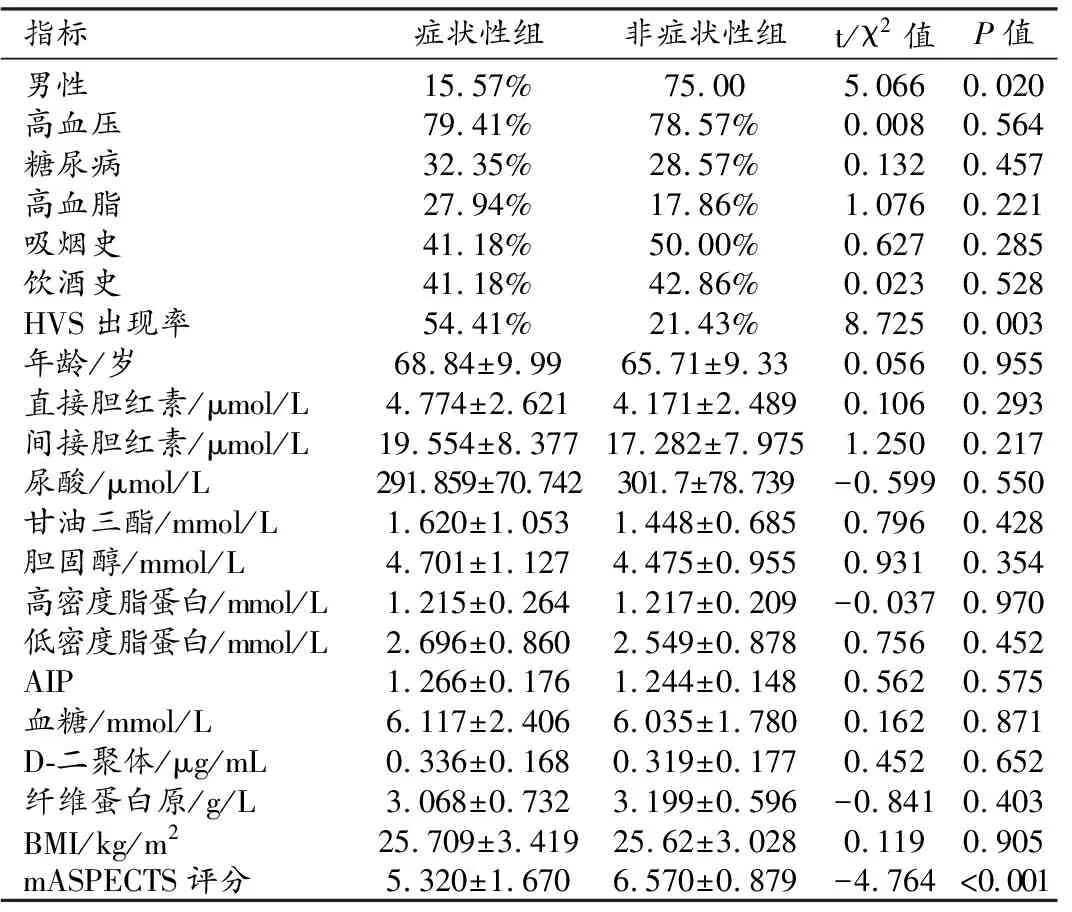
表1 症状性组与非症状性组临床资料的比较
两组之间高血压、糖尿病、高血脂、吸烟和饮酒史出现率的差异均无统计学意义(P>0.05);两组之间年龄、BMI及实验室指标中的血脂指标、血糖、胆红素、D-二聚体、纤维蛋白原和AIP的差异均无统计学意义(P>0.05)。两组之间性别构成和HVS出现率的差异有统计学意义(P<0.05);两组之间HVS-mASPECTS评分的差异具有统计学意义(P<0.001)。
2.logistic回归分析
将症状性与非症状性颈内或大脑中动脉病变组之间P<0.1的自变量纳入多因素logistic回归分析,结果见表2。统计分析结果显示性别及HVS-mASPECTS评分是重度颈内动脉或大脑中动脉病变患者发生急性脑缺血性事件的独立危险因素(P<0.05),其中HVS-mASPECTS评分预测重度病变患者发生脑缺血事件的AUC为0.714(95%CI:0.611~0.817,P=0.001)。
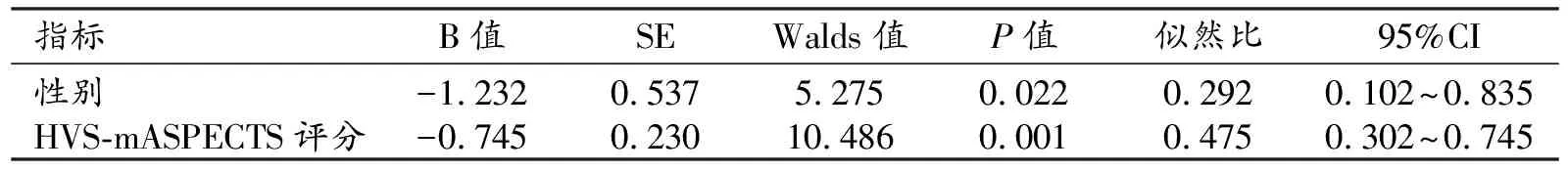
表2 症状性颈内或大脑中动脉病变危险因素的回归分析
3.HVS与脑缺血事件的相关性
根据脑缺血事件的类型分为3组,其中TIA组8例,分水岭梗死组49例,非分水岭梗死组11例。3组之间HVS出现率和mASPECTS评分的比较结果见表3。分水岭梗死组中34例(69.39%)可见HVS,非分水岭梗死组中2例(18.18%),TIA组中仅1例(12.50%),3组之间HVS出现率的差异有统计学意义(χ2=15.916,P<0.001)。三组之间HVS-mASPECT评分的差异有统计学意义(F=9.169,P<0.001);进一步组间两两比较,分水岭梗死组的HVS-mASPECT评分显著低于其它2组(P<0.01)。

表3 HVS与脑缺血事件的相关性分析
4.HVS危险因素分析
根据头颅FLAIR图像上是否出现HVS,将患者分为HVS阳性组43例和HVS阴性组53例,两组之间临床资料的比较见表4。两组之间性别、年龄、BMI及糖尿病、高血脂、吸烟和饮酒史的差异均无统计学意义(P>0.05),两组之间的血脂、血糖、胆红素、D-二聚体和纤维蛋白原水平及AIP的差异无统计学意义(P>0.05)。HVS阳性组高血压患者的构成比显著高于HVS阴性组(P<0.05)。回归分析显示高血压是HVS的独立危险因素(OR=4.748,P=0.01)。
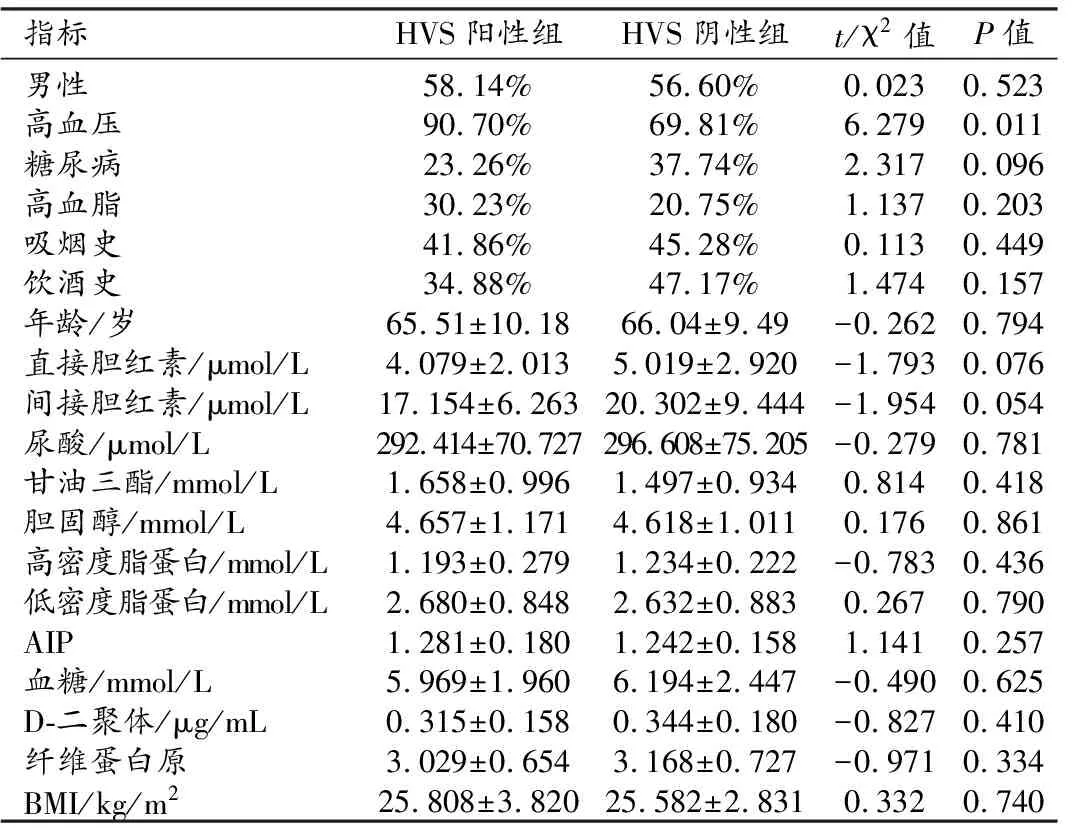
表4 HVS危险因素分析
讨 论
脑动脉狭窄是导致我国患者缺血性卒中的重要原因之一,其中颈内动脉和大脑中动脉狭窄是导致前循环梗死的重要原因[2-4]。脑动脉狭窄患者一旦出现急性脑缺血事件往往病情更严重,预后更差且更容易复发[18],因此对此类患者发生脑缺血事件的风险评估尤为重要。
既往研究[8-10]发现,大脑中动脉近段以及颈内动脉重度狭窄或闭塞后在FLAIR序列上可见大脑中动脉供血区域出现HVS,其可能的机制包括严重病变血管远端缓慢血流或侧支循环的慢血流所致;HVS分布范围越广病变血管供血区域内梗死体积越大,病情容易恶化,预后越差。考虑HVS分布区域存在低灌注状态,当低灌注得不到有效改善则导致梗死体积增加。刘文华等[11]对行取栓治疗的急性大脑中动脉闭塞患者研究发现,随着取栓后血管再通,HVS消失,预后良好,认为HVS提示局部存在低灌注区域,随着低灌注区域血流改善,HVS消失,症状改善。Kufner等[12]研究认为HVS存在预示由于侧支循环不足而存在严重缺血,HVS分布范围越广脑灌注不足越严重。已有研究证实HVS分布区域内存在脑血流量下降和血流缓慢[13]。然至今为止HVS与脑缺血事件之间的关系仍有不同的观点[19-22]。HVS分布越广,病变血管供血区内梗死体积越小,有助于延缓或抑制梗死体积进展,机制系HVS代表远端侧支循环的建立。但HVS阴性并不能说明侧支循环建立不良[22],甚至有研究者认为HVS阴性患者甚至较HVS阳性患者侧支循环建立良好[7]。而陈军等[23]认为HVS与侧支循环之间呈曲线关系,并不能简单认为HVS代表侧支循环的建立。因此HVS与侧枝循环之间的关系仍需进一步研究。造成以上不同结论原因可能与HVS的显影受多个因素影响有关,除病变狭窄血管严重程度外可能还受侧支循环开放的程度和血流速度有关。HVS是一种影像学表现,其出现的病理生理学机制是局部血管内慢血流[8-10,13],当血流缓慢时血管流空效应便会消失,在FLAIR序列上可出现HVS。既往研究已证实HVS分布区域内血流缓慢且存在灌注不足[6-7,12-13]。
HVS可在脑梗死发生之前出现[13],也可助于TIA的诊断及预测复发[24-25],但HVS是否与重度颈内或大脑中动脉病变患者出现缺血性事件相关,既往研究缺鲜有报道。本研究通过比较症状性与非症状性颈内或大脑中动脉重度病变组之间的危险因素发现,常见的脑血管病危险因素如血压、血糖、血脂以及AIP等与此类患者发生脑缺血事件并无相关,而HVS所占的比率及HVS-mASPECTS评分在两组之间存在显著差异,回归分析显示HVS-mASPECTS评分是脑缺血事件发生的独立危险因素。根据ROC曲线下面积结果,我们可以认为HVS-mASPECTS对脑缺血事件的发生具有一定的预测效果。HVS与脑缺血事件相关性分析显示,HVS与分水岭梗死灶密切相关。分水岭梗死包括外分水岭梗死和内分水岭梗死以及混合性梗死,其重要机制系血流动力学障碍导致的低灌注损害,脑动脉存在重度狭窄或闭塞系主要原因[17]。本研究结果可以说明HVS的出现提示病变血管区域内存在慢血流和低灌注状态,HVS分布范围越广,则低灌注越严重,当患者的侧支循环建立不足时,在一定诱发因素下极易发生脑缺血事件。因此当颈内或大脑中动脉重度病变患者出现HVS需警惕脑缺血事件的发生,需早期积极临床干预。
HVS的危险因素分析显示,高血压是重度颈内或大脑中动脉病变患者出现HVS的危险因素。当颅内大动脉狭窄或闭塞导致脑血流灌注不足,将通过远端小血管自身调节或侧支循环的建立增加脑血流灌注。高血压既是大动脉病变危险因素也是小血管病危险因素,因此高血压患者易导致脑动脉狭窄患者脑血流灌注不足。最近的研究表明高血压是大动脉病变患者侧支循环不良的唯一预测因素,在发生症状性狭窄前即可存在脑血流灌注下降[26]。本研究中高血压患者HVS出现率高,同样可以说明高血压患者更易导致病变血管区域内血流灌注不足。既往亦有研究认为HVS与Willis环之间具有相关性[22],但考虑到颈动脉、大脑中动脉与Willis环之间的不同解剖关系,故本文中未做进一步的探讨。
另外,本研究发现,性别在症状性与非症状性两组之间存在差异,结果显示女性患者较男性患者更易出现脑缺血事件。既往研究已经证实雌激素水平的下降与脑梗死的发病相关,绝经后的女性脑梗死发病率增高,可能系雌激素通过影响机体的糖脂代谢和炎性反应而导致脑梗死的发生[27]。本研究中41例女性患者年龄为(65.07±9.93)岁,最小年龄49岁,而女性患者40岁以后雌激素水平开始下降,50岁左右进入绝经期,因此笔者认为本研究中女性患者更易出现脑缺血事件与其雌激素水平下降相关。
综上所述,在颈内动脉或大脑中动脉重度病变患者中,HVS与脑缺血事件的发生相关,尤其分水岭梗死,HVS对脑缺血事件发生具有一定诊断价值,HVS出现可能提示病变血管责任区域内存在低灌注。高血压是HVS临床危险因素,另外女性患者更易发生脑缺血事件。

