把握主线 科学建模
——以一道周测试题讲评探讨、优化、建模为例
湖南 戴儒俭
近年来中国高考命题改革的主要方向是加大对考生思维能力的考查,高考评价体系指导下高考命题呈现出“无思维,不命题”的新特征。化学学科的关键能力主要从理解与辨析能力、分析与推测能力、归纳与论证能力、探究与创新能力4个维度构建,要求考生在遇到与化学学科相关的问题情境时,具有认识问题、分析问题、解决问题的能力。为此,教师在平时的课堂教学中应杜绝“填鸭式满堂灌”教学模式,少讲、精讲,通过创设情境,引发认知冲突,有意识地启发学生思维,让学生通过思考提出解决方法,归纳解决思路,构建解决同类问题的有效思维模型。另外,教师在各类测试中应精心选题,让学生通过练习及时巩固知识,强化思维能力与分析问题、解决问题的能力。
1.试题建模
以我校在高一下学期一次周测试题中所选的一道题为例,阐述如何引导学生通过分析、建模解决问题。
1.1 试题
向50 mL 14.0 mol·L-1浓硝酸中加入足量的铜,充分反应后共收集到标准状况下2.24 L NO和NO2混合气体(不考虑混合气体中可能存在的其他氮氧化物),则参加反应的铜的质量为
( )
A.6.4 g B.12.8 g C.19.2 g D.38.4 g
1.2 试题分析
在学生已学习了2019年人教版必修二第五章——化工生产中的重要非金属元素,并对HNO3基本性质有了认知后,我校化学组选择了这道以Cu与HNO3反应为载体的典型试题作为周测试题。试题情境来源于教材,不陌生,考虑到了硝酸随着反应进行其浓度变化后产物也有所变化,符合教材对知识的真实陈述。但问题之处在于,一个体系中涉及了两个氧化还原反应,一个是开始阶段的Cu与浓HNO3反应,另一个是后一阶段的Cu与稀HNO3反应,Cu与HNO3均参与两个反应。若先写出化学方程式,就会发现,HNO3虽然完全耗尽,但Cu与HNO3在两个反应中的计量数比例不同,无法直接通过HNO3计算消耗的Cu;另外产物NO2、NO的量也未知,同样无法通过单个反应计算各自消耗的Cu。那么能否改变思路,避开化学方程式,另辟蹊径?笔者采用了下面的方式:
1.3 建模前的启发引导活动
从元素守恒入手,设计了如下问题:
[问题1]从反应物的量来看,Cu足量,硝酸完全反应,反应后所得溶液中存在的溶质是什么?
学生思考后回答:HNO3完全耗尽,溶质只有Cu(NO3)2。
此设问旨在从所求参加反应的Cu转化入手,寻找线索。
[问题2]反应后所得溶液的溶质与参加反应铜的物质的量关系为?
学生思考后回答:Cu~Cu(NO3)2,二者物质的量之比为1∶1。
此设问旨在建立Cu元素守恒关系,建立欲求参加反应的Cu,可先求Cu(NO3)2或Cu2+的思路。
[问题3]Cu(NO3)2溶液中的阴、阳离子的物质的量关系为?
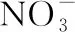
[问题4]HNO3除了体现其氧化性,转化为气体氮氧化物(NO2、NO),还转化为什么物质?又体现HNO3什么性质?
学生思考后回答:HNO3一部分作氧化剂,被还原分别得到NO2、NO,另一部分作酸,转化为Cu(NO3)2。
此设问旨在建立物质总量与分量关系。
[问题5]HNO3分别转化为NO2、NO时,NO2、NO与参加反应的HNO3物质的量关系分别为?
此设问旨在建立N元素守恒关系(局部)。
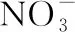
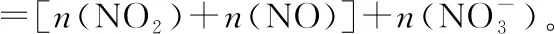
此设问旨在建立N元素守恒关系(整体)。
1.4 三个守恒关系等式
基于以上关系式,建模如图1:
图1
2.模型应用与验证
2.1 模型应用
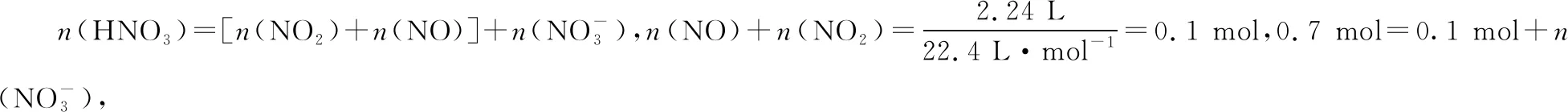
模型应用解题方法呈现后,同学们大多反映易懂、好理解。这样一来,问题似乎已解决,但笔者突然想到这样一个问题:作为一个氧化还原反应,该模型自始至终未体现电子守恒这一规律。故后续和同学们一起进行了以下探究、验证。
2.2 模型验证
极端假设法分析验证:
抗病品种的选育可以从根本上减少病害的发生和发展,分子生物学作为选育抗病品种的主要方法在近些年已经得到高度的重视,抗病育种时可以针对不同地区的气候特点进行抗病育种,得到针对该地区的抗病品种。抗病品种不仅可以提高蔬菜粮食的产量同时也可以减少农药的污染,但目前分子生物学方法选育的抗病品种仍然存在一些问题。
0.1 mol混合气体若全为NO2,意味着HNO3得到0.1 mol 电子;而0.1 mol混合气体若全为NO,意味着HNO3得到0.3 mol电子。0.1 mol混合气体意味着硝酸得到的电子在0.1 mol~0.3 mol之间;但是答案为0.3 mol Cu,失去的是0.6 mol电子,这显然违背了电子守恒,故选项C错误。


故消耗Cu的质量应在11.2 g~16.8 g之间,是否应选B呢?
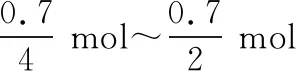
综上,结论为该题违背科学常识,是一道错题。
3.对试题改编后模型优化、重建
3.1 改编后的试题
向50 mL 14.0 mol·L-1浓硝酸中加入足量的铜,充分反应后共收集到标准状况下4.48 L NO和NO2混合气体(不考虑混合气体中可能存在的其他氮氧化物),下列说法不正确的是
( )
A.参加反应的铜的质量为16.0 g
B.气体产物中NO和NO2的体积之比为3∶1
C.若向充分反应后的溶液中继续加入稀硫酸,无明显现象
D.反应中氧化产物与还原产物的物质的量之比为5∶4
3.2 优化、重建的模型
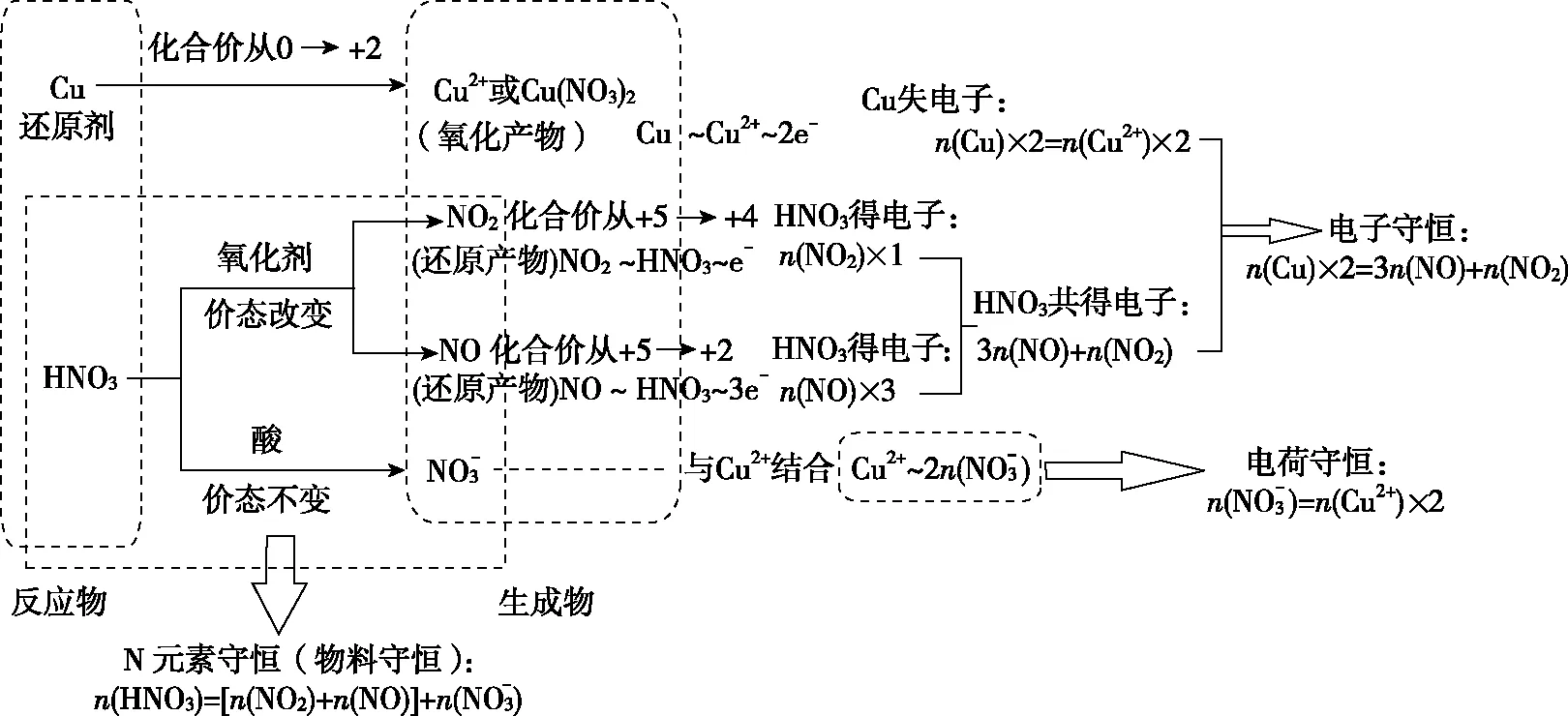
图2
3.3 优化后的模型解题应用
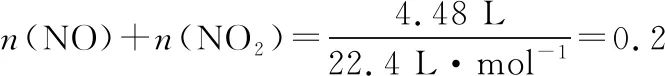
4.优化后模型合理性再验证
优化后模型补充了一个电子守恒的表达式。对于复杂的反应体系,如题中Cu与一定浓度的HNO3反应,Cu过量,硝酸完全反应,产物有Cu(NO3)2、NO2、NO,一种常规解法是基于化学方程式列出比例关系。如:

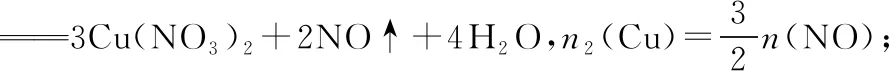
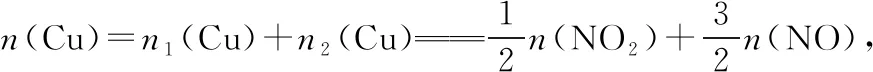
5.小结与反思
5.1 小结
化学建模,是个高级思维活动的具体实施过程,需要借助于理解与辨析、分析与思考,以守恒思想为核心,是化学学科核心素养中变化观念与平衡思想的体现。剔除细枝末节,紧紧抓住始态(反应物)与终态(生成物),厘清物质转化过程中的变与不变。物质变了,元素种类未变化;微粒变了,同种元素原子个数未变;价态变了,升降总数(平衡)相等,得失电子(平衡)相等。对于电解质溶液,电荷守恒与化合物中化合价代数和为零的原则一样,本质上也是平衡思想。
对于高中学生的化学建模的学习,任重道远。应尊重客观规律,由简单到复杂,由浅到深,循序渐进,步步推进,不求一步到位,更不可能一蹴而就。建模结果的呈现形式,不求统一标准,要因题而异,因人而异。只要能把复杂问题简单化,把复杂问题形象化,思维有序化、操作简单化、程序化,就是有效建模。以下面试题为例。
【试题】向100 mL一定浓度的稀硝酸中加入5.6 g铁粉,充分反应后共收集到标准状况下2.24 L NO气体,测得反应后溶液的pH=0,则原稀硝酸的物质的量浓度为________(不考虑反应前后溶液体积的变化)。
该试题的建模呈现如图3:
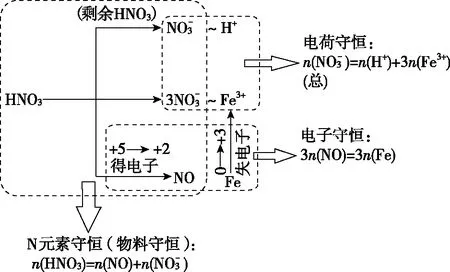
图3
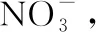
该试题的建模围绕试题所问,目标明确,重点突出。题目不同,反应后溶液中离子组成也变多,模型也有所变化与调整。
5.2 反思
作为一名教师,常常面临着一个困惑,怎么样才能把复杂的问题给台下的学生讲明白,这就需要教师首先试着站在学生的角度,以学生当下的认知水平为出发点,一步步抽丝剥茧把复杂的问题分解成若干子问题,降低难度,步步为营,使问题最终迎刃而解。
另外,信息时代的网络,方便我们搜题借鉴参考,但也难免存在差错,需要我们擦亮眼睛,大胆质疑,小心求证,去伪存真。

