免疫系统人源化小鼠模型构建技术探讨
范蓓,王园园,赵云霞,江魁,王斌
1.华兰生物工程股份有限公司,河南 新乡 453000;
2.河南晟明生物技术研究院有限公司,河南 新乡 453600;
3.华兰基因工程有限公司,河南 新乡 453600
肿瘤免疫疗法的出现代表肿瘤治疗手段的革命性进步,也成为抗肿瘤药物研发的热点。虽然免疫疗法在不同适应症中表现出可观的长期生存率,但只在一小部分患者和肿瘤类型中获得成功,仍然无法使很多患者从中受益[1],因此,亟需临床前动物模型来推动能够延长或改变患者临床反应的新免疫疗法或免疫组合疗法的开发,提高临床试验的成功率。目前,用于评价免疫疗法的小鼠模型有同源小鼠模型、化学诱导小鼠模型、基因编辑人源化小鼠模型和免疫系统人源化小鼠模型,其中前三种模型应用比较广泛,它们依赖于小鼠免疫系统,但小鼠的免疫反应并不能完整复制人的免疫反应[2]。免疫系统人源化小鼠模型是将人的免疫细胞移植到重度免疫缺陷的小鼠体内,构建出具有功能性人免疫系统的小鼠模型,更接近于人体免疫系统,能够更好地模拟药物进入人体后免疫系统的反应,因此越来越受到科研工作者的关注和青睐。虽然免疫系统人源化小鼠模型构建技术已非常成熟,但是人源化免疫系统重建的影响因素很多,不同单位和机构的水平参差不齐,对模型构建成功率及应用转化方面的影响也不同。本研究从构建方法、免疫缺陷小鼠品系、性别及饲养、免疫细胞的供体、数量和细胞状态等方面对免疫系统人源化小鼠模型构建进行了技术探讨,以期为肿瘤免疫疗法提供更有利的药物研发工具。
1 材料与方法
1.1 实验材料
1.1.1 实验动物31只6~8周龄重度免疫缺陷雌性小鼠NCG(NOD CRISPR Prkdc Il2r gamma),品系名称为NOD/ShiLtJGpt-Prkdcem26Cd52 Il2rgem26Cd22/Gpt,SPF级,购于江苏集萃药康科技股份有限公司,小鼠在华兰基因工程有限公司动物中心屏障动物实验设施进行饲养。与本研究相关的动物实验获得了华兰集团实验动物管理委员会批准(申请受理编号:ER-HLGE-RD-2021005-02,ER
HLGE-RD-2021005-03,ER-HLGE-RD-2021005-09),整个动物实验过程遵循实验动物伦理福利3R原则,实验动物管理和使用符合法规要求。
1.1.2 细胞Human normal PB-MNC(HuPB-MNC)购于上海澳能生物技术有限公司,包括四种供体:供体1(批号:LP200730,Donor ID:Z006)、供体2(批号:LP200907A,Donor ID:Y1292)、供体3(批号:PCH20210200017,Donor ID:Z0115)、供体4(批号:PCH20210400013,Donor ID:Z0144),液氮保存备用。
1.1.3 主要试剂1×FBS和1×PBS(pH 7.4)均购自美国Gibco公司;RPMI-1640购自ATCC;DNaseⅠ购自美国Worthington公司;盐酸购自洛阳昊华化学试剂有限公司;无水乙醇购自天津市科密欧化学试剂有限公司;肝素钠、BSA购自北京索莱宝科技有限公司;0.9%氯化钠注射液购自河南科伦药业有限公司;1×RBC裂解缓冲液购自美国eBioscience公司;FITC anti-human CD45抗体、PerCP/Cyanine5.5 anti-mouse CD45抗体购自美国BioLegend公司。
1.1.4 主要仪器小鼠饲养IVC系统(苏州冯氏,ZJ-5);层流传递窗(中科圣杰);生物安全柜(苏净泰安,BSC-1604ⅡA2);紫外线消毒车(申光仪器,豪华型);电子天平(河南宏程,T500);二氧化碳培养箱(上海力申,HF90);电热恒温水箱(上海锡为科学,HWS-28);生物安全柜(苏州安泰,BSC-1304ⅡB2);脉动真空灭菌器(山东新华医疗器械,XG1.DTF-1.5);高精密度电子天平(赛多利斯科学仪器,GL224l-1SCN);涡旋混匀器(精骐,HYQ-3110);离心机(Dragon,D3024R);流式细胞仪(BD,C6)。
1.2 实验方法
1.2.1 重度免疫缺陷小鼠NCG的饲养与检疫小鼠饲养于IVC系统中,环境条件控制在20~26℃,相对湿度40%~70%,小鼠照度15~20 lx,工作照度200 lx以上,光照12 h明暗交替,噪音低于60 dB;与小鼠有关的所有操作,如更换笼具垫料、加水加料、实验操作等均在生物安全柜中进行;给予合格的小鼠生长繁殖饲料,自由摄食;经高压灭菌的玉米芯材质作为实验专用垫料,应保证无异味、无结块、无霉变、无虫蛀、无异物污染等;饮用水采用酸化水(用HCl调节pH至2.5~3.0),经高压灭菌后使用饮水瓶供应,自由摄水;所有动物购入后,由兽医负责检疫,动物检疫期1~3 d,检疫期最后期限由兽医决定。
1.2.2 HuPB-MNC细胞复苏从液氮中取出供体1、供体2、供体3和供体4 HuPB-MNC细胞,快速将其置入37℃水浴中解冻,直到管中只剩下最后一片结晶;在生物安全柜中,用75%乙醇擦拭细胞冻存管外壁;打开细胞冻存管,用1 mL移液枪轻轻混匀细胞后,将细胞移至含有300μg DNaseⅠ的50 mL无菌离心管中,用1 mL完全培养液冲洗冻存管,并将其转移到50 mL离心管中,边滴加边摇匀;之后逐滴加入18 mL 37℃预热的完全培养基(含10%FBS的RPMI-1640),边滴加边摇匀;细胞悬液室温条件下200 r·min-1离心15 min;去除上清后加适量体积1×PBS,轻轻混匀细胞,取少量细胞悬液计数,确定复苏后细胞活率及细胞数;用PBS调整到需要的细胞浓度,备用。
1.2.3 免疫系统人源化小鼠模型的建立选取检疫合格的6~8周龄NCG重度免疫缺陷雌性小鼠,适应性饲养1周左右;注射前将复苏后的HuPB-MNC细胞置于冰上保存;分别取1.0E+6 cells和1.0E+7 cells的HuPB-MNC细胞,使用1 mL无菌注射器吸取200μL HuPB-MNC细胞悬液,以尾静脉注射方式注射NCG小鼠;对照组NCG小鼠不作任何处理;每周观察小鼠2次,并记录小鼠体重及死亡情况;实验第7、14、21、28和35天眼眶静脉丛试血,流式检测小鼠外周血中huCD45+T细胞和mCD45+T细胞,huCD45%计算方法如公式(1)。
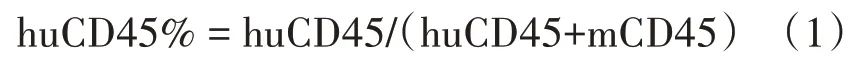
1.2.4 流式细胞术监测NCG小鼠外周血中人CD45+T细胞的重建水平采用流式细胞术监测小鼠外周血中人CD45+T细胞的重建水平,具体操作如下:①采血:小鼠眼眶静脉丛试血,加入1%肝素钠生理盐水溶液抗凝(4μL抗凝剂:200μL血),混匀后室温放置,1 h内染色。②抗体Mix配制:以一个样品为例,取1.25μL FITC anti-human CD45抗 体 和0.3125μL PerCP/Cyanine5.5 anti-mouse CD45抗体,加入3.4375μL 1%BSA-PBS染色缓冲液涡旋混匀,4℃避光待用。③荧光标记:50μL抗凝血,每管加入5μL FITC anti-human CD45和PerCP/Cyanine5.5 anti-mouse CD45抗体Mix,充分混匀,4℃避光孵育20 min。另设置不加抗体处理作为阴性对照。④裂红:加入红细胞裂解液(全血:红细胞裂解液体积比为1∶10),轻摇混匀,室温反应5 min,加入1×PBS终止裂红反应(PBS:红细胞裂解液体积比为2∶1),500 r·min-1离心5 min,弃上清(观察裂红效果,是否需要重复1次)。⑤洗涤:加入1 mL 1×PBS,500 r·min-1离心5 min,弃上清。⑥检测:细胞沉淀加入300μL 1×PBS,300目尼龙网过滤后上机检测。
1.2.5 数据采集及统计学分析实验采集的原始数据采用Graphpad Prism 7.0软件进行分析;流式细胞仪检测数据采用BD AccuriTMC6软件进行分析,流式监测结果图采用FlowJo V10软件进行绘制。
2 结果与分析
2.1 免疫细胞移植数量的选择
分别取1.0E+6 cells和1.0E+7 cells的供体1 HuPB-MNC细胞以尾静脉注射方式移植入NCG小鼠体内,实验第7、14、21、28和35 d眼眶静脉丛试血,流式检测小鼠外周血中huCD45+T细胞和mCD45+T细胞,计算huCD45%。结果显示(图1),HuPB-MNC细胞移植数量为1.0E+7 cells时重建效果较好。
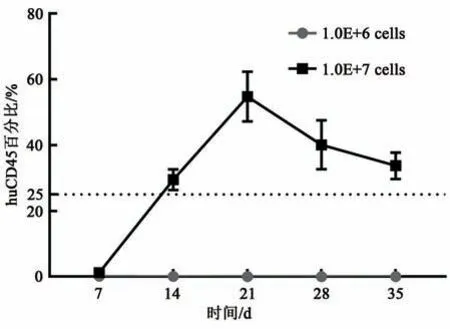
图1 不同免疫细胞移植数量对免疫重建效果的影响Fig.1 Effect of different number of transplanted immune cells on immune reconstitution
2.2 免疫细胞供体的选择
2.2.1 免疫细胞不同供体重建后体重及生存率的变化分别取1.0E+7 cells数量的供体2、供体3和供体4 HuPB-MNC细胞以尾静脉注射方式移植入NCG小鼠体内,对照组小鼠不作任何处理。免疫细胞移植后NCG小鼠体重变化结果显示(图2),与对照组相比,供体2组和供体4组在HuPBMNC细胞移植21 d后体重开始下降,供体3组在HuPB-MNC细胞移植0 d后体重未见明显增长,平均体重始终低于对照组。NCG小鼠生存率变化结果显示(图3),供体3组在HuPB-MNC细胞移植35 d时的生存率下降至80%,供体2组和供体4组在HuPB-MNC细胞移植35 d时生存率均为100%。由以上结果可知,供体2组和供体4组在HuPBMNC细胞移植21 d后开始出现GVHD移植物抗宿主反应,供体3组在HuPB-MNC细胞移植0 d后即表现出GVHD移植物抗宿主反应。以上结果表明,生存率在NCG小鼠不同供体的重建速度和水平存在明显差异。

图2 免疫细胞不同供体重建后体重的变化Fig.2 Effect of different donors of transplanted immune cells on body weight

图3 免疫细胞不同供体重建后生存率的变化Fig.3 Effect of different donors of transplanted immune cells on survival rate
2.2.2 免疫细胞不同供体重建后NCG小鼠外周血中人CD45+T细胞的重建水平的变化分别取1.0E+6 cells数量的供体2、供体3和供体4 HuPBMNC细胞以尾静脉注射方式移植入NCG小鼠体内,实验第7、14、21、28和35天眼眶静脉丛试血,流式检测小鼠外周血中huCD45+T细胞和mCD45+T细胞,计算huCD45%。NCG小鼠外周血中人CD45+T细胞的重建水平的变化结果显示(图4),供体3组和供体4组在HuPB-MNC细胞移植21 d时NCG小鼠外周血中人CD45+T细胞的重建水平大于25%,供体2组在HuPB-MNC细胞移植28 d时NCG小鼠外周血中人CD45+T细胞的重建水平大于25%,标志着免疫系统人源化小鼠模型建立成功。每周采集NCG小鼠外周血进行流式动态监测结果显示(图5),NCG小鼠外周血中人CD45+T细胞重建水平随时间推移逐步上升,在重建35 d时供体2组、供体3组和供体4组huCD45%平 均 值 分 别 达34.77%、26.24%和56.10%。
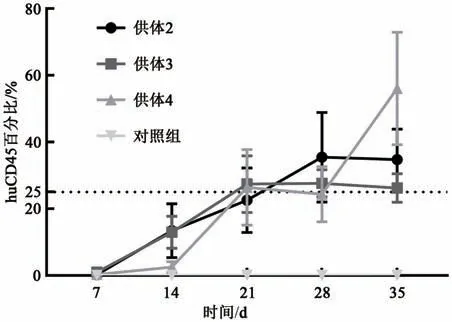
图4 NCG小鼠外周血中人CD45+T细胞的重建水平的变化Fig.4 Effect of different donors of transplanted immune cells on reconstruction level of NCG mice peripheral blood
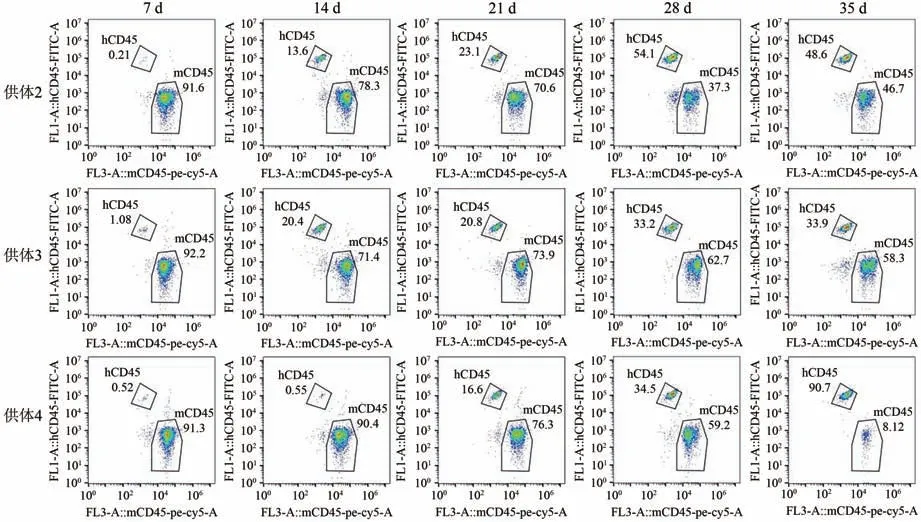
图5 每周采集NCG小鼠外周血进行流式动态监测Fig.5 The results of weekly flow dynamic monitoring of NCG mice peripheral blood
3 讨论
在肿瘤免疫治疗药物的研发中,药物筛选及药效研究需要大量的模型动物,而重度免疫缺陷小鼠的价格较贵,通过提高模型构建成功率及应用转化率可以大大节约成本。但是影响免疫系统人源化小鼠模型构建成功的因素很多,如构建方法、免疫缺陷小鼠品系、性别及饲养、免疫细胞的供体、数量和细胞状态等,本研究通过实验,总结出一些经验,现从以下几个方面进行讨论。
3.1 免疫系统人源化小鼠模型构建方法的选择
目前用于人源化免疫系统重建的免疫细胞主要有人CD34+造血干细胞(Hu-CD34+HSC)和人外周单个核细胞(Hu-PBMC),根据免疫系统人源化小鼠模型免疫细胞来源和构建方法的不同,可以分为Hu-CD34+模型、Hu-BLT模型和Hu-PBL模型[3]。
Hu-CD34+模型是将来源于人外周血、骨髓、胎儿肝脏和脐带血等CD34+造血干细胞注射入经辐照处理的新生和成年免疫缺陷小鼠,以实现T细胞、B细胞、髓系及NK细胞的发育。该模型的免疫细胞和造血系统是由小鼠体内发育而来,对其宿主具有免疫耐受性,通常不会发生GVHD反应,实验窗口期最长可达45周[4],适用于长期研究。但是该模型重建周期较长,通常需要8~12周,且T细胞数量较少、活性较低、髓系细胞发育受限[5-6]。
Hu-BLT模型是将胎儿肝脏和胸腺组织移植入经辐照处理的成年免疫缺陷小鼠肾包膜下,再将来源于同一个体胎儿肝脏或骨髓的造血干细胞静脉注射入该小鼠体内,该模型提供了人的胸腺微环境,使得人T细胞的发育和对人MHC分子成为可能[3]。Hu-BLT小鼠具有完整的免疫系统并且能产生人源性的适应性免疫应答,是模拟人免疫系统最完善的小鼠模型,但是存在胎儿肝脏和胸腺来源受限、构建难度极大、可诱发GVHD反应等缺点,使其研究和应用受到极大的限制[2,5]。
Hu-PBL模型通过将人PBMCs以静脉或腹腔注射的方式移植入成年免疫缺陷小鼠,以实现外周血和脾脏中人CD45+T细胞的植入和增殖。PBMC移植后人T细胞增殖速度快,重建水平高且稳定,通常2~3周时检测外周血中人CD45+T细胞可超过25%,该模型构建方法简单、耗时短、成本相对其他模型较低,是免疫治疗短期研究的理想非临床动物模型,被广泛应用于肿瘤免疫治疗研究中[7-10]。Lin等[11]研 究表明Hu-PBL模型评估PD-L1/PD-1靶向免疫治疗不仅耗时短且更准确,是研究PD-L1/PD-1靶向抗肿瘤疗效的宝贵工具。
3.2 免疫缺陷小鼠的选择
小鼠的异种移植成功与否与受体的免疫屏障状态关系密切,受体免疫缺陷程度越高,供体细胞发生免疫排斥的几率越低,移植成功率越高。目前应用较广泛的免疫缺陷小鼠品系包括NOG/MNSG/NPG/NCG(NOD-SCID IL2rg-/-)、NRG(NODRag1-/-IL2rg-/-)、BRG(BALB/cA-Rag2-/-IL2rg-/-)和NPG-B2M。
在选择免疫缺陷小鼠品系时首先要考虑遗传背景,如白细胞介素2受体γ链具有重要免疫功能的细胞因子IL-2、IL-4、IL-7、IL-9、IL-15和IL-21的共同受体亚基,该基因敲除后小鼠机体免疫功能严重受损,通过多种受体阻断细胞因子信号传导,导致功能性NK细胞缺陷。重组激活基因Rag1和Rag2在免疫球蛋白(Ig)基因和T细胞受体(TCR)基因的重排和重组过程中发挥重要作用,是B细胞和T淋巴细胞成熟过程的必需阶段,任意一个缺失都会导致T、B淋巴细胞发育中断,表现为严重的T/B细胞早期发育阻滞,进而不能产生成熟的T、B淋巴细胞。B2M基因编码的β2微球蛋白是MHCⅠ类分子的亚基,MHCⅠ类分子介导的T细胞反应在异种排斥反应中起重要作用,B2M基因敲除后,小鼠细胞表面不再表达MHCⅠ类分子,GVHD显著减弱[12]。遗传基因的改变会直接影响免疫系统的组成成分、免疫细胞泄露程度、寿命、辐照敏感度及繁殖能力。因此,在选择免疫缺陷小鼠品系时应综合考虑各种因素。
其次,免疫缺陷小鼠的性别也是影响免疫系统重建的重要因素之一。Faiyaz等[13]研究结果表明,受体性别在人造血干细胞移植和增殖过程中起着关键性作用,雌性NSG小鼠比雄性NSG小鼠人CD45+造血细胞的重建效果更好。Volk等[14-15]研究表明,在造血干细胞移植后0~12周雌性小鼠比雄性小鼠初始T细胞水平高,16周左右雄性小鼠成熟T细胞表现出更高的发育水平,20周以后外周血中人CD45+细胞、初始T细胞和记忆T细胞在不同性别之间达到平衡。总体来说,雌性小鼠在免疫细胞发育和成熟方面比雄性小鼠更有优势,表现出更高水平的重建效率[16-17]。
3.3 免疫细胞的选择
免疫细胞的供体、数量和细胞状态也是影响人源化免疫系统重建的重要因素。有研究发现,不同供体的免疫细胞在同一小鼠品系的重建速度、重建水平及移植后免疫细胞发育和成熟的情况不同,不同供体构建的免疫系统人源化小鼠模型对同一免疫检查点抑制剂反应也不同[18-19]。
人源化免疫系统的重建需要合适数量的免疫细胞,过多或过少均会影响重建效果。CD34+HSC细胞移植数量过多可能会导致贫血,PBMC细胞移植过多可能会加速GVHD反应,而移植数量过少可能会降低重建率甚至会造成重建失败。一般情况下,CD34+HSC细胞移植数量为1.0E+4 cells~2.0E+5 cells,PBMC细胞移植数量为5.0E+6 cells~2.0E+7 cells[16]。
选择新鲜采集还是超低温保存的免疫细胞,对于人源化免疫系统重建没有明显影响[4],但是免疫细胞的存活率及结块率却是影响重建效率的关键因素。因此,将预先筛选好的供体先超低温保存,重建时再进行复苏,可以提高重建成功率。
综上所述,在构建免疫系统人源化小鼠模型时,应该从构建方法、免疫缺陷小鼠品系、性别和饲养、免疫细胞的供体、数量和细胞状态等各个方面进行考虑,通过采用多种供体克服差异性,优化肿瘤模型和免疫细胞供体联合接种方案最大化利用窗口期[20]等策略提高模型构建成功率及应用转化率,使实验室免疫系统人源化小鼠模型构建方法进一步完善。近年来,免疫系统人源化小鼠模型被广泛应用于免疫检查点抑制剂的临床前研究中,除了已应用于临床的PD-1/PD-L1和CTLA-4,也发现不少新的免疫检查点,这些新的免疫检查点很大程度上会选择免疫系统人源化小鼠模型进行临床前研究,未来本实验室会进一步研究肿瘤模型和免疫细胞供体联合方案,开发出更多的免疫系统人源化肿瘤模型,以期为肿瘤免疫疗法提供更有利的药物研发工具。

