宿主膜联蛋白A2与伪狂犬病病毒US3蛋白互作及其对细胞凋亡的影响
郭振华,李 翔,翁茂洋,金前跃,郭军庆,邢广旭,张改平,,3*
(1.河南省农业科学院动物免疫学重点实验室,郑州 450002; 2.西北农林科技大学动物医学院,杨凌 712100;3.江苏高校动物重要疫病与人兽共患病防控协同创新中心,扬州 225009)
伪狂犬病病毒(pseudorabies virus,PRV)是具有囊膜的双链DNA病毒,基因组大小约140 kb,编码至少70个蛋白,属于α-疱疹病毒亚科(Alphaherpesvirinae),水痘病毒属(Varicellovirus)[1]。猪是PRV的唯一自然宿主,PRV感染猪后引起的疾病称为伪狂犬病(pseudorabies, PR),常见的临床表现包括母猪繁殖障碍、仔猪神经症状以及中大猪呼吸道症状等[2-3]。PRV在我国猪群中具有较高的流行率,是危害我国养猪业的重要病原之一。此外,PRV还可感染狗、猫、牛、羊、狐狸、水貂和狼等多种动物,具有很广的感染谱,且除了猪以外,其他动物多在感染后24~48 h内死亡[4]。
US3 蛋白是丝氨酸/苏氨酸蛋白激酶,存在于所有的α-疱疹病毒亚科成员中,也是PRV的一个重要毒力蛋白[5]。研究显示,US3可以诱导丝切蛋白(cofilin)去磷酸化和RhoA 蛋白的磷酸化,从而影响细胞骨架重排[6-7];可以通过降解Bcl-2 相关转录因子1(Bcl-2 associated transcription factor 1,Bclaf1)和诱导IRF3 的高度磷酸化来抑制Ⅰ型干扰素信号[8];通过激活PI3-K/Akt和NF-κB 信号通路来调控抗凋亡基因的表达等[9]。但目前对US3参与的生物学过程及其分子机理的揭示还很有限,有必要深入发掘鉴定新的和US3互作的宿主蛋白,从而进一步拓展对US3 生物学功能的认知。
膜联蛋白A2(annexin A2,ANXA2)是一个具有多种生物学功能的钙磷脂结合蛋白,参与囊泡转运、细胞骨架膜动力学和信号转导等多个生物学过程[10-11]。在病毒感染过程中也发挥着重要作用,有报道显示,ANXA2可以和猪繁殖与呼吸综合征病毒(PRRSV)的Nsp9互作,从而促进PRRSV在MARC-145细胞上的增殖[11];ANXA2还可以和宿主波形蛋白(vimentin)互作,来促进PRRSV和猪圆环病毒2型(PCV2)的复制[12];ANXA2可以和猪瘟病毒(CSFV)NS5A和E2蛋白互作,促进CSFV在PK-15细胞上的增殖[13]。但目前尚没有针对ANXA2是否影响PRV复制增殖的相关研究报道。
本研究中,作者通过免疫共沉淀和pull-down分析验证了US3和ANXA2的相互作用,发现抑制ANXA2的表达可以显著影响PRV的增殖,过表达ANXA2对PRV和凋亡刺激剂诱导的细胞凋亡具有负调控作用。
1 材料与方法
1.1 材料
PK-15细胞和3D4/21细胞由本实验室保存;PRV毒株HeNLH/2017(GenBank:MT775883)由本实验室从临床病料中分离鉴定[3];小干扰RNA由上海吉玛公司合成,引物由生工生物工程(上海)股份有限公司合成;pEGFP-C1、pEGFP-N1和pCMV-3xflag质粒由本实验室保存;pEGFP-US3、pEGFP-ANXA2、pCMV-3xflag-US3、pCMV-3xflag-A2和pEASY-Blunt-UL54重组质粒由本实验室构建并保存;Flag亲和磁珠购自ThermoFisher Scientific公司,GFP-Trap磁珠购自ChromTek公司;PRV gE蛋白单克隆抗体由本实验室制备、保存。
1.2 试剂
无内毒素质粒提取试剂盒购自康为世纪生物科技有限公司;转染试剂Lipofectamine 2000购自Invitrogen公司;Q5超保真酶和限制性内切酶购自NEB公司;核酸提取试剂Mini Best Virus DNA/RNA Extraction kit和反转录试剂Prime ScriptTMRT reagent kit购自TaKaRa公司;TRIzolRReagent购自索莱宝生物科技有限公司;RIPA细胞裂解液和细胞凋亡刺激剂(apoptotic stimulator)购自碧云天生物技术公司;ECL超敏化学发光液(P10300)购自新赛美公司;SYBR Green荧光定量试剂购自Roche公司;ProteoSilverTMStain Kit银染试剂购自Sigma公司;GFP抗体(D5.1)、ANXA2抗体(D11G2)、Caspase-3抗体和Cleaved Caspase-3抗体购自Cell Signaling Technology公司;Flag抗体和β-tubulin抗体购自Abbkine公司;AnnexinV-APC/PI细胞凋亡检测试剂盒购自凯基生物公司。
1.3 US3潜在互作蛋白发掘
pEGFP-N1和pEGFP-US3分别转染PK-15细胞,24 h后收取蛋白样品,并用GFP-Trap磁珠进行pull-down,制备的蛋白样品跑SDS-PAGE,按照 ProteoSilverTMStain Kit银染试剂的说明书进行银染,待加入终止液后,在白色背景板下比较银染后的pEGFP-N1和pEGFP-US3组的样品条带,用干净刀片切取差异性条带,送生工生物工程(上海)股份有限公司进行LC-MS质谱分析。
1.4 免疫共沉淀和pull-down分析
pEGFP-ANXA2、pEGFP-N1、pCMV-3xflag和pCMV-3xflag-US3分别进行两两组合,转染HEK 293T细胞,转染36 h后,用Flag亲和磁珠和GFP-Trap磁珠分别进行免疫共沉淀分析。取pCMV-3xflag和pCMV-3xflag-US3质粒转染PK-15细胞,36 h后收取蛋白样品,用Flag亲和磁珠进行pull-down,用ANXA2和Flag抗体进行免疫印迹分析。
1.5 荧光定量RT-PCR
利用TRIzolR法分别提取RNAi对照组和处理组细胞的总RNA,然后进行反转录获得cDNA,以获得的cDNA为模板,通过检测ANXA2和内参基因GAPDH的mRNA含量来验证ANXA2在转录水平的敲低效果;利用绝对荧光定量PCR评估敲低ANXA2的表达对PRV基因组复制的影响,按照病毒DNA/RNA提取试剂盒的说明书进行RNAi对照组和处理组病毒核酸的提取。然后以pEASY-Blunt-UL54质粒标准品建立标准曲线,用建立的针对PRVUL54基因的荧光定量PCR进行扩增,并根据标准曲线计算基因的拷贝数,用来代表各组中PRV DNA的含量。具体的引物和siRNA序列见表1。

表1 引物和siRNA序列信息
1.6 病毒滴度测定
采用半数细胞培养物感染量(50% tissue culture infective dose,TCID50)来进行测定,将PK-15 细胞以1.0 ×104个细胞·孔-1铺于 96 孔板,待每个孔的单层细胞长至 90%的丰度时,弃去上清培养基,用PBS润洗3次;然后加入用DMEM细胞维持液(含2.0%FBS)10倍倍比稀释的病毒液样品,获得稀释度依次为 10-1~10-10的待测病毒稀释液;96 孔板的第一列对应 10-1稀释度的混合液,第二列对应10-2稀释度的混合液,依次类推,最后两列作为空白组,加入无病毒液的维持液,每个稀释度设8个重复。置于细胞培养箱,培养3~5 d,期间在显微镜下观察PRV感染引起的细胞病变情况,记录每个稀释度发生细胞病变的孔数,用 Reed-Muench 法计算TCID50。
1.7 Western blot分析
利用RIPA细胞裂解液收取细胞蛋白样品,制备的蛋白样品经变性处理后,取适量加到12.0%变性蛋白预制胶上样孔中进行电泳(SDS-PAGE),然后经过转印将蛋白转移至硝酸纤维素膜,用5.0%的脱脂奶粉(0.5%PBST配制)对膜进行室温封闭2 h,接着分别用特异性的一抗或二抗(见“1.2”)继续室温孵育1 h,最后将配制的ECL超敏化学发光液均匀加到PVDF膜上,置于凝胶成像扫描仪调整合适的曝光时间进行观察。
1.8 流式细胞术
PRV感染或者凋亡刺激剂刺激PK-15细胞,在指定时间点收取细胞,并用PBS进行悬浮,按照说明书用Annexin V-APC/PI对细胞进行避光染色5 min,然后使用Beckman CytoFLEX设备进行流式细胞检测分析,所有数据使用CytExpert软件进行分析处理。
1.9 数据统计
荧光定量PCR/RT-PCR、病毒滴度测定和细胞凋亡的流式分析试验均进行了3次重复,各组数据用GraphPad Prism软件中的t检验或者ANOVA方法进行统计学差异性分析。P<0.05(*)表示差异显著,P<0.01(**)表示差异极显著,ns表示无显著差异。
2 结 果
2.1 US3潜在互作蛋白筛选
通过蛋白pull-down、银染和串联质谱(LC-MS)分析,发现了多个与PRV US3蛋白具有潜在相互作用的宿主蛋白(表2)。

表2 LC-MS质谱分析结果
2.2 ANXA2与PRV US3的相互作用
pEGFP-ANXA2与pCMV-3xflag-US3,pEGFP-N1与pCMV-3xflag-US3,pEGFP-ANXA2与pCMV-3xflag分别共转染HEK 293T细胞,收取蛋白样品后,用Flag亲和磁珠或GFP-Trap磁珠分别进行免疫共沉淀分析。结果如图1所示,Flag亲和磁珠进行免疫沉淀分析时,可以检测到特异的GFP-ANXA2条带(图1A);GFP-Trap磁珠进行免疫沉淀分析时,可以检测到特异性的Flag-US3条带(图1B)。进一步用pCMV-3xflag和pCMV-3xflag-US3质粒转染PK-15细胞,36 h后收取蛋白样品,用Flag亲和磁珠进行pull-down,分别用ANXA2和Flag抗体进行免疫印迹分析,结果显示,US3可以和内源性的ANXA2发生特异的相互作用(图1C)。

A、B.免疫共沉淀验证外源性ANXA2和US3的互作;C.Pull-down分析US3和内源性ANXA2的互作
2.3 敲低ANXA2的表达抑制PRV的增殖
PK-15细胞转染小干扰RNA 36 h后,用相对荧光定量PCR和免疫印迹法检测ANXA2转录和表达的抑制效果,结果如图2A和B所示,Si ANXA2-670#序列对的基因沉默效果最好,选择该序列进行后续的试验。为进一步验证ANXA2对PRV增殖的影响,PK-15细胞转染Si NC和Si ANXA2-670# 36 h后,用PRV进行感染(MOI=0.1),在指定的时间点收取样品,通过分析基因拷贝数、病毒滴度和gE蛋白的表达水平(图2C~E),结果发现,与Si NC组相比较,敲低ANXA2的表达后显著抑制了PRV在PK-15细胞上的复制增殖。

A、B. qRT-PCR和免疫印迹评估ANXA2的敲低效果;C. 病毒基因含量的检测;D. 病毒滴度(TCID50)的检测;E. 病毒蛋白表达水平分析;*. P<0.05, **. P<0.01, ***. P<0.001, ns. P>0.05
2.4 PRV感染可以诱导细胞凋亡
细胞凋亡是宿主细胞抵抗各种病原微生物感染的关键防御机制,作者分析了PRV感染对细胞凋亡的影响。结果如图3所示,3D4/21细胞(图3A)和PK-15细胞(图3B)感染PRV(MOI=0.1)的指定时间点收集蛋白样品,通过免疫印迹检测显示,与对照组相比,凋亡效应蛋白Caspase-3发生了明显的活化剪切;进一步的利用流式细胞仪检测Annexin V和PI染色细胞情况,发现PRV感染后,Annexin V和PI双染的晚期凋亡细胞明显增多(图3C)。这些结果表明,PRV感染宿主细胞后会诱导细胞凋亡的发生。
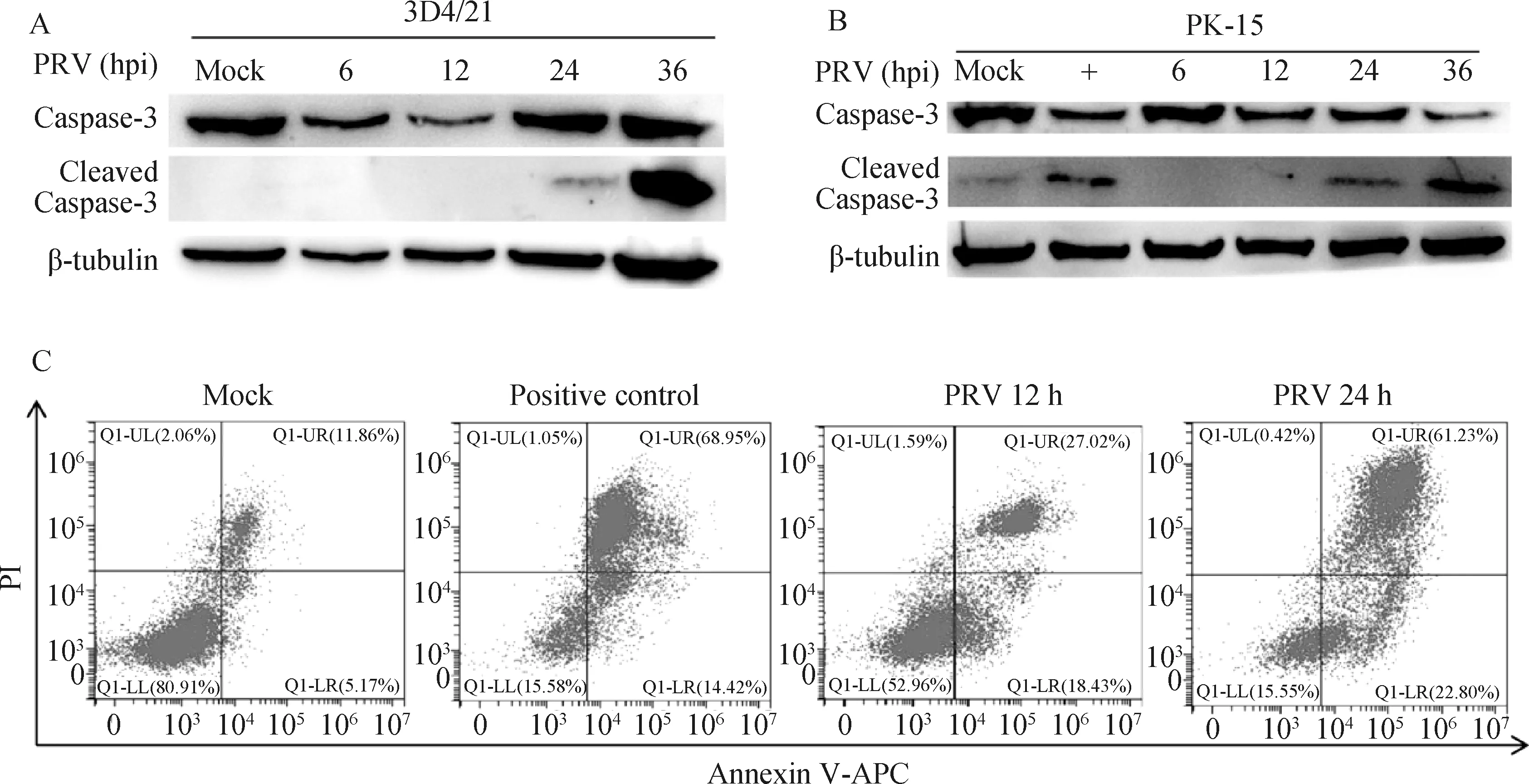
A、B. Western blot分析caspase-3剪切体蛋白水平的变化;C. 流式细胞术分析细胞凋亡情况
2.5 ANXA2参与了PRV诱导的细胞凋亡调控
有研究报道ANXA2可以抵抗X射线辐射诱导的细胞凋亡[14],但ANXA2是否参与了病毒感染诱导的细胞凋亡调控尚不清楚。在PK-15细胞上分别过量或敲低ANXA2的表达,然后用PRV进行感染(MOI=0.1)24 h,收取蛋白样品进行免疫印迹分析。其中PRV US3蛋白是已知的具有抑制细胞凋亡的作用,作为阳性对照。结果显示,在过表达ANXA2的条件下(图4A),ANXA2对PRV诱导的细胞凋亡显示出了明显的抑制效应;而敲低ANXA2的表达后(图4B),则对PRV诱导的细胞凋亡具有显著的促进作用。

A. 过表达ANXA2抑制PRV感染诱导的细胞凋亡;B. 敲低ANXA2的表达促进PRV感染诱导的细胞凋亡
2.6 ANXA2对凋亡刺激剂诱导细胞凋亡的影响
为进一步验证ANXA2对细胞凋亡的影响,同样在过表达或敲低ANXA2表达的条件下,用凋亡刺激剂刺激PK-15细胞10 h,然后收集样品用对应的抗体进行免疫印迹分析。结果如图5A和B所示,ANXA2对凋亡刺激剂诱导的细胞凋亡具有显著的抑制作用。

A. 过表达ANXA2抑制凋亡刺激剂诱导的细胞凋亡;B. 敲低ANXA2的表达增强凋亡刺激剂诱导的细胞凋亡
2.7 流式细胞术分析ANXA2对细胞凋亡的影响
PK-15细胞在ANXA2敲低或过表达的条件下,用凋亡刺激剂刺激2 h后,收取细胞用Annexin V-APC/PI凋亡检测试剂盒对细胞进行染色,然后进行流式细胞仪检测。结果如图6A和B所示,敲低ANXA2的表达对凋亡刺激剂诱导的细胞凋亡呈现出促进效应,而过表达ANXA2的条件下,则表现出显著的抑制细胞凋亡的效应。
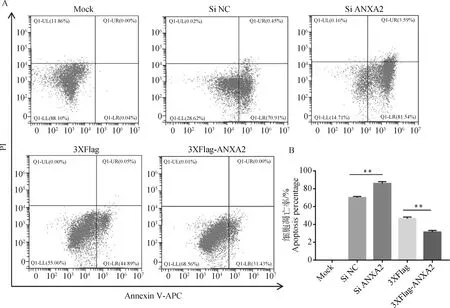
A. 过表达ANXA2抑制凋亡刺激剂诱导的细胞凋亡;B. 敲低ANXA2的表达增强凋亡刺激剂诱导的细胞凋亡。**.P<0.01
3 讨 论
US3蛋白激酶是一个在α疱疹病毒中高度保守的蛋白,已有的研究显示US3蛋白参与了细胞骨架重排、免疫调控和细胞凋亡等多个生物学过程,是PRV进入细胞后的入核和出核过程的重要调控蛋白[8,15-16]。关于US3互作蛋白的筛选鉴定将有助于更好地理解US3蛋白的生物学功能,如Jansens等[5]利用磷酸化组学分析了过表达US3的条件下对宿主蛋白磷酸化的影响,鉴定发现了14个显著去磷酸化的蛋白和64个显著磷酸化的蛋白。在前期试验中,通过在PK-15细胞过表达GFP-US3蛋白,然后利用GFP-Trap磁珠pull down,结合银染和蛋白质谱技术(LC/MS),发现宿主ANXA2是一个潜在的与US3互作蛋白。在本研究中,作者通过免疫共沉淀技术和pull-down技术进一步验证了ANXA2和US3的相互作用。ANXA2作为一个新鉴定的和US3互作的宿主蛋白,拓展了对US3蛋白作用底物的认识,其具体行使的生物学功能及分子机制还有待进一步深入研究。
ANXA2在PRV感染过程中的作用尚不清楚。有研究显示,PRV感染神经细胞后,可以刺激轴突处局部的蛋白合成,丰度较高的蛋白有ANXA2 和外周蛋白 (peripherin),这些蛋白参与了PRV在神经细胞的逆向转运过程[17]。在对PRV病毒粒子包含宿主蛋白成分的鉴定研究中,也发现了ANXA2存在于成熟的病毒粒子中[18]。本研究中,作者利用小RNA干扰技术来抑制ANXA2的表达,发现敲低ANXA2的表达,可以显著抑制PRV在PK-15细胞上的复制增殖。结果提示ANXA2在PRV复制增殖的过程中发挥着一定的作用。
细胞凋亡是宿主细胞抵抗各种病原微生物感染的重要防御机制之一[19-20]。有报道显示,US3可以通过激活PI3-K/Akt和NF-κB 信号通路来抑制PRV感染诱导的细胞凋亡[9];而也有报道显示,在P53基因诱导的凋亡过程中,ANXA2的表达受到显著抑制,ANXA2也可以抵抗X射线诱导的细胞凋亡[10]。本研究中,作者通过免疫印迹和流式细胞术,验证了过表达ANXA2对PRV和凋亡刺激剂诱导的细胞凋亡的影响,确定了ANXA2具有负调控细胞凋亡的作用,但其具体的分子机制尚需要进一步的研究证实。
4 结 论
ANXA2是一个新的可以和PRV US3蛋白相互作用的宿主蛋白,PRV的复制增殖需要ANXA2的参与,ANXA2具有负调控细胞凋亡的作用。

