引导编辑系统的研究与应用进展
邹惠影,李俊良,朱化彬
(中国农业科学院北京畜牧兽医研究所,北京 100193)
随着生命体基因组序列的揭示及生物信息学的发展,对基因组上的碱基进行精确改造一直是生命科学领域重要的研究课题。第三代基因编辑技术CRISPR/Cas9(clustered regularly interspaced short palindromic repeats/CRISPR associated 9)系统是继TALEN、ZFN之后的又一重大突破,它的出现开启了基因编辑的新时代,在生物医学、农林畜牧等方面展示出了巨大的应用前景。
CRISPR/Cas9系统由Cas9核酸酶和单向导RNA(single guide RNA,sgRNA)组成,sgRNA招募Cas9蛋白结合到靶位点,Cas9识别靶位点下游的 PAM(protospacer adjacent motif, PAM)基序,并对PAM上游3~5 nt进行切割,产生DNA双链断裂,诱发细胞启动修复机制,发生非同源末端连接(non-homologous end joining, NHEJ),该过程可引入片段的插入或缺失;或在供体DNA存在下发生同源介导修复(homology-directed repair, HDR),进行精确修复[1-3]。由于CRISPR/Cas9系统的操作简单及高效编辑,该系统已经在动物、植物和微生物中进行广泛应用,包括遗传育种、特定遗传性疾病的修复、潜在药物靶标的验证和全基因组筛选挖掘基因生物学功能[4-6]。科研工作者将CRISPR/Cas9系统分别与胞嘧啶脱氨酶和腺嘌呤脱氨酶整合,发明了高效诱导单碱基编辑的单碱基编辑系统,包括胞嘧啶单碱基编辑器(cytosine base editor, CBE)[7]和腺嘌呤单碱基编辑器(adenine base editor, ABE)[8]。CBE能够将C/G向T/A转变,而ABE则可将A/T转变成G/C。然而,单碱基编辑器会在高效编辑单碱基的同时产生严重的脱靶突变,并且不能实现碱基之间的颠换(A-T或C-G)[9-10]。
引导编辑 (prime editing, PE) 系统是基于CRISPR/Cas9系统新研发出的一项靶基因修饰技术,在无需供体DNA存在下可以实现任意碱基的互换、短片段的插入和缺失,是基因修饰强有力的工具,将基因编辑提升了一个新的水平[11]。PE系统将会在精准育种、纠正致病性的遗传突变和构建动物疾病模型等方面有广阔的应用前景。
1 引导编辑系统的概况及特点
2019年,Anzalone等[11]开发了“search and replace”全新基因编辑技术-prime editing系统,被Nature 杂志评论是“超精确的新型基因编辑工具”。PE系统包括Cas9切口酶(Cas9 nickase,nCas9)、反转录酶(reverse transcriptase,RT)和引导编辑向导RNA(prime editing guide RNA,pegRNA),其中nCas9与RT融合在一起。pegRNA包括引导nCas9结合靶位点的spacer(sgRNA)、primer binding site (PBS)和目标序列(RT以此序列为模板将新的遗传信息写进基因组里,被称为RT模板)。pegRNA引导nCas9-RT复合体结合到基因靶位点,nCas9在PAM序列上游3 nt产生切口,切割链3′端与PBS互补结合,之后RT以RT模板进行延伸合成新的碱基信息(图1)。携带3′ 端编辑Flap的编辑产物与携带5′端非编辑Flap的产物稳定平衡,其中5′端非编辑Flap被核酸酶切除可以获得一条编辑链和一条非编辑链的产物,在细胞修复后最终获得稳定编辑的DNA。
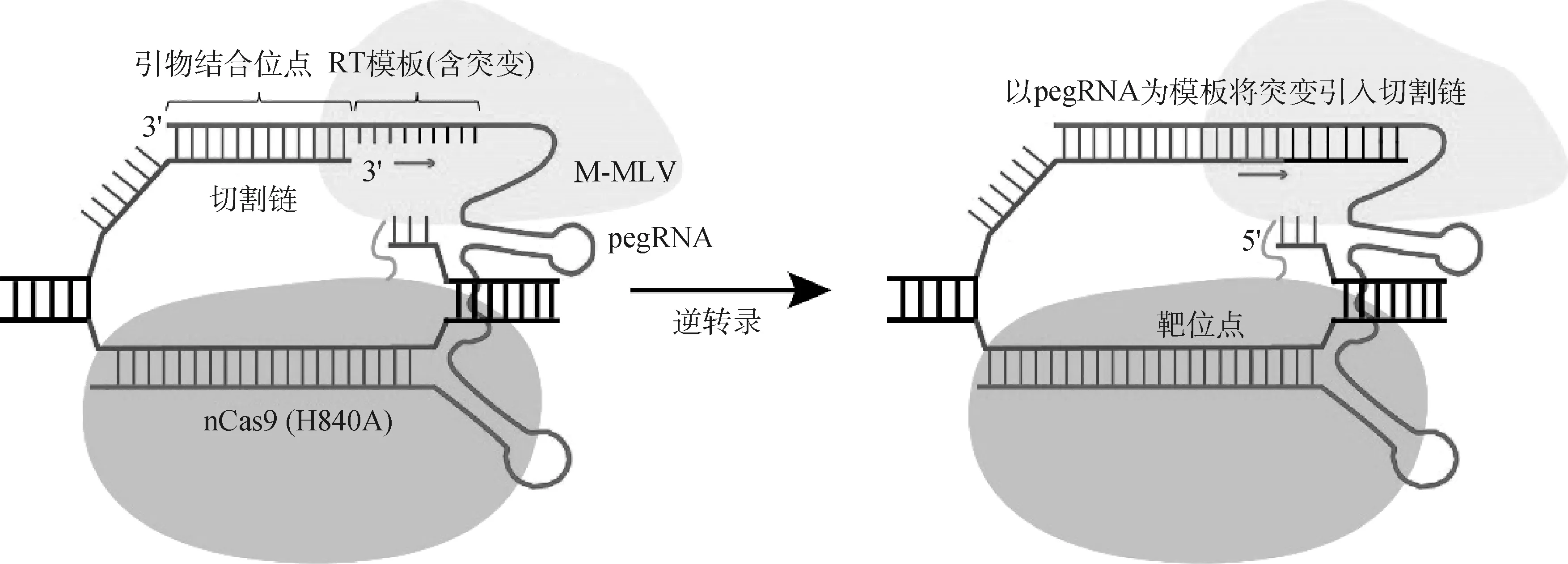
图1 引导编辑系统的构成及工作模式
PE系统不需要供体DNA,并且不需要产生双链断裂(double-strand breaks, DSB),即可实现碱基之间的自由替换及目标位点碱基精确插入与删除(插入的碱基长度可达44 bp,删除的碱基长度可达80 bp)[11]。与单碱基编辑系统相比,对于位于单碱基编辑器编辑窗口(4~8 nt)的CG或AT, PE系统在大部分位点的编辑效率较低,并且会引入更多的插入缺失突变。但是在精准度方面,PE系统能准确编辑目标碱基,而单碱基编辑器在编辑窗口有多个可编辑的CG或AT的情况下会产生多种编辑产物,其中只编辑目标碱基的产物占比较少。对于小片段插入和缺失的精确编辑,与CRISPR/Cas9介导的HDR相比,PE系统不需要供体DNA,产生更少的由于DBS诱发的插入缺失突变,而编辑效率与HDR相近(表1)。

表1 PE系统、BE系统和HDR的比较
2 引导编辑系统的优化
为了提高PE系统的编辑效率,Anzalone等[11]对Prime编辑器(prime editor,PE)进行了优化与改进。在PE1中,莫洛尼鼠白血病病毒逆转录酶(moloney murine leukemia virus reverse transcriptase,M-MLV RT)与nCas9(H840A)的C端连接,并在同一个质粒中表达。PE1介导的单碱基替换效率依赖PBS的长度,编辑效率为0.7%~5.5%;PE1介导的碱基的插入与缺失效率为4%~17%。为了提高M-MLV RT的耐热性、持续合成能力和DNA/RNA结合能力,研究者在M-MLV RT中引入5个突变(D200N/L603W/T330P/T306K/W313F),将单碱基突变效率提高了1.6~5.1倍,这个改造后的系统被称为PE2[11]。研究表明,在非编辑链引入一个切口可以促使以编辑链为模板进行DNA修复,从而提高编辑效率,因此,在PE2的基础上,引入一个经典sgRNA与靶位点结合,引导nCas9在非编辑链产生切口,突变效率提高了3倍,这个系统被称为PE3[11]。研究显示,非编辑链切口距离编辑链切口约50 bp时的编辑效率较高。如果设计的sgRNA只能与编辑后序列匹配,与原序列不匹配,那么nCas9会在编辑链Flap拆分之后才在非编辑链产生切口,这样可以减少产生非必要的脱靶突变,这种设计策略被称为PE3b[11]。
为了进一步提高PE系统的编辑效率,Chen等[12]进行了CRISPR干扰(CRISPR interference, CRISPRi)筛选,发现DNA错配修复(DNA mismatch repair, MMR)相关基因抑制了PE的效率,并促进产生indel副产物。为解决这一问题,他们尝试与PE系统共表达MMR通路相关基因显性负性突变体(dominant negative MLH1, MLH1 dn),结果显示MLH1 dn能有效增强PE的基因编辑效率。PE2与MLH1 dn的组合被称为PE4,PE3与MLH1 dn的组合称为PE5。与相应的PE2和PE3相比,PE4和PE5的编辑效率分别提高了7.7倍和2倍,并且目标编辑产物的纯度提高了3.4倍[12]。之后,Da Silva等[13]也得出MMR能够抑制PE系统的结论;通过消除MMR,PE系统的效率提高了2~17倍。
除此之外,科研工作者还在扩展PE系统的编辑范围(删除和插入)、nCas9-MMLV融合蛋白的结构、pegRNA的设计、PE系统的递送、抗药性筛选和报告系统富集编辑细胞等方面对PE系统进行优化。
Jiang等[14]和Choi等[15]在PE系统基础上分别研发了PE-Cas9-based deletion and repair (PEDAR)和PRIME-Del工具。这两种工具都是用Cas9蛋白替换PE系统中的nCas9,并且在插入/删除位置的上、下游设计一对pegRNA,借助细胞修复过程中微同源介导的末端连接(microhomology-mediated end joining,MMEJ)或单链退火(single strand annealing,SSA)途径完成修复。PEDAR被验证可以精确进行60 bp的插入和大于10 kb片段的删除;PRIME-Del被验证可以精确进行大于10 kb片段的删除,在基因治疗领域和基础生物学蛋白质功能研究等方法中有潜在的应用。随后,Anzalone等[16]开发了twin prime editing (twinPE)工具,包括原始PE系统的PE蛋白和两个pegRNA。twinPE能够高效进行108 bp的插入和818 bp的删除。另外,twinPE结合Bxb1 整合酶可以在基因组特定位点整合5.6 kb的片段和纠正长达40 kb的基因倒置。twinPE工具的pegRNA在基因组的不同靶位点产生单链缺口,相比较PEDAR 和PRIME-Del会产生更少的副产物。最近,Wang等[17]开发了GRANDE diting系统,利用一对特殊设计的pegRNA实现长达1 kb DNA片段的靶向插入。
Liu等[18]在SpCas9与M-MLV序列的N端和C端添加了c-Myc NLS和SV40 NLS,构成了PE2*;用SaCas9和SaCas9KKH变体替换SpCas9,构成了SaPE2*和SaKKHPE2*。经检测,在小鼠转基因和内源基因的碱基替换、插入、缺失编辑过程中,PE2*的效率都要高于PE2的编辑效率;SaPE2*在一些位点编辑效率与PE2*相差不多,但是SaKKHPE2*的编辑效率一直较低。Xu等[19]构建了PE-P2,利用自切割多肽2A串联表达PE系统和筛选标记,并采用强化的sgRNA,使水稻基因组中靶位点突变效率提高了22倍(从1.2%到26%)。该团队还发现,在RT模板中引入同义错配碱基和nCas9的C端融合M-MLV均可提高PE系统的编辑效率。将这两种策略组合使用时,出现了倍增协同效应,PE系统在水稻中的平均编辑效率达到了24.3%,在玉米原生质中达到了6.2%,在人细胞中达到了12.5%[20]。Lu等[21]通过密码子优化和CaM35S启动子优化提高了PE系统的编辑效率。研究者还同时对nCas9-MMLV融合蛋白多个方面进行优化,构建出具有更强编辑效果的PEmax。这些优化包括MMLV的优化密码子、Cas9n突变体、Cas9n与MMLV添加连接序列和增加NLS序列[12]。
pegRNA的3′端延伸在PE系统工作时暴露在细胞中(未被融合蛋白包裹),容易被核酸酶降解。为解决这一问题,多个课题组通过对pegRNA的3′端添加RNA结构基序来增加pegRNA的稳定性,进一步提高了PE系统的编辑效率。这些结构基序包括G-quadruplex[22]、xrRNA[23]和tevopreQ1(trimmed evopreQ1)[24]等。添加tevopreQ1的epegRNA与MLH1 dn和 PEmax协同作用可显著提高编辑效率,其中PE4 max和epegRNAs在Hela细胞和HEK293T细胞中的编辑效率分别提高了72倍和3.5倍;PE5 max和epegRNAs在Hela细胞和HEK293T细胞中的编辑效率分别提高了12倍和1.6倍[12]。Li等[25]通过规律性引入同义突变和pegRNA骨架优化,开发了新型引导编辑系统sPE和aPE,提高了编辑效率。与PE3相比,sPE3的编辑效率平均提高353倍;aPE3的编辑效率平均提高2.77倍。另外,对pegRNA的优化还包括PBS和RT模板两方面。PBS和RT模板的长度与编辑效率没有绝对的对应关系,通常需要设计不同长度的PBS进行编辑尝试。研究工作者建议PBS的起始长度为13 nt,但是当编辑位点的G/C含量超出40%~60%时,可适当延长或缩短PBS长度。RT模板的建议起始长度为10~16 nt,并且RT模板与sgRNA骨架3′端连接的第一个碱基不能是C,否则编辑效率会降低。Lin等[26]从PBS与切割链结合的紧密程度入手研究,发现PE系统在PBS的Tm值为30 ℃时编辑效率最高,Tm值过低或过高都会影响编辑效率。他们还用双pegRNA策略对靶位点的双链分别产生切口和写入编辑序列,将编辑效率提高了1.8~4.2倍,并且没有产生额外的插入/缺失突变。采用优化的PBS结合双pegRNA策略,PPE系统在水稻中的效率提高了2.9~17.4倍。
科研工作者还尝试用piggyBac载体[27-28]、腺病毒载体[29]递送PE系统或者将PE系统构成一元载体[30]、将PE系统分离成多个载体[31]进行基因编辑。这些改进都能使PE系统发挥作用,拓展了PE系统的应用范围。Xu等[32]在PE系统中加入HPT抗性基因构建了pPE2、pPE3/3b,在水稻中对1个外源和3个内源基因进行小片段编辑,最高编辑效率达到31.3%,并将HPT-ATG回复突变加入到筛选过程中构建了surrogate PE2系统,该系统能够富集编辑细胞,不同程度提高编辑效率。另外,科研工作者还利用巧妙设计的报告系统富集编辑的细胞提高PE系统的编辑效率[33-34]。
3 引导编辑系统的应用
由于PE系统强大的编辑功能及普适性,其一经报道,便迅速在各种物种及各个研究领域进行了应用。下面详细讲述PE系统近期在动物和植物中的推广与应用(表2)。
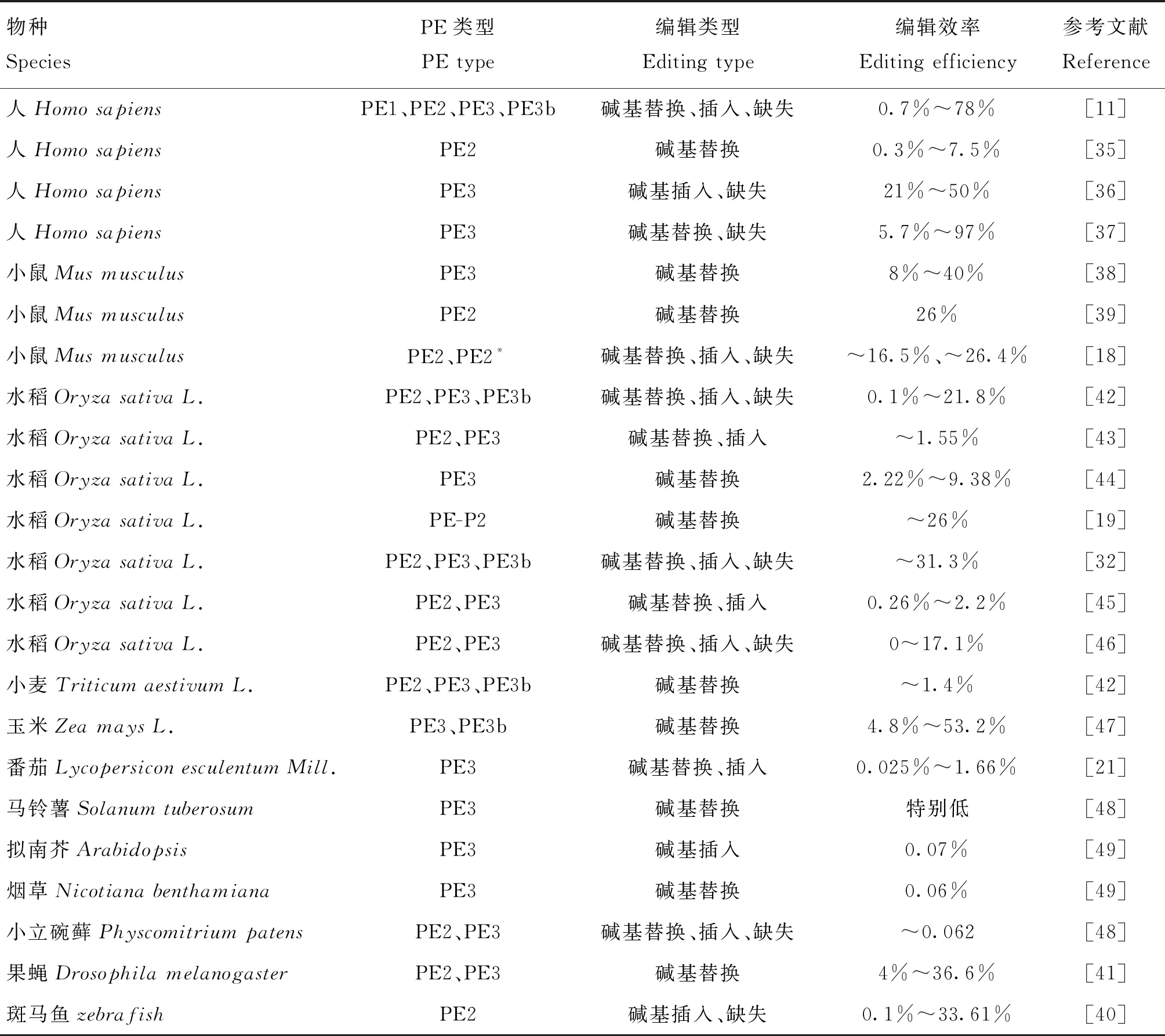
表2 PE系统的应用
3.1 引导编辑系统在动物中的应用
目前PE系统在人和小鼠中的应用较多。Anzalone等[11]利用优化后PE3在HEK293T细胞中进行了24种单碱基编辑,其中包括12种碱基的转换和颠换,平均编辑效率为(33±7.9)%。进而,科研工作者又利用PE3进行了小片段的插入和缺失编辑,1 bp和3 bp的插入效率分别为(32±9.8)%和(39±16)%;1 bp和3 bp的删除效率分别为(29±14)%和(32±11)%。PE3还被用于模拟镰刀型细胞贫血(AT-TA)、黑蒙性白痴(TATC插入)和朊病毒病(GC-TA)病因突变,并高效回复突变。并且,研究者还在K562、U2OS和Hela细胞及终端分化细胞原代小鼠皮层神经元中应用了PE3系统,发现均能成功编辑[11]。Sürün等[35]利用PE系统分别在HEK293T和hiPS细胞中进行GFP到CFP的编辑,编辑效率分别为0.3%~6.5%和7.5%左右,比BE系统在HEK293T(13%~47%)和hiPS细胞(80%)中的编辑效率低很多。Schene等[36]利用PE系统在人小肠和肝类器官中实现模拟与癌细胞相关CTNNB1基因6个碱基的删除,精确编辑效率为30%~50%,与2-D细胞水平的编辑效率相似。另外,该课题组还分别对DGAT1突变(第7外显子3个碱基缺失c.629_631 delCCT)病人来源的小肠类器官和患威尔逊病(ATP7B一个碱基的重复c.1288 dup)病人来源的肝类器官进行精确基因回复。与HDR相比,PE系统会产生更少的非必要插入缺失突变。Geurts等[37]在成体干细胞来源的结肠类器官和肝类器官中模拟了TP53的多种突变类型,其中在结肠类器官中的编辑效率最高为25%,在肝类器官中的最高达到97%。该课题组还比较了PE系统、ABE系统和CRISPR/Cas9介导的HDR三种编辑系统对CFTR-R785*突变的回复效率,结果显示PE系统编辑效率为0~5.7%,ABE为9.1%,CRISPR/Cas9介导的HDR为1.22%。PE系统的编辑效率介于碱基编辑器和CRISPR/Cas9介导的HDR之间,但是对于不在BE系统editing window的突变,PE系统是相对较好的选择。
Liu等[38]首次利用PE系统构建了人类并指畸形的小鼠模型。人类并指畸形致病变异是基因HOXD13两个碱基的颠换(G-C/G-T)。科研工作者在胚胎1-cell期显微注射PE系统mRNA,在囊胚期两种突变获得效率分别为8/18(44%)和12/16(75%);注射胚胎移植到代孕母亲体内获得突变小鼠的效率分别为8/30(27%)和2/19(11%)。突变胚胎和小鼠的高通量测序结果显示显微注射会导致突变嵌合。Gao等[39]分别利用PE系统和CRISPR/Cas9介导的HDR制备CArG box突变小鼠,该位点位于Tspan2启动子内,是转录因子结合位点,获得的小鼠在主动脉和膀胱检测不到Tspan2 mRNA的表达。PE系统和HDR获得正确编辑小鼠的效率分别为26%和54%。研究者发现,11只HDR小鼠在靶位点都有不同程度的插入突变(0.91%~93.91%),在10只PE鼠中没有检测到;在5只HDR鼠中检测到不同程度的脱靶突变(5.5%~60.2%),同样在PE鼠中没有检测到高于对照鼠的突变。Liu等[18]通过尾静脉注射方法在小鼠肝中对癌基因Ctnnb1进行突变,注射PE2*的小鼠肝产生更多的肿瘤。另外,他们还用Split-Intein内含肽介导分拆PE,并用AAV载体进行递送,成功对小鼠肝SERPINA1致病突变进行精确回复。
PE系统还被应用于其他模式动物。Petri等[40]利用PE系统对斑马鱼的基因组进行精确编辑,其中5 bp和10 bp删除效率为4.13%~33.61%,小片段的精确插入效率高达18%。另外,作者还成功在斑马鱼中制备了两个基因的致病变体TYR P301L和KRAS G12V,并通过生殖系传递给后代。Bosch等[41]在果蝇中也成功应用了PE系统,经检测在S2R+细胞中,PE系统编辑效率约为4%~8%;通过转基因杂交和胚胎注射也能有效编辑果蝇生殖细胞,其中转基因杂交获得生殖系传递正确编辑效率最高为36%,胚胎注射为5.3%。研究表明,在大部分动物基因组编辑过程中,PE3的编辑效率要高于PE2。
3.2 引导编辑系统在植物中的应用
Lin等[42]通过对PE系统进行密码子优化首次建立了适用于植物的引导编辑系统(plant prime editing,PPE)。PPE系统在水稻和小麦基因组中实现了12种单碱基替换(0.2%~8.0%)、多碱基替换(0.6%~1.5%)及小片段插入(1.1%)和缺失(4.3%)。研究结果显示,编辑效率受RT模板长度影响较大,在37 ℃条件下反应效果最好,在非编辑链产生切口的策略对PPE系统效率影响不大。最后作者还构建了二元载体,编辑效率高达21.8%。随后,Tang等[43]对水稻的10个基因进行靶向编辑,最高编辑效率达到1.55%。研究结果也表明,在非编辑链产生切口并不能提高PE系统在水稻中的编辑效率。Li等[44]成功在水稻中对外源hptII突变基因和内源OsEPSPS基因实现了精确编辑,其中外源基因的编辑效率为9.38%,内源基因的编辑效率为2.22%。Butt等[45]利用PE系统对水稻的除草剂抗性基因OsALS、提高产量基因OsIPA和调控侧枝基因OsTB1进行了精确编辑。Hua等[46]利用Sp-PE2和Sp-PE3分别对水稻中转基因的突变GFP和内源基因ALS、APO1等进行碱基替换、缺失和插入。突变GFP的回复编辑效率分别为15.6%和17.1%,内源基因只有ALS的碱基替换效率为9.1%,其他内源基因均检测不到突变效率,可见PE系统对不同靶位点的作用情况不同。
科研工作者在其他植物中也陆续开展了PE系统的研究。Jiang等[47]通过增加PE中pegRNA表达框的数量及优化pegRNA驱动启动子提高pegRNA的表达量,首次对玉米两个乙酰乳酸合酶基因ZmALS1和ZmALS2进行碱基替换(W542L和S621I),编辑效率高达4.8%~53.2%,并且获得ZmALS1和ZmALS2纯合突变体。该研究的编辑效率较之前水稻中的研究有了很大的提升,为进一步优化植物PE系统提供了方向。Lu等[21]首次对双子叶植物番茄GAI、ALS2和PDS1三个基因进行了碱基替换、插入突变。科研工作者还尝试对马铃薯基因组进行编辑,但是编辑效率非常低[48]。另外,PE系统也成功对拟南芥[49]、烟草[49]和小立碗藓[48]等其他模式植物的基因组进行了精确编辑。
4 引导编辑系统设计工具
随着PE系统的广泛应用,很多课题组研发了pegRNA的设计工具方便科研工作者应用PE系统。Schene等[34]基于PBS序列设计和双pegRNA策略,开发了植物pegRNA设计网站PlantPegDesigner(http://www.plantgenomeediting.net/),为使用者提供了pegRNA选择与推荐方案。Bhagwat等[50]开发了multicrispr工具,该工具可以针对包括PE系统等多种基于CRISPR的编辑方法进行gRNA设计。Hsu等[51]针对prime editing系统合作开发了一项友好的网页设计工具—PrimeDesign(http://primedesign.pinellolab.org/),并利用此工具构建了一个全面和可搜索的数据库—PrimeVar,该数据库包含了对超过68 500种人类致病性遗传变异的模拟和纠正的pegRNA和ngRNA组合。Chow等[52]开发了pegFinder(http://pegfinder.sidichenlab.org/),为PE2和PE3设计pegRNA,并且报告中还给出不同长度的RT模板和PBS序列供实验人员选择。Morris等[53]对人类致病性疾病遗传变异设计了模拟和纠正的PE系统,并通过Cas9替代酶和延长RT模板策略,使覆盖的致病变异达到了50 000以上,收集在以下网站(https://primeedit.nygenome.org/)。Hwang等[54]向PE系统应用者提供了两个免费的网站PE-Designer(http://www.rgenome.net/pedesigner/)和PE-Analyzer(http://www.rgenome.net/pe-analyzer/)。PE-Designer可以进行pegRNA的设计,包括目标序列潜在的靶位点、pegRNA延伸序列及切口sgRNA的序列;PE-Analyzer专门用于PE结果分析,接受高通量测序数据,能够输出突变分析的表格及作图。
5 引导编辑系统的脱靶效应
脱靶效应一直是基因编辑工具比较关注的重点,为了检测PE系统的脱靶风险,Jin等[55]率先在农作物中深入评估了PPE系统的脱靶效应。研究人员发现,PPE系统对间隔序列近PAM端及PBS的5′端的错配容忍度较低。通过对pegRNA的179个内源潜在脱靶位点的编辑情况进行高通量检测,结果显示PPE系统在水稻中的脱靶编辑效率很低(0~0.23%),其中有8个位点携带一个或两个错配碱基,脱靶编辑效率仅为0~0.02%。研究人员还对依赖pegRNA和不依赖 pegRNA的全基因组范围内可能产生的碱基替换 (single nucleotide variants, SNVs) 和小片段的插入与缺失(insertions/deletions, Indels)进行统计,发现PPE系统几乎不会在基因组内引发额外的SNVs或Indels突变。另外,在植物体中过表达PPE系统不会干扰细胞内源的逆转录生物学过程,也不会在全基因组范围内产生pegRNA或mRNA序列的随机插入[55]。以上结果表明PPE在植物中有很高的编辑特异性。
Kim等[56]利用nDigenome-seq在人的细胞中评估了PE系统的特异性,主要评估PE系统的主要组成nCas9的特异性,在9个靶位点中只检测到5个脱靶位点,脱靶编辑效率为0.1%~0.9%,说明PE系统的特异性较高,并且通过应用改造的Cas9变体会进一步提高PE系统在人细胞中的编辑特异性。
6 引导编辑系统的发展前景
目前PE系统已在多个物种中进行成功编辑,有广泛的普适性。PE系统不产生DSB,通过引入编辑模板即可精确进行小片段的插入/缺失及碱基间的任意替换,靶位点序列要求不严格,广泛存在于基因组中。与BE系统相比,PE系统编辑效率虽然偏低,但是对于在BE系统编辑窗口(4~8 nt)存在多个可编辑碱基、编辑窗口之外及不可编辑类型(碱基颠换)的突变,PE系统是更好的选择。与CRISPR/Cas9介导的HDR相比,PE系统编辑效率相当或优于HDR,但是可大大减少由于HDR引入的插入突变,因此从整体水平上,PE系统是优于HDR的。另外,多个物种的应用显示,PE系统的特异性高,脱靶效应低,对于动植物精准育种和微突变引起的疾病治疗等方面有很大的应用潜力。
PE系统效率影响因素较多,不同物种的应用效率不同,不同靶位点效率不同,另外,PBS和RT模板的长度和反应温度也会影响PE系统的效率。因此,为了推进PE系统的广泛应用,开发出针对不同物种的pegRNA设计及效率预测网站很有必要。目前,科研工作者在改造Cas9、扩展PE系统编辑范围、提高pegRNA稳定性、载体递送和筛选系统等方面对PE系统进行优化,都取得了很好的进展。下一步,研究者可以考虑开展不同优化方向协同作用的研究,更进一步提高PE系统的编辑效率。PE系统在不同物种中的编辑效率差异较大,在动物中的平均编辑效率比植物高,在马铃薯中尤其低。寻找不同物种中限制PE系统编辑效率的因素,进一步优化PE系统以适应该物种的应用,也是未来重要的研究方向。
自PE系统成功开发以来,科研工作者就从多个方面对其进行优化,已经取得了很大的进展,未来仍然可期。总之,PE系统在动植物基因功能研究和育种方面有非常广阔的前景,并且该技术有可能成为一种新的基因治疗形式,以安全、高靶向的方式插入治疗基因,以替代突变或缺失的基因。

