MOG抗体相关疾病的影像学表现
杨敏 姚振威
髓鞘少突胶质细胞糖蛋白(myelin oligodendrocyte glycoprotein,MOG)是在哺乳动物的中枢神经系统少突胶质细胞上特异表达的糖蛋白,为豚鼠脱髓鞘抗体的靶点[1]。目前,有关MOG的生物学功能仍不清楚,根据分子结构推测其可能具有维持髓鞘结构稳定、调控细胞骨架以及激活补体等作用[2]。MOG抗体可通过血脑屏障,并能与中枢神经系统MOG相结合,产生以髓鞘脱失为主要病理表现的疾病,称为MOG抗体相关疾病(MOG antibody related diseases,MOG-AD)。国内专家[3]提出了初步的MOG-AD诊断标准,包括:①用全长人类MOG作为靶抗原的细胞法检测血清MOG-IgG阳性;②临床有下列表现之一或组合:视神经炎(optic neuritis,ON;包括慢性复发性炎性视神经病变)、横贯性脊髓炎、脑炎或脑膜脑炎、脑干脑炎;③与中枢神经系统脱髓鞘相关的MRI或电生理(孤立性ON病人的视觉诱发电位)检查结果;④排除其他诊断。
MOG-AD属于炎症性脱髓鞘疾病中一个新的疾病谱,它不同于多发性硬化(multiple sclerosis,MS)和视神经脊髓炎谱系疾病(neuromyelitis optical spectrum disorder,NMOSD)[4]。MOG-AD临床及影像表现形式多样,可类似急性播散性脑脊髓炎、NMOSD、ON、脑炎、脊髓炎、肿瘤样脱髓鞘、复发性腰骶脊髓神经根病等[5]。MOG-AD可累及多个部位,且目前其在各部位的影像表现尚不被熟知,诊断准确率低。本文就MOG-AD在视神经、脑部、脊髓和其他颅神经的MRI表现及影像研究现状进行综述。
1 视神经MOG-AD的影像诊断
1.1 影像表现 视神经MOG-AD影像表现具有一定特征性,可以提示辅助临床诊断。MOG-AD以孤立性视神经受累多见(约占83%),且容易复发[6]。发生视神经MOG-AD的男女比例相当,易累及视神经前段,双侧发生及长节段病变多见。急性发作期,视神经形态可能正常或肿胀,部分病人可见视乳头水肿[6];慢性期,视神经可出现萎缩[7]。T2WI或脂肪抑制序列上呈高信号(图1A),增强扫描多为轻度强化[8-9]。部分MOG-AD病人可见视神经周围脂肪组织强化(图1B),在首次发作时最为明显,此征象被认为是视神经MOG-AD最具特征的表现[10]。

图1 左侧视神经MOG-AD病人。A图,横断面T2WI脂肪抑制序列影像,左侧视神经眶内段较右侧信号增高。B图,横断面脂肪抑制增强T1WI序列影像,左侧视神经周围脂肪组织强化。
1.2 鉴别 有研究[9]认为扩散加权成像(DWI)的表观扩散系数(ADC)值有利于视神经MOG-AD同NMOSD鉴别,后者ADC值更低。ADC值可反映两者发病机制的差异,与MOG-AD的单纯性脱髓鞘相比,NMOSD的轴突损伤和血液神经屏障破坏更严重。虽然NMOSD与MOG-AD均可表现为双侧、纵向、广泛的视神经病变,但MOG-AD病人视神经前段更易受累,视乳头增大的占比更高,视神经周围强化更多见[6],NMOSD更易累及视神经偏后的部分(如视交叉或视束)[8]。
2 脑部及其他颅神经MOG-AD影像诊断
2.1 影像表现Li等[11]研究认为MOG-AD易出现脑部受累,各年龄段总的脑部病变发生率类似于NMOSD,MOG-AD病人脑损伤可分为3种分布模式:①累及中线结构和深部灰质(图2A、B),包括间脑、脑桥、延髓、胼胝体、中线大脑脚、第三脑室周围、丘脑和基底节,丘脑和脑桥以及深部灰质病变更常见;②累及幕上白质(图2C),包括皮质旁白质、脑室周围深部白质、血管旁白质、内囊;③累及灰质,包括灰质及邻近白质同时累及,或局限于灰质。研究[12-13]表明MOG-AD脑部受累的不同临床和影像学表现与年龄相关,儿童比成人更易出现脑部病变,年龄较小的儿童更常表现为类似急性播散性脑脊髓炎的广泛大脑病变。
MOG-AD脑部病变表现为少量“蓬松”的、界限不清的或者大片的T2WI高信号,增强扫描病变不强化或者呈松散的结节状、斑片状、条状或开环状强化(图2D-F)[14]。Komatsu等[15]发现白质病变可出现血管周围强化,类似胶质纤维酸性蛋白星形细胞病相关的原发性炎症或脑炎。部分病变表现为软脑膜强化,类似脑膜炎[16]。胼胝体病变往往呈局灶性、离散性的结节状病灶,在脑室周围没有特定的方向[17]。部分以癫 起病者表现为皮质脑炎,可见特有的皮质液体衰减反转恢复(FLAIR)序列高信号,称为“FLAMES”(FLAIR-hyperintense lesions in anti-MOG-associated encephalitis with seizures),在DWI序列上病灶显示不佳,可以与癫导致的脑部异常相鉴别。Miyaue等[18]、Shu等[19]报道的3例MOG-AD影像表现类似肿瘤样脱髓鞘,脑组织活检病理类似多发性硬化。
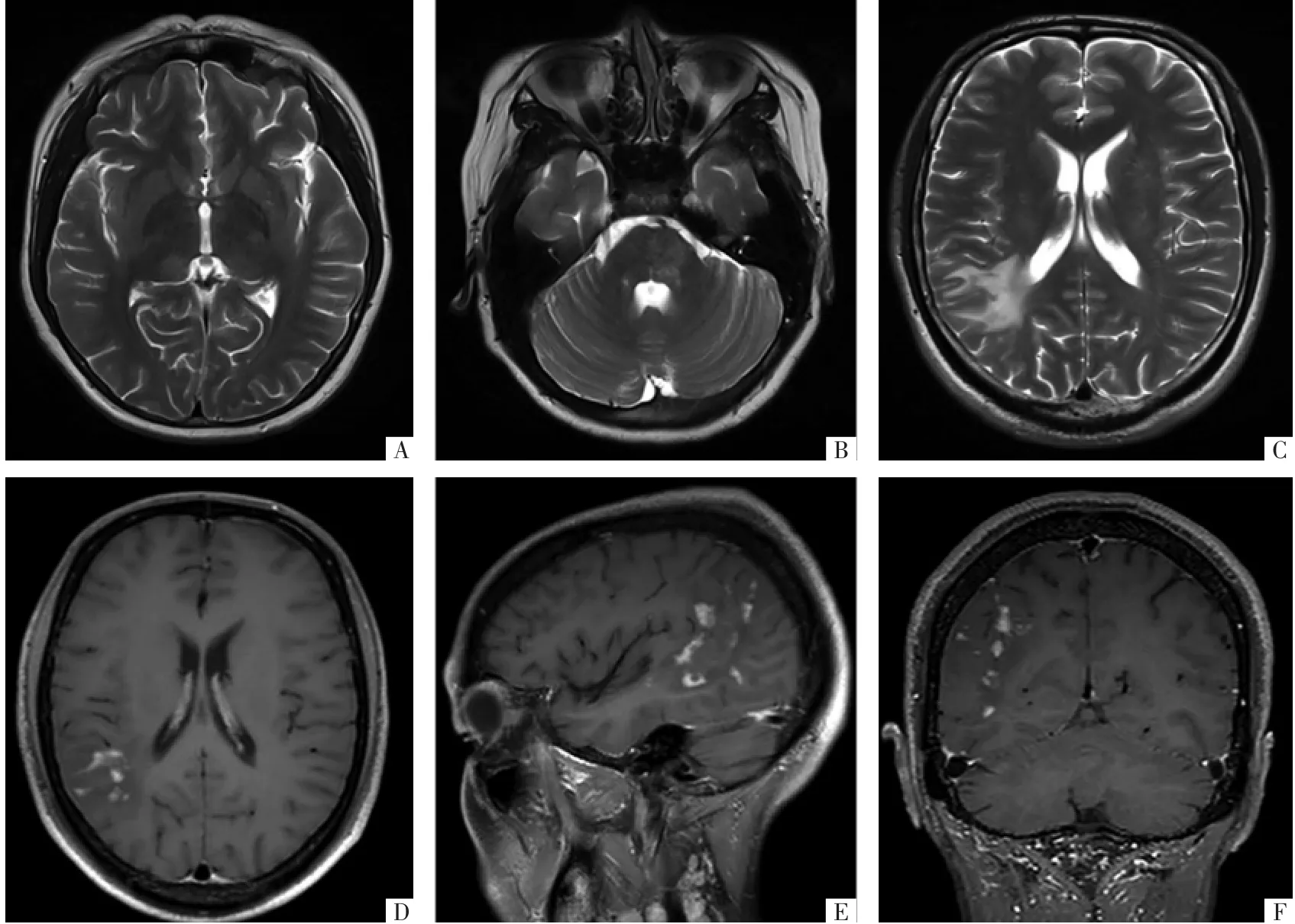
图2 脑部MOG-AD。A、B图为同一病人的T2WI横断面影像,右侧丘脑、脑桥见斑片状较高信号,边界模糊。C-F图为同一病人,C图为T2WI横断面影像,右顶叶白质内片状高信号,伴病灶内结节状、斑片状稍低信号;D-F图分别为T1WI增强横断面、矢状面、冠状面影像,右顶叶病灶呈松散的结节状、斑片状中等度强化,强化区域与T2WI病灶内稍低信号区一致。
MOG-AD其他颅神经受累少见,均为个案报道,影像表现不具特征性。
2.2 鉴别MOG-AD不同于MS,并非所有MOGAD病人都会出现脑部病变,亦不会呈现为MS的典型脑部病变。MOG-AD可见直径较大的白质病变或脑干病变,但未见文献[10]报道MS中的Dawson指征和NMOSD中的桥弓征。MOG-AD相关的脑桥病变,尤其表现为结节状和线状强化时,可类似于类固醇激素反应性慢性淋巴细胞炎症伴脑桥血管周围强化[14]。MOG-AD的脑干和基底节病变仍需与白塞氏病鉴别。
3 脊髓MOG-AD影像诊断
3.1 影像表现 虽然在MOG-AD中不太常见脊髓病变,但其发生部位和信号特征具有提示作用。纵向广泛性横贯性脊髓炎相对较多见,颈、胸髓均可受累,常伴轻度脊髓肿胀(图3A)[10,20]。圆锥受累(图3B)在MOG-AD相对有特异性,甚至可出现孤立性圆锥病变[21]。MOG-AD中还可有短病变(<3个椎体节段),且常与另一个纵向的广泛性病变同时存在[22]。
脊髓病变可表现为局限于灰质的T2WI序列上的高信号,在矢状面呈线状(称矢状线)(图3B、C),在横断面呈“H征”(图3D),是脊髓MOG-AD的特征性表现[22]。矢状面T2WI序列的脊髓中央线状高信号病变可与室管膜管叠加,称为室管膜管“假性扩张”(图3C),也被认为是脊髓MOG-AD的特征。增强MRI上,脊髓病变常呈云雾状或铅笔线样强化[23]。在对MOG-AD病人进行颈髓定量MRI及扩散张量成像时,可见受累颈髓灰质体积显著减小;无论病变是否累及颈髓,颈髓平均各向异性分数均与健康志愿者相当,提示该病变对脊髓白质影响较小[24]。MOG-AD表现为脊髓和脑深部灰质受累的原因尚不清楚,在脊髓灰质中发现含有MOG的少突胶质细胞,转录组图谱显示MOG在大脑灰质中表达,可能有助于解释此表现[25-26]。MRI表现可能反映了MOG-AD中存在灰质脱髓鞘[22]。

图3 脊髓MOG-AD病人。A图,矢状面T2WI上显示颈髓局部肿胀,髓内见条片状高信号。B-D图为同一病人。B、C图,矢状面脂肪抑制T2WI上可见脊髓广泛病变,圆锥受累,脊髓内异常信号呈线状,符合室管膜管“假性扩张”表现;D图,横断面T2WI上显示脊髓灰质呈“H征”。
3.2 鉴别 与MS相比,NMOSD和MOG-AD更易出现纵向、广泛性、横贯性脊髓病变,MOG-AD病变在横断面T2WI序列通常位于脊髓中央,与MS的脊髓周围(后索或侧索)受累不同。部分脊髓MOG-AD与NMOSD无法区分,但前者更常局限于灰质(可见矢状线/H征),更易出现2个非连续性病变。MOGAD脊髓病变强化的发生率低于NMOSD及MS,且脊髓水肿程度相对较轻[22]。
4 小结
MOG-AD影像表现模式多种多样,影像诊断医生应熟悉MOG-AD的主要影像特征,如:视神经前段易受累、视乳头水肿及视神经周围强化多见、脊髓圆锥易受累、T2WI可表现为横断面H征及室管膜管“假性扩张”、脑部病变表现为多种分布和模式、部分颅神经受累等,需将其与NMOSD、MS等神经免疫疾病区分开,以帮助临床筛选应检测MOG抗体的高危人群,便于MOG-AD病人尽早接受规范化治疗。
目前针对MOG-AD影像表现的研究均为回顾性分析,影像技术仅采用平扫MRI、增强MRI及DWI,其在磁敏感加权成像、扩散张量成像、灌注加权成像等功能MRI上的表现有待进一步研究。另外,针对现有影像学表现,仍有诸多疑问亟待解决,例如:①脑部病变在T2WI序列信号不均匀,部分呈稍低信号的区域正好对应增强T1WI序列的强化区域,此征象是否由病变本身的不均质性导致,或者可否认为T2WI序列稍低信号区代表血脑屏障破坏区、周围更高信号区代表脑实质水肿区。②并非所有病变均呈扩散受限或者出现强化,这是否代表血脑屏障破坏的严重程度有差异,扩散受限和强化程度与MOG抗体滴度和疾病预后是否有相关性。③MOG-AD首次发作与复发的影像学表现、合并其他抗体阳性的影像学表现是否存在差异等。上述问题需在未来进一步探索和深入研究。

