对数生长期酿酒酵母胞内代谢情况分析
曹凤,任红,2,3,4,5,黄桂东,2,3,4,5,祝智航,陈忻,钟先锋,2,3,4,5*
1(佛山科学技术学院 食品科学与工程学院,广东 佛山,528231)2(广东省传统发酵食品工程技术研究中心,广东 佛山,528231) 3(广东省食品流通安全控制工程技术研究中心,广东 佛山,528231)4(佛山市酿造工程技术研究中心,广东 佛山,528231) 5(佛山市农业生物制造工程技术研究中心,广东 佛山,528231)
酿酒酵母生物安全性高,是发酵产业中的重要微生物,其菌体及菌体代谢产物在多种行业得到广泛应用[1]。在酿酒工业中,酿酒酵母是乙醇发酵关键菌株,其生成的醇类、酸类、酯类、醛类等风味化合物构成了发酵酒的风味品质;也是饲料生产中单细胞蛋白的主要来源,同时可增加饲料中核酸、维生素、多糖等营养物质的含量[2]。现代医药上将酿酒酵母制成酵母片,用于提高新陈代谢机能,治疗消化不良症,还可作为一些微量元素的载体应用于医疗保健行业。由于酿酒酵母具有清楚的遗传背景和成熟的遗传操作平台,在现代分子和细胞生物学中常用作真核模式生物,是微生物细胞工厂低成本发酵生产天然产物的优良宿主,广泛应用于功能性营养源和生物领域等方面[3]。
对数生长期酿酒酵母利用糖作为碳源,以最快的生长速度和最短的分裂时间迅速繁殖[4]。此时期细胞代谢最旺盛,个体形态和生理特性相对稳定[5],是了解酵母生长情况、调控细胞发酵代谢的较好时间点。大量初级代谢产物在此时期合成,如糖、氨基酸、核苷酸等,乙醇等次级代谢产物此时也开始合成,其中许多代谢产物在经济上十分重要。ZHOU等[6]利用构建酵母工程菌株以全细胞生物生产蜜二糖。叶燕锐等[7]分析酿酒酵母对数生长中、后期的全基因组表达谱,研究其发酵性能,旨在提高燃料酒精的生成量。
目前更多的研究集中于通过控制发酵环境、定向改造酵母菌株等手段改变一种或几种代谢物的发酵情况,缺乏对酿酒酵母整体性代谢情况研究。因此,本研究以对数生长期酿酒酵母细胞为对象,采用LCMS/MS对代谢物进行鉴定,通过KEGG(https:www.kegg.jpkeggpathway)注释分析,获得主要代谢途径。了解经过迟滞生长期后对数生长时酿酒酵母胞内代谢物及代谢通路分布情况,丰富酿酒酵母生长的典型阶段,为定向改造酿酒酵母、提高发酵效率提供依据与方向。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种与培养基
酵母菌株为全基因型野生酿酒酵母,于广东省传统发酵食品工程技术研究中心保藏;YPD液体培养基(g/L):葡萄糖20、蛋白胨20、酵母粉10,121 ℃高压灭菌15 min,YPD固体培养基在液体培养基中加入20 g/L琼脂粉即可。
1.1.2 主要试剂
丙三醇(分析纯),天津市大茂化学试剂厂;乙腈(分析纯),德国Merck公司;乙酸铵(生物试剂纯度),美国Sigma公司;磷酸盐缓冲液(分析纯),默赛飞世尔科技公司。
1.2 仪器与设备
7200可见分光光度计,上海尤尼柯公司;IS-RSV1液晶显示振荡器,上海美国精骐公司;磁PL系列力移液器,上海梅特勒-托利多公司;ALLEGRA-64R 台式高速大容量离心机,美国贝克曼公司;AB Triple TOF 6600质谱仪,美国AB SCIEX公司;Agilent 1290 Infinity LC超高压液相色谱仪,美国Agilent公司;Scientz-IID超声波细胞粉碎机,宁波新芝生物科技股份有限公司。
1.3 实验方法
1.3.1 菌株活化与培养
将保存的菌种接种于YPD固体培养基培养,挑取单菌落到YPD液体培养基培养,至OD600nm值为1.0。将上述菌液以5%接种量接种至YPD液体培养基,30 ℃,培养24 h。
1.3.2 生长曲线测定
从酵母菌接种后开始,每隔2 h取适量菌悬液,测定OD600nm值。以各时间点菌悬液OD600nm值为纵坐标,培养时间为横坐标,绘制酵母细胞生长曲线。
1.3.3 胞内代谢物制备
菌株接种后第4、6、8 h,酿酒酵母处于对数生长中、中后、后期。故取发酵至4、6、8 h发酵液,8 000×g离心5 min。沉淀细胞用预冷的磷酸盐缓冲盐溶液(10 mmol/L,pH 7.4)清洗,4 ℃条件下,8 000×g离心5 min,反复清洗3次。
取上述清洗后的酵母菌体,加入预冷的V(甲醇)∶V(乙腈)∶V(水)=2∶2∶1溶液,涡旋混匀,超声波细胞破碎仪充分裂解,在4 ℃条件下14 000×g离心20 min,收集上清液,冷冻干燥备用。分析时取样品加入50%乙腈溶液复溶,0.22 μm膜过滤。
1.3.4 超高效液相色谱-串联质谱法(ultra high performance liquid chromatography-tandem mass-spectrometry,UHPLC-MS/MS)分析
采用超高效液相色谱系统(1290 Infinity LC,Agilent)(色谱柱:ACQUITY UPLC BEH Amide 1.7 μm,2.1 mm×100 mm column)联合四级杆-飞行时间质谱(AB Triple TOF 6600,Beckman)进行分析。色谱条件:进样量2 μL,柱温25 ℃。梯度洗脱程序如下:0~0.5 min,95% B;0.5~7 min,B从95%线性变化至65%;7~8 min,B从65%线性变化至40%;8~9 min,B维持在40%;9~9.1 min,B从40%线性变化至95%;9.1~12 min,B维持在95%。
质谱条件:ESI源,离子源加热温度600 ℃,正负离子电压±5 500 V,碰撞能量为(35±15) eV。采集正负离子2种扫描模式,一级质谱扫描范围:m/z60~1 000,扫描频率:5 scan/s;二级质谱扫描范围:m/z25~1 000,扫描频率:20 scan/s。
数据收集排除同位素设置为4 Da,每个周期要监测的候选离子10个。
1.3.5 代谢物和代谢通路分析
采用XCMS软件进行峰对齐、保留时间校正和提取峰面积,基于上海中科新生命生物科技有限公司自建数据库,通过与数据库中代谢物的保留时间、分子质量、二级碎裂谱图、碰撞能等信息进行匹配,对生物样本中的代谢物进行结构鉴定。通过KEGG数据库(https:www.kegg.jpkeggpathway)进行代谢通路注释,获得代谢物参与的通路。
2 结果与分析
2.1 酿酒酵母生长曲线
采用比浊法测定酿酒酵母生长情况,绘制酿酒酵母生长曲线如图1所示,酿酒酵母迟滞生长期为0~2 h,对数生长期为2~8 h,稳定生长期始于8 h。迟滞生长期酵母细胞数量缓慢增加,酵母菌开始调整体内酶系统,对生长环境较敏感,是酵母菌为适应新环境而出现的代谢调整期。对数生长期,酵母菌数量呈指数增长,研究表明,此时酵母菌经迟滞期适应了生长环境,生物活性高,处于最适菌龄[8];稳定生长期,活菌数量达到最高水平且保持相对稳定[9]。4、6、8 h分别为酿酒酵母对数生长中、中后、后期,酿酒酵母代谢相对活跃,选择此生长时间点为取样时间点,对酿酒酵母代谢物及代谢途径进行分析,以了解其代谢情况。
2.2 对数生长期酿酒酵母胞内代谢物分析
采用UHPLC-MS/MS技术,共鉴定出927种对数生长期酿酒酵母胞内代谢物。对获得的代谢物进行归类如表1所示。对数生长期酿酒酵母胞内代谢物归为8类,其中含氮和含硫化合物数量最多,其他依次为有机酸及其衍生物、氨基酸及其衍生物、酯类物质、糖类物质、酮类和醛类物质、醇类物质、其他物质(包括酿酒酵母生长代谢过程中涉及的无机盐等物质,其代谢物个数≤5种)。以各代谢物峰面积与总峰面积比值表示其相对含量,对八类代谢物相对含量进行比较,较高的依次为含氮和含硫化合物、有机酸及其衍生物、酯类等。由表1可知,含氮和含硫化合物、醇类相对含量随生长时间的变化趋势一致,在对数生长中期较高,中后期和后期基本一致,说明这两类物质主要在对数生长中期生成,在中后期被分解利用,后期整体上趋于稳定。有机酸及其衍生物相对含量先升高后略有降低,说明对数生长期有机酸及其衍生物的积累在中后期达到最高。酯类相对含量在对数生长中、中后、后期逐渐升高,说明酯类物质的生成随着生长时间逐渐增加,其含量逐渐积累。对数生长期氨基酸及其衍生物、糖类、酮类和醛类、其他类物质相对含量变化不明显。
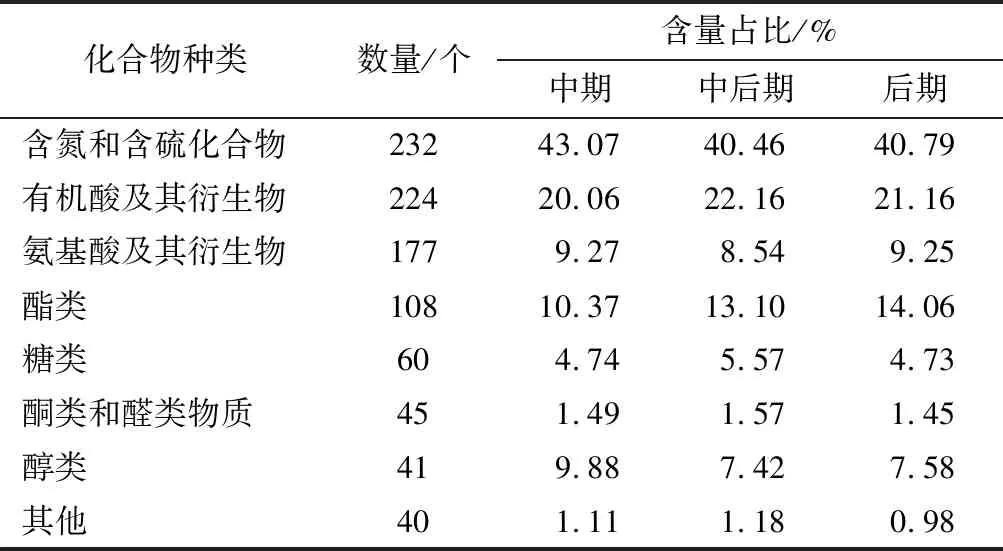
表1 对数生长期酿酒酵母代谢物类别数量和相对含量Table 1 Quantity and relative content of metabolite from Saccharomyces cerevisiae in logarithmic growth stage
对数生长期酿酒酵母胞内主要代谢物(相对含量≥1%)如表2所示,这些代谢物对遗传信息复制、抗逆性提高等方面具有一定作用。如中、后期主要代谢物L-二氢乳清酸、中后期主要代谢物胞苷、鸟苷酸、次黄嘌呤、7-甲基尿酸,是酿酒酵母中的能量载体和酶辅因子,充当遗传信息传递者、磷酸基团供体和信号介质[10],支持细胞繁殖和生长。L-古洛糖酸-γ-内酯可刺激多肽合成,和焦谷氨酸-色氨酸等多肽均可增强酿酒酵母逆环境耐受性和抗应激能力[11],提高细胞生长率和存活率[12]。
这些代谢物在酿酒酵母细胞膜构建、信号分子传递、渗透压调节等方面也具有一定作用。γ-亚麻酸甲酯、二十二碳六烯酸(docosahexaenoic acid,DHA)属于酯类和有机酸,它们是酵母细胞膜主要构建成分,DHA还参与线粒体合成和稳态调节,对线粒体DNA复制、转录和稳态维持发挥重要作用[13]。甘油-3-磷酰胆碱是乙酰胆碱生物合成前体,和白雀木醇均对细胞膜有一定生理作用。甘油-3-磷酰胆碱有助于细胞膜磷脂合成,增强细胞膜流动性。乙酰胆碱是一种神经递质,具有调节细胞膜对离子通透性、提高信息传递速度等重要生理活性。白雀木醇可维持细胞渗透压,还可促进酵母细胞增殖和DNA合成[14]。哈尔满碱、垂茄啶、甜菜碱属于含氮化合物,是对数生长期酿酒酵母代谢物中主要的生物碱,哈尔满碱、垂茄啶具有一定抑菌活性[15],甜菜碱可促进酵母脂肪代谢,调节细胞渗透压,维持酶活力[16]。
硫胺素单磷酸酯是辅酶焦磷酸硫胺素(thiamine pyrophosphate,TPP)合成前体,TPP是维持丙酮酸、α-酮戊二酸和支链酮酸脱氢酶活性的必需辅因子[17],这些酶在三羧酸循环(tricarboxylic acid cycle,TCA)中具有重要功能。2-磷酸甘油酸是生物细胞中常见生化分子,糖解作用中生成高能磷酸分子磷酸烯醇式丙酮酸,是一种无氧状态下的放能过程,最后生成丙酮酸进入TCA。蜜二糖是食品、化妆品添加剂,可促进双歧杆菌、乳杆菌等肠道益生菌群增殖、缓解皮炎症状,本研究中蜜二糖相对含量较高,可进一步考虑通过控制发酵环境、改造酵母等方法利用酿酒酵母生物合成蜜二糖。
2.3 对数生长期酿酒酵母胞内代谢途径分析
通过KEGG注释分析,将检测到的代谢物按代谢途径进行归类。酿酒酵母对数生长期胞内主要代谢途径为核苷酸代谢、辅因子和维生素的代谢、碳水化合物代谢,如表3所示。此时期碳水化合物代谢、其他次生代谢物的生物合成、能量代谢、萜类化合物和聚酮化合物的生物合成、异生素生物降解途径的相对含量基本保持不变。氨基酸代谢和脂质代谢相对含量的变化表明对数生长期酿酒酵母的氨基酸代谢逐渐增强,脂质代谢在对数生长中后期最活跃。对数生长中后、后期核苷酸代谢、辅因子和维生素的代谢途径相对含量显著降低,主要是由于嘧啶代谢途径中L-二氢乳清酸(表2、表4)的相对含量降低,说明中后、后期嘧啶代谢的活跃度降低,硫胺素代谢途径中硫胺素单磷酸酯(表2、表4)的相对含量显著降低,说明硫胺素代谢主要发生在对数生长中期。

表2 对数生长期酿酒酵母主要代谢物Table 2 Main metabolites of Saccharomyces cerevisiae in logarithmic growth stage
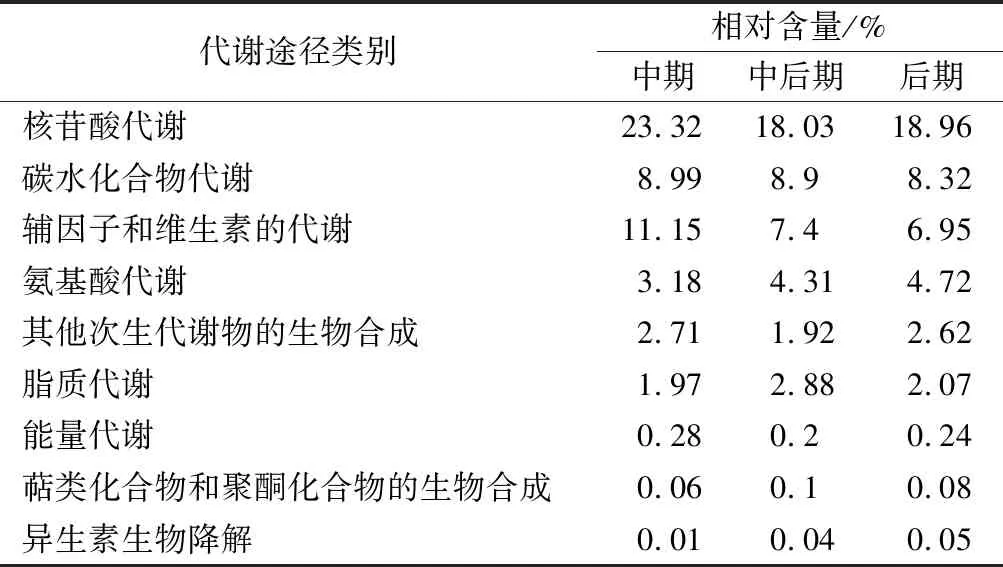
表3 对数生长期酿酒酵母代谢途径类别及其相对含量Table 3 Categories and relative content of metabolic pathway on Saccharomyces cerevisiae in logarithmic growth stage
对数生长期酿酒酵母主要代谢通路和及其主要代谢物(相对含量≥0.1%)如表4所示。共有5种代谢物参与嘧啶代谢,3种物质参与嘌呤代谢,这些代谢途径生成了重要的能源物质和信使分子,以及活性基因载体,参与组成辅酶,在酵母细胞各种生理活动如膜受体激素作用发挥、核苷酸合成中起重要作用。氨酰基tRNA合成是核糖体翻译过程的必要生化反应,在酵母细胞蛋白质合成中起至关重要的作用。甘油磷脂是对酿酒酵母生长较重要的一类酯类,甘油磷脂代谢参与细胞膜对蛋白质识别和信号转导,参与酵母细胞膜和膜表面活性物质构成[18]。黄酮类化合物、抗坏血酸、谷胱甘肽都具有抗自由基和抗氧化作用。黄酮类化合物是多酚类次级代谢产物的总称,具有潜在的抗菌、抗病毒、抗衰老等活性。抗坏血酸和醛酸盐代谢、谷胱甘肽代谢主要在酵母细胞氧化还原代谢反应中起调节作用,减少氧化损伤,与黄酮类合成代谢均可在一定程度上增加细胞耐受能力,延长酵母细胞寿命。
氨基酸代谢途径中,赖氨酸降解可以调节酵母代谢平衡,可为合成肉碱类化合物提供结构组分。精氨酸和脯氨酸代谢可将谷氨酸、脯氨酸、聚胺等转换为高能磷酸化合物肌酸磷酸,还可通过尿素循环解除氨中毒,避免酵母细胞由于氨过量造成的代谢紊乱[19]。支链氨基酸缬氨酸,亮氨酸和异亮氨酸的生物合成可作为生物体能源,促进氮储留,提高蛋白质合成率。半乳糖代谢、淀粉和蔗糖代谢是酿酒酵母主要的碳水化合物代谢途径,代谢过程中释放大量能量,供酵母生命活动使用,同时为合成脂类、蛋白质、核酸等生物大分子物质提供原料[20]。
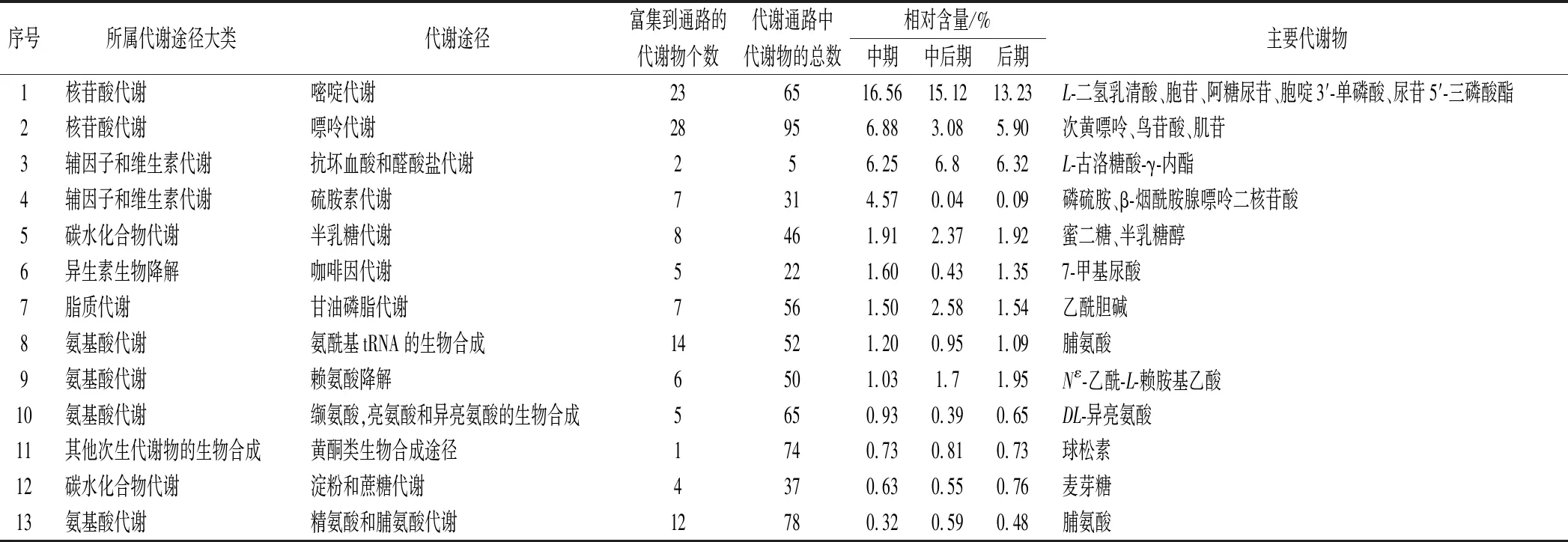
表4 对数生长期酿酒酵母主要代谢通路Table 4 Main metabolic pathways of Saccharomyces cerevisiae in logarithmic growth stage
对上述核苷酸代谢、碳水化合物物代谢、氨基酸代谢中的主要代谢途径进行分析,绘制核苷酸代谢途径如图2所示,碳水化合物与氨基酸代谢途径如图3所示。核苷酸是参与酿酒酵母生长繁殖的一种极其重要的小分子化合物,是生命最基本物质之一,它不仅可以作为DNA和RNA合成前体,而且在代谢中也扮演着重要角色,可作为生理、生化过程的调节物质参与体内物质代谢。在酿酒酵母对数生长期,核苷酸代谢主要为嘌呤代谢和嘧啶代谢,本研究中酿酒酵母参与此代谢途径的代谢物个数为51。酵母细胞经过迟滞期后,此时迅速苏醒,核苷酸类物质对外界环境应激反应迅速,为菌体分裂做准备,在此阶段遗传物质大量合成,核苷酸代谢途径非常活跃,此结果与彭立新等[21]研究一致。
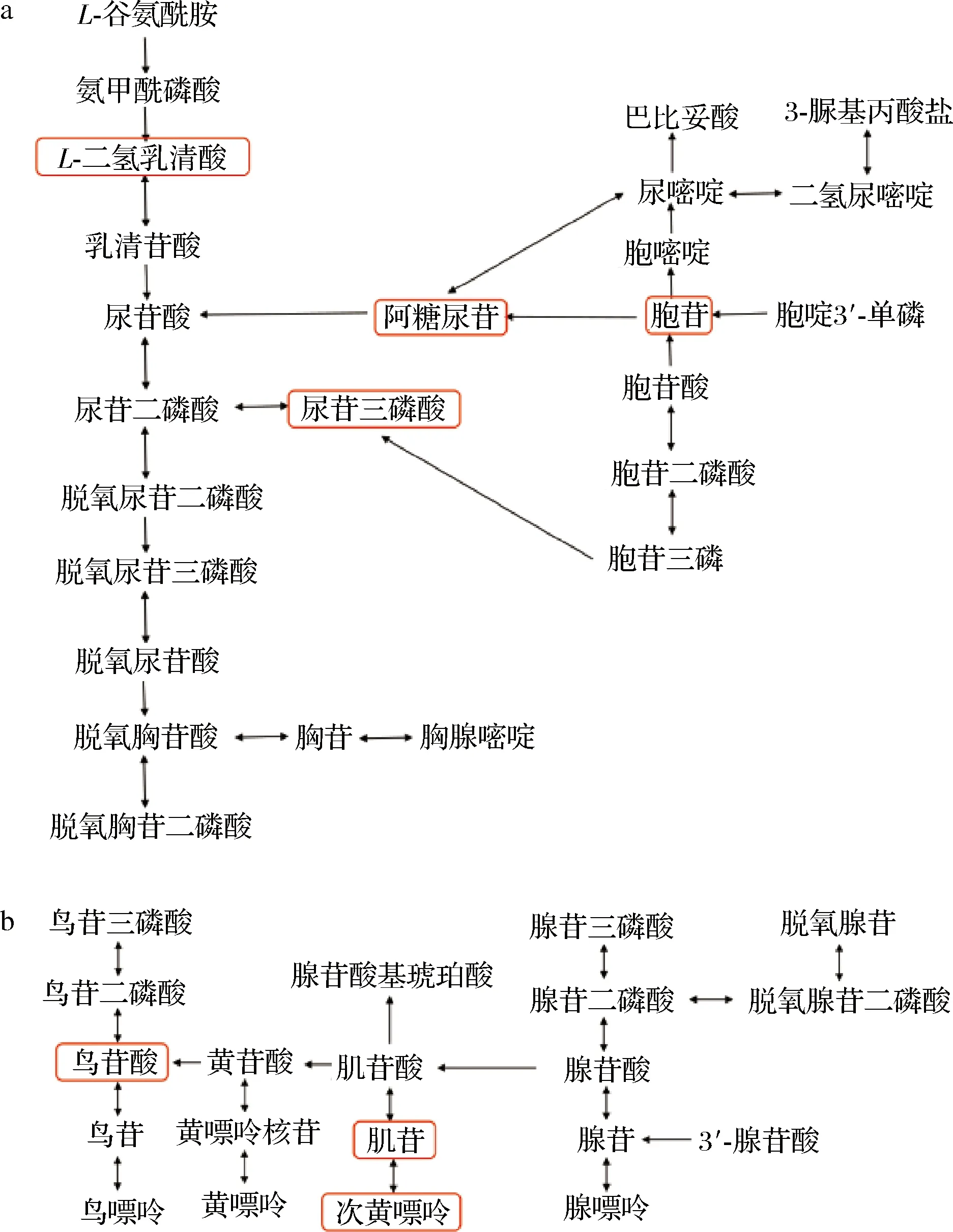
a-嘧啶代谢;b-嘌呤代谢图2 酿酒酵母核苷酸代谢Fig.2 Nucleotide metabolism in Saccharomyces cerevisiae注:加框字体为检测到的主要代谢物(相对含量≥0.1%)(下同)
碳水化合物代谢与氨基酸代谢之间有着密切的联系,氨基酸在酵母菌中作为前体物质参与细胞构建,同时通过形成催化酶调节细胞代谢,作为酶辅助因子和氮源广泛参与酵母代谢过程[22]。酿酒酵母对数生长期氨基酸代谢中主要代谢途径为赖氨酸降解,谷胱甘肽代谢,缬氨酸、亮氨酸和异亮氨酸生物合成以及降解。碳水化合物代谢中通量较高的途径为淀粉和蔗糖代谢,半乳糖代谢。由图3可知,6-磷酸葡萄糖、丙酮酸、2-酮戊二酸为酿酒酵母碳水化合物和氨基酸代谢关键节点。6-磷酸葡萄糖节点分支为糖酵解途径(em- bden-meyerhof-parnas pathway,EMP)和戊糖磷酸途径(hexose monophosphate pathway,HMP),EMP较活跃,其相对含量为0.14%。EMP代谢流进入TCA途径产生能量,HMP为核苷酸合成供应还原力NADPH,研究表明,中断HMP氧化途径会导致核苷酸含量迅速下降[23]。丙酮酸节点分支有亮氨酸和异亮氨酸代谢等,其主要进入TCA以产生氨基酸,进一步合成蛋白质。TCA中2-酮戊二酸是一个重要节点,图3中分别流向谷氨酸和琥珀酸,与琥珀酸相比,谷氨酸代谢流较为活跃,较多氨基酸生成处于此分支,同时谷氨酰胺是核苷酸生物合成前体物质,可进一步促进核苷酸生成。本研究中碳水化合物和氨基酸代谢中关键代谢节点与张凯丽[24]研究中核苷酸代谢关键节点一致,推测在酿酒酵母对数生长期,酵母菌碳水化合物和氨基酸代谢流分布也是为了更好地促进核苷酸代谢,以支持酵母细胞快速增长繁殖。

图3 酿酒酵母碳水化合物和氨基酸代谢Fig.3 Carbohydrate and amino acid metabolism of Saccharomyces cerevisiae
3 结论
本文研究了酿酒酵母对数生长期代谢情况,经鉴定,得到927种代谢物,分为8类,其中代谢物数量较多的为含氮和含硫化合物、有机酸及其衍生物、氨基酸及其衍生物等;相对含量较高的为含氮和含硫化合物、有机酸及其衍生物、酯类等。代谢物主要与酵母遗传信息复制、细胞膜构建、信号分子传递、渗透压调节、抗逆性提高等相关。涉及的代谢途径主要有核苷酸代谢、辅因子和维生素代谢、碳水化合物代谢及氨基酸代谢。核苷酸代谢中嘌呤代谢与嘧啶代谢途径相对含量最高,说明对数生长期酿酒酵母主要进行与生长繁殖密切相关的代谢,为后续蛋白质生物合成做准备。同时碳水化合物和氨基酸代谢流分布可更好地支持嘌呤与嘧啶代谢,帮助酵母增殖、生长和存活。

