大孔强酸树脂膨胀床吸附提取ε-聚赖氨酸的研究
刘洋,王靓,张宏建,陈旭升,张建华*
1(江南大学 生物工程学院,江苏 无锡,214122)2(工业生物技术教育部重点实验室(江南大学),江苏 无锡,214122)
ε-聚赖氨酸(ε-poly-L-lysine,ε-PL)是一种由链霉菌分泌产生的抗菌肽,由5~35个L-赖氨酸通过α-COOH和ε-NH2形成酰胺键连接而成的聚合物,其分子质量一般为780~4 600 Da[1]。由于其多阳离子性质可以通过离子吸附与携带负电荷的细胞表面相互作用,故对于包括革兰氏阳性和阴性细菌、酵母菌、霉菌甚至病毒在内的多种微生物都表现出良好的抑菌活性[2]。目前,ε-PL及其盐酸盐已获得日本、美国、中国等国家和地区批准用作天然食品防腐剂[3]。此外,ε-PL还在药物载体、脂质体、干扰素诱导剂和水凝胶等多个领域有着广阔的应用前景[4]。由此可见,ε-PL是一种具有广泛应用领域的生物技术产品。
微生物发酵法是目前生产ε-PL最经济的方式。经历40余年的菌株改造和发酵工艺不间断优化,当前ε-PL最高发酵水平已经突破70 g/L[5]。因此,如何高效率地从发酵液中分离提取ε-PL就成为学术界和产业界关注的另一个重点。1981年,SHIMA等[6]报道了ε-PL提取第一条完整工艺:该工艺采用过滤的方式进行固液分离,去除大量菌体后收集滤液,将收集的滤液pH值调节至8.5后再过滤1次,过滤液通过弱酸阳离子树脂进行吸附,并使用去离子水和醋酸对树脂进行洗涤,再使用0.1 mol/L盐酸进行解吸附,洗脱液再通过蒸发浓缩和活性炭脱色后,最后采用乙醇和乙醚混合液进行沉淀,收集沉淀用水复溶后通过凝胶层析获得ε-PL 样品。2003 年,美国食品药品监督管理局公布了一种ε-PL 提取新工艺[7]:采用微滤膜过滤作为固液分离的方式,随后采用三级离子交换进行正负吸附,最后经活性炭脱色获得产品。该工艺相比于第一条工艺最大特点是去除了有机溶剂沉淀。2016 年,本团队建立了一种菌体絮凝结合板框过滤进行固液分离,再利用离子交换吸附耦合膜分离提取ε-PL 的方法[8],初步实现ε-PL纯度90.2%,收率达到75%;后续经过优化[9],进一步实现ε-PL纯度98.8%,收率达到72.6%。从已报道的ε-PL提取工艺来看,进行发酵液的菌体去除均是必备的第一步操作。事实上,不管是采用离心还是过滤进行发酵液的固液分离,设备投资大、能耗高和操作时间长都是不可克服的弊端。
膨胀床吸附(expanded bed adsorption,EBA)是一种新型的生物分离技术,不需要任何预处理,通过在一个单元操作中达到固液分离和产品分离纯化的目的。DE SOUSA等[10]将EBA技术用于提取重组503抗原,提取效率提高到88.8%;PATHAPATI等[11]将EBA技术与模拟移动床技术相结合应用于γ-氨基丁酸的提纯中,使发酵液的提取效率和纯度一步提高了2倍,产品纯度达到92%;MACIEL等[12]通过EBA技术对乳铁蛋白进行纯化,纯度可达到92.7%,回收率为87%;郭静等[13]通过膨胀床-固定床层析偶联方式分离纯化藻蓝蛋白,纯化因子达到2.2,回收率为58.8%。由此可见,EBA技术可以不经过固液分离直接从发酵液中选择性捕获目标产物,不仅提高了提取效率,也节约了经济成本,并证明了EBA技术如果应用在ε-PL产品的提取工艺上,将是一条非常经济有效的工艺路线。
本研究尝试建立利用大孔强酸树脂膨胀床直接从发酵液中分离纯化ε-PL的工艺,以期实现省略固液分离单元、降低分离提取成本和提升提取效率的目的。首先进行了用于膨胀床的强酸树脂筛选,并通过吸附等温线模型研究了树脂吸附ε-PL行为,再对单柱膨胀床吸附提取ε-PL的工艺参数进行了优化,最后构建了三柱串联膨胀床提取ε-PL的循环工艺。
1 材料与方法
1.1 材料与试剂
发酵液由本实验室提供;甲基橙等主要实验试剂,分析纯,国药集团化学试剂有限公司;大孔型强酸性阳离子交换树脂,郑州和成新材料科技有限公司、天津双联科技有限公司、江苏苏青水处理工程集团有限公司,主要信息如表1所示。

表1 树脂主要参数Table 1 Main parameters of resin
1.2 仪器与设备
40 mm×300 mm层析柱,新科水处理设备厂;精密蠕动泵BT100-2J、BT300-2J,保定兰格恒流泵有限公司;Agilent 1260 Infinity高效液相色谱仪,美国Agilent公司。
1.3 实验方法
1.3.1 强酸树脂的筛选
称取2 g活化好的钠型树脂,放入含100 mL发酵液的摇瓶中,于30 ℃、200 r/min的摇床中振荡12 h后,取样检测。吸附饱和的树脂用去离子水清洗后,加入100 mL 0.8 mol/L NaOH溶液,于30 ℃、200 r/min的摇床中振荡6 h洗脱,取样检测。
1.3.2 分析方法
甲基橙比色法确定ε-PL质量浓度[14]。
检测料液被树脂吸附前后的ε-PL质量浓度,根据公式(1)计算树脂工作交换容量(qe):
(1)
式中:C0、C1,吸附前后料液的ε-PL质量浓度,g/L;V0、V1,吸附前后料液的体积,L;m,树脂质量,g。
检测吸附饱和的树脂在洗脱液中解吸的ε-PL质量浓度,根据公式(2)计算树脂解吸率:

(2)
式中:C2,洗脱液的ε-PL质量浓度,g/L;C0、C1,吸附前后料液的ε-PL质量浓度,g/L;V2,洗脱液的体积,L;V0、V1,吸附前后料液的体积。
考马斯亮蓝法确定蛋白质量浓度[15]。检测料液被树脂吸附前后的蛋白质量浓度,根据公式(3)计算蛋白去除率:

(3)
式中:P0、P1,吸附前后料液的蛋白质量浓度,g/L;V0、V1,吸附前后料液的体积,L。
文献发现,425 nm下发酵液存在可见光最大吸收峰[16],因此采用425 nm作为检测波长。检测料液被树脂吸附前后的色度,根据公式(4)计算色素去除率:

(4)
式中:R0、R1,吸附前后料液在425 nm下的色度;V0、V1,吸附前后料液的体积,L。
高效液相色谱(high performance liquid chromatography,HPLC)法分析检测ε-PL的纯度和聚合度[17-18]。对料液和树脂洗脱液进行取样,样品使用流动相进行稀释,最后用0.45 μm微滤膜过滤。ε-PL的纯度和聚合度检测波长分别为210、215 nm。
1.3.3 吸附等温线和热力学参数
活化的钠型SQD-04树脂2 g放入装有100 mL不同浓度发酵液的摇瓶中,在293、303、310 K下于200 r/min的摇床中振摇12 h,取样检测。采用2种吸附等温线模型[19]对实验结果进行拟合,如公式(5)、公式(6)所示:
Langmuir模型:
(5)
Freundlich模型:
qe/(mg·g-1)=KF×(Ce)1/n
(6)
式中:qmax,树脂最大交换容量,mg/g;Ce,吸附后料液的ε-PL质量浓度,mg/mL;KL、KF,Langmuir模型、Freundlich模型的模型常数;1/n,Freundlich模型的模型指数。
用公式(7)、公式(8)计算293、303、310 K下SQD-04树脂吸附ε-PL的热力学参数(ΔG、ΔH和ΔS)[19]:
ΔG/(kJ·mol-1)=-R×T×lnK0
(7)
(8)
式中:R,通用气体常数;T,温度,K;K0,热力学平衡常数。
1. 3. 4 膨胀比(E)对膨胀床吸附效果的影响
固定进料浓度(C0) 25 g/L和初始高径比(H0/D)4.0,改变膨胀比为1.2、1.4、1.6、1.8,料液进料1个柱体积(bed volume,BV)时取样并停止进料,使用去离子水洗涤,树脂上方的发酵液冲洗干净后,将柱中树脂取出,一定体积的去离子水浸泡并超声,使树脂表面截留的菌体充分混匀于去离子水中后取样。分析检测进料前后ε-PL质量浓度差(ΔC)、树脂饱和度(qe/qmax)以及菌体截留指标,菌体截留情况在600 nm下测得。
1.3.5 初始高径比(H0/D)对膨胀床吸附效果的影响
固定进料浓度(C0)25 g/L和膨胀比(E)1.6,改变H0/D为2.7、3.3、4.0,料液进料1个柱体积时取样并停止进料,使用去离子水洗涤,树脂上方的发酵液冲洗干净后,将柱中树脂取出,一定体积的去离子水浸泡并超声,使树脂表面截留的菌体充分混匀于去离子水中后取样。分析检测进料前后ε-PL质量浓度差(ΔC)、树脂饱和度(qe/qmax)以及菌体截留指标。
1.3.6 进料浓度(C0)对膨胀床吸附效果的影响
固定膨胀比(E)1.6和初始高径比(H0/D)2.7、4.0,改变C0为15、20、25 g/L,料液进料1个柱体积时取样并停止进料,分析检测进料前后ε-PL质量浓度差(ΔC)、树脂饱和度(qe/qmax)指标。
1.3.7 三柱串联膨胀床循环工艺的构建与优化
按照图1构建工艺装置,对速度(v1)进行优化,分别以1、2、3 BV/h的速度进料,每个柱体积进行取样检测,当C3的ε-PL质量浓度达到进料ε-PL质量浓度的5%,视为穿透,停止进料。根据实验结果分析,以每个柱子的树脂饱和度(qe/qmax)、总进料量、总收率为指标确定最佳速度v1。

图1 三柱串联膨胀床循环工艺装置图Fig.1 Three-column series circulating expanded bed process device diagram注:a、b、c、d为蠕动泵
2 结果与分析
2.1 大孔强酸树脂的筛选
由于ε-PL是一种富含多阳离子的聚合物,因此利用离子交换吸附提取ε-PL往往需要选择阳离子树脂,而目前使用固定床吸附提取ε-PL均选择弱酸钠型/铵型阳离子交换树脂[20]。主要是因为弱酸钠型/铵型阳离子树脂吸附量大,可以达到300 mg/g左右。然而,在何洪刚等[21]的研究中发现,弱酸树脂吸附ε-PL过程中料液pH会逐渐升高,甚至到pH 9.0左右,而发酵液pH到5.0以上,ε-PL就会被菌体自带的分解酶大量降解[22-23]。因此,弱酸阳离子树脂不能用于直接从发酵液中吸附提取ε-PL。前期预实验发现,强酸树脂用于发酵液吸附提取ε-PL不会造成料液pH变化。所以,本研究首先需要筛选适用于膨胀床的大孔强酸阳离子交换树脂。另外,基于弱酸阳离子树脂研究发现,钠型树脂工作交换容量通常会优于氢型,所以本研究考虑直接筛选钠型强酸树脂用于膨胀床。
由图2-a可知,钠型树脂SQD-04、D072、D061的工作交换容量较高,分别达到294.37、286.07、279.57 mg/g;图2-b发现3种树脂洗脱液的解吸率分别为70.59%、67.53%、59.10%;蛋白去除率为58.25%、55.76%、56.53%;色素去除率为97.83%、97.20%、98.18%。利用HPLC对3种树脂洗脱液进一步检测,结果如图3所示。SQD-04、D061、D072树脂洗脱液的纯度分别达到94.97%、62.44%、57.81%(图3-a),而聚合度分析发现,SQD-04树脂洗脱液的低聚合度(5~25)ε-PL较少(图3-b)。本研究想要筛选出工作交换容量较高,可以较好地去除杂质并能得到较高聚合度(>25)ε-PL 的树脂,因此,根据上述实验结果选择钠型树脂SQD-04进行后续研究。

a-树脂工作交换容量;b-洗脱液的解吸率、蛋白去除率与色素去除率图2 不同钠型树脂吸附和解吸参数Fig.2 Adsorption and desorption parameters of different Na+ form resins

a-发酵液与洗脱液的纯度;b-发酵液与洗脱液的聚合度图3 发酵液与洗脱液的纯度和聚合度Fig.3 Purity and degree of polymerization of fermentation broth and eluate
2.2 吸附等温线和热力学参数
图4 是Langmuir和Freundlich模型对不同温度下SQD-04树脂吸附不同质量浓度(7.09、15.83、17.34、26.01、35.30 mg/mL)发酵液中ε-PL实验结果的线性拟合;由表2可知,Langmuir吸附等温线模型的R2>0.99,Freundlich吸附等温线模型的R2>0.65。高相关系数表明,Langmuir吸附等温线模型适用于描述研究浓度范围内钠型SQD-04树脂吸附发酵液中ε-PL体系。同时,由图4和表2可知,随着温度的升高,模型常数在减小,说明升高温度不利于SQD-04对ε-PL的吸附。

a-Langmuir模型的线性相关关系;b-Freundlich模型的线性相关关系图4 吸附等温线模型对不同温度下SQD-04树脂吸附发酵液中ε-PL实验结果的线性拟合Fig.4 Linear fitting of adsorption isotherm model to SQD-04 resin adsorption experiment results of ε-PL in fermentation broth at different temperatures

表2 不同温度下SQD-04树脂吸附发酵液中ε-PL的Langmuir和Freundlich参数Table 2 Langmuir and Freundlich parameters of ε-PL in fermentation broth on SQD-04 resin at different temperatures
由表3可知,ΔG为负值且随着温度的升高而降低,表明SQD-04树脂对发酵液中ε-PL具有良好的吸附作用,且293 K下比其他温度更容易进行吸附;ΔH的负值表明SQD-04树脂的吸附过程是放热的,温度的升高会对吸附过程产生负面影响;ΔS的正值表明吸附过程中系统的总无序性增加。所以,根据吸附等温线模型拟合结果和热力学参数,SQD-04对ε-PL的吸附在293 K下较为合适。
2.3 膨胀比对膨胀床吸附效果的影响
膨胀比(E)为膨胀床高度与固定床高度的比值,是影响膨胀床工艺的关键因素之一。由图5-a可知,当E=1.2时,树脂膨胀比较小,树脂之间的空隙较窄,导致菌体截留较多(OD600=0.69);当E提高到1.4和1.6,树脂之间的空隙增大,菌体截留迅速减少(0.13和0.07);而当E继续提高到1.8时,树脂空隙虽然继续变大,但菌体截留(0.05)相比E为1.6时降低的并不明显。总体来看,E越大,菌体截留越少,这意味着进料过程中柱子堵塞风险降低。

表3 不同温度下SQD-04树脂吸附发酵液中ε-PL的热力学参数Table 3 Thermodynamic parameters of adsorption of ε-PL in fermentation broth by SQD-04 resin at different temperatures
由图5-b可知,E从1.2增加到1.8,进料1个柱体积前后ε-PL质量浓度差(ΔC)从0.49 g/L减少到0.21 g/L,树脂饱和度(qe/qmax)从4.90×10-3下降到2.06×10-3,说明ΔC和qe/qmax在不断减小,原因是随着E的提高,进料速度加快,在一定程度上加快了对床层的穿透,树脂与料液中ε-PL的接触时间缩短,从而影响了树脂对ε-PL的吸附效率,导致ΔC和qe/qmax越来越小,DE SOUSA等[10]在膨胀床吸附503抗原穿透曲线的建模与模拟的研究中也表明了这一观点,膨胀比的增加使进料速度提高,导致了树脂吸附效率的降低。因此,根据上述指标分析,选择膨胀比1.6进行后续研究。
2.4 初始高径比对膨胀床吸附效果的影响
初始高径比(H0/D)也是影响膨胀床工艺关键的因素之一。由图6-a可知,随着H0/D的增高,菌体截留也在提高(从0.04增长到0.07),表明了随着H0/D的增加,进料过程中柱子堵塞风险可能会升高。由图6-b可知,H0/D从2.7提高到4.0,ΔC从0.22 g/L增加到0.24 g/L,说明在相同的膨胀比下,ΔC在逐渐增大,这是由于直径相同,H0/D的增高意味着树脂床层高度的增加,传质单元数也会随之增加,料液流经床层的停留时间会变长,使吸附过程更充分,从而ΔC越来越大;但qe/qmax却从3.31×10-3降低到2.50×10-3,说明树脂饱和度在逐渐变小,表明一定时间内树脂的吸附效率降低,这是由于树脂床层高度的增高代表了树脂的量变多,树脂达到吸附平衡的时间会相应延长,导致qe/qmax越来越小。文献中也报道了这种现象[24],高径比的增加,对过程效率具有负面影响,对柱效率具有正面影响。因此,考虑柱效率,可选择H0/D为4.0进行后续研究;考虑过程效率,可选择H0/D为2.7进行后续研究。

a-菌体截留;b-ε-PL质量浓度差(ΔC)、树脂饱和度(qe/qmax)图5 不同膨胀比下料液进料一个柱体积的ΔC、qe/qmax及菌体截留Fig.5 ΔC,qe/qmax and bacterial rejection of one column volume of feed liquid with different swelling ratio
2.5 进料浓度对膨胀床吸附效果的影响
进料浓度(C0)对膨胀床工艺也具有关键影响。由图7可知,固定膨胀比为1.6,初始高径比为2.7时,随着C0的提高,ΔC从0.15 g/L增加到0.22 g/L,qe/qmax从2.31×10-3提高到3.31×10-3;初始高径比为4.0时,随着C0的提高,ΔC从0.18 g/L增加到0.24 g/L,qe/qmax从1.79×10-3提高到2.50×10-3,说明了在相同的膨胀比和初始高径比下,ΔC和qe/qmax都在不断增大,原因是研究的浓度范围内,树脂吸附效率与料液浓度呈正相关关系,因此在相同的停留时间内,随着C0的增加,树脂对ε-PL的吸附效率逐渐提高,平衡时间相应缩短,这与LIKOZAR等[25]研究一致,因此选择初始质量浓度25 g/L进行后续研究。

a-菌体截留;b-ε-PL质量浓度差(ΔC)、树脂饱和度(qe/qmax)图6 不同初始高径比下料液进料一个柱体积的ΔC、qe/qmax及菌体截留Fig.6 ΔC, qe/qmax and bacterial rejection of feed solution injection one column volume with different initial height-to-diameter ratio
综合分析,若注重柱效率(以ΔC和菌体截留为指标),应选择C0为25 g/L,E为1.6,H0/D为4.0用于后续研究;若注重过程效率(以qe/qmax和菌体截留为指标),应选择C0为25 g/L,E为1.6,H0/D为2.7用于后续研究。
2.6 三柱串联循环膨胀床工艺的构建与优化
按照前期单因素试验结果,发现膨胀床工艺需采用多柱串联,但如果只进行简单的多柱串联,那柱子的数量将会无限多。因此,根据实际工艺应用的要求,设计了图1所示的三柱串联膨胀床循环工艺。并且出于工业应用的需要,在三柱串联膨胀床循环工艺中选择了C0为25 g/L,E为1.6,H0/D为2.7用于后续优化,这是因为操作时间短、吸附效率高是提高收率的必要条件。
由图8可知,v1为1 BV/h时,在第13个柱体积时3#柱穿透;而v1为2、3 BV/h时,3 #柱在第9、7个柱体积时达到穿透。由表4可知,当v1变大,3#柱达到穿透时,1# 柱的qe/qmax从0.76降低到0.37,2#柱的qe/qmax从0.33降低到0.16,3#柱的qe/qmax从0.13降低到0.04,处理的料液体积从13个柱体积减少到7个柱体积,总收率从98.20%降至96.84%。这是因为随着v1变大,循环液的ε-PL质量浓度逐渐升高,虽然树脂的吸附效率随着循环液浓度的提高而提高,但由于树脂膨胀比较高,柱子中料液循环速度较快,较高的浓度和较快的速度会加快料液对树脂床层的穿透,从而使每根柱子流出液的ε-PL质量浓度逐渐升高,导致3 #柱的穿透时间缩短。所以,当v1较大时,三柱串联膨胀床循环工艺会很快穿透,虽穿透时间缩短,但是吸附效率会降低,总收率也在减小,因此若想在v1较高的情况下实现应用,需要增加柱子的数量。
综合分析,当树脂初始高径比为2.7,膨胀比为1.6 下,进料质量浓度为25 g/L,v1为1 BV/h时进料,3#柱达到穿透时,1#柱的qe/qmax达到0.75以上,总收率为98.20% ,证明了三柱串联膨胀床循环工艺在v1≤1 BV/h 下是可以被应用的。

a-ε-PL质量浓度差(ΔC);b-树脂饱和度(qe/qmax)图7 不同进料浓度下料液进料一个柱体积的ΔC、qe/qmaxFig.7 ΔC, qe/qmax of one column volume of feed liquid injection at different feed concentrations

a-v1=1 BV/h下各出口ε-PL质量浓度变化;b-v1=2 BV/h下各出口ε-PL质量浓度变化;c-v1=3 BV/h下各出口ε-PL质量浓度变化图8 不同v1下每个柱体积各出口ε-PL质量浓度变化Fig.8 The change of ε-PL mass concentration at each outlet of each column volume under different v1
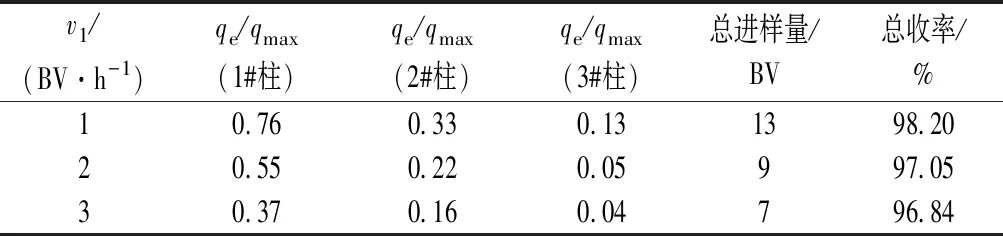
表4 不同v1下3#柱穿透时三柱串联膨胀床循环工艺参数Table 4 Technological parameters of three-column series circulating expanded bed when 3# column penetrates under different v1
3 结论
为了取消ε-PL提取工艺中的固液分离操作,并降低分离提取成本和提高提取效率,本研究尝试建立了一种大孔强酸性阳离子树脂利用膨胀床从发酵液中直接吸附提取ε-PL的工艺。研究从8种强酸树脂中筛选确定了SQD-04用于膨胀床;吸附等温线模型和热力学参数研究表明,SQD-04吸附ε-PL符合Langmuir吸附等温线模型,且为放热反应。进一步膨胀床工艺条件优化发现,若注重柱效率,C0为25 g/L、E为1.6、H0/D为4.0条件下最优;若注重过程效率,C0为25 g/L、E为1.6、H0/D为2.7条件下最优。最后,优化了三柱串联膨胀床循环工艺中上样速度(v1)。结果表明,在树脂高径比为2.7,膨胀比为1.6下,进料质量浓度25 g/L,速度v1为1 BV/h进料,3#柱穿透时,1#柱的树脂饱和度可达到0.76,总进料量为13个BV,总收率为98.20%,证明了三柱串联膨胀床循环工艺是可以实现的。虽然三柱串联膨胀床循环工艺可以提高提取效率,但若进行放大试验且应用在工业上,该工艺可以与模拟移动床设计相结合,以实现吸附-洗涤-洗脱的连续操作。

