水稻纹枯病生防木霉菌分离鉴定及适应性研究
金辉,王伟,颜尘栋,王薇,李熙英
(延边大学农学院,吉林延边 133000)
由立枯丝核菌(Rhizoctonia solaniKühn)侵染引起的水稻纹枯病是世界各产稻区普遍发生的水稻病害之一[1]。常造成水稻产量降低,一般减产10%~30%,严重时达到50%[2]。近年来,随着现代水稻品种的推广和氮肥使用量的增加,水稻纹枯病的危害在全国呈上升趋势,一些地区已超过了稻瘟病的危害[3]。
目前,对水稻纹枯病的防治方法主要有农业防治、生物防治以及化学防治方法。化学防治污染较大,对环境具有明显的破坏,并且病菌抗药性日益增强,加上目前尚未发现免疫或高抗品种,使得水稻纹枯病的防治工作越来越难;生物防治是现阶段防治水稻纹枯病的重要手段,具有广阔的应用前景[4]。束震[5]发现,木霉菌(Trichodermaspp.)是优良的生防菌株,哈茨木霉菌也是普遍存在于土壤中的重要微生物种群,营养竞争、重寄生、抗生作用及促进作物生长作用使其成为植病生防的重要因子。
木霉属(Trichoderma)真菌繁殖速度快,具有安全无毒、环保、有效等特点,能防治多种植物病害,尤其对立枯丝核菌、镰刀菌属(Fusarium)、疫霉菌属(Phytophthora)、腐霉菌属(Pythium)、链格孢菌属(Alternaria)等引起的幼苗立枯病、疫霉病、猝倒病等有较好的防治效果[6]。木霉菌在防治植物病害过程中能促进植物生长、改善土壤环境条件、提高植物抗逆性,具有良好的应用潜力[7]。目前,国内外用于生物防治的木霉菌菌株主要有以下8种:哈茨木霉(Trichoderma harz)、钩状木霉(Trichoderma hooked)、多孢木霉(Trichoderma polysporidis)、长枝木霉(Trichoderma longifolia)、康宁木霉(Trichoderma corning)、绿粘帚霉(Gliocladium virens)、绿色木霉(Green wood mold)、棘孢木霉(Trichoderma asperellum),其中哈茨木霉和绿色木霉已作为生防制剂在田间广泛应用[8]。王艳丽等[9]报道,哈茨木霉对水稻纹枯病的防效可达到62.48%~72.29%;董晓军等[10]通过固体和液体发酵制备的3种木霉菌制剂对番茄灰霉病田间防效均超过60%,相当于50%腐霉利可湿性粉剂1 500倍液的防效。本研究从本地土壤中分离、筛选和鉴定出对水稻纹枯病菌具有较强生防作用的木霉菌菌株,研究了及其适应性,为水稻纹枯病的生物防治提供依据。
1 材料与方法
1.1 材料
1.1.1 供试菌种 水稻纹枯病菌(Rhizoctonia solani)、人参立枯病菌(Rhizoctonia solani)、玉米弯孢霉叶斑病菌(Curvularia lunata)、人参黑斑病菌(Alternaria panax)、水稻恶苗病菌(Fusarium moniliforme)、人参锈腐病菌(Cylindrocarpon destructans)、人参灰霉病菌(Botrytiscinerea)、辣椒炭疽病菌(Colletotrichum capsici)由延边大学农学院植物病理研究室保存。
1.1.2 供试土样 在延边大学农学院实习基地的玉米、西红柿、芹菜、辣椒、丁香树、毛白杨、榆树、油松、苹果和梨田地,采集植物根际15—20 cm土层样品。将土样碾碎,自然晾干后放在4℃冰箱保存用于筛选木霉菌。
1.1.3 供试培养基 马铃薯葡萄糖培养基(potato dextrose agar,PDA):1 000 mL蒸馏水,200 g去皮马铃薯,18 g琼脂粉,20 g葡萄糖。
孟加拉红培养基:KH2PO41 g,MgSO4·7H2O 0.5 g,葡萄糖10 g,蛋白胨5 g,氯霉素0.1 g,孟加拉红0.03 g,琼脂18 g,蒸馏水1 000 mL。
PDB培养基:去皮马铃薯200 g,葡萄糖20 g,蒸馏水1 000 mL。
MEA培养基:麦芽糖30 g,蛋白胨3 g,琼脂15 g,蒸馏水1 000 mL。
1.1.4 供试药剂 1.5%多抗霉素、75%百菌灵、50%多菌灵、50%腐霉利、80%代森锰锌均购自本地农药商店,胶回收试剂盒购自OMEGA公司。引物合成和测序由吉林省库美生物科技有限公司完成。
1.1.5 仪器设备 H-B11-800恒温培养箱,上海市跃进医疗器械一厂;B203LED光学显微镜,重庆奥特光学仪器有限公司。
1.2 土壤中木霉菌分离及纯化
木霉菌分离采用稀释涂布平板法:取10 g土样加入90 mL无菌水,120 r·min-1恒温振荡器中震荡10 min后进行梯度稀释,取10-2、10-3、10-4稀释液0.3 mL涂抹于孟加拉红培养基平板上,每个处理重复3次,于25℃培养箱中倒置培养。待长出菌落,统计培养皿中的真菌菌株数,挑菌丝制成玻片在显微镜下观察其分生孢子和分生孢子梗的形态,根据菌落的形态特征[11]确定木霉菌菌株,挑取单个菌丝接种到PDA培养基上,连续3代挑取菌丝纯化培养,并在4℃下低温保存备用。
1.3 抑菌率测定
从纯化好的木霉菌与水稻纹枯病菌的菌落边缘,分别取直径为5和7 mm的菌饼,在PDA平板中央放置纹枯病菌菌饼,两端各2 cm处放木霉菌菌饼,每个处理设3个重复,以只接纹枯病菌菌饼的平板为对照,于25℃恒温培养箱培养。每天观察和测量病原菌菌落生长直径,直至对照菌落长满整个平皿为止,计算抑菌率。

1.4 木霉菌菌株发酵浓缩液制备及抑菌鉴定
将纯化好的木霉菌株用打孔器取直径5 mm菌饼,取4个菌饼接种于100 mL PDB培养液中,28℃、120·min-1恒温摇床培养7 d,6 000 r·min-1离心20 min得上清液。用旋转蒸发仪将上清液浓缩至10 mL,即为发酵浓缩液。将活化好的水稻纹枯病菌菌株,用7 mm的打孔器取菌饼,接种于在PDA平板中央,在距离菌饼中心1.5 cm处对称放置滴上100μL发酵浓缩液的直径8 mm的滤纸片,置于25℃恒温培养箱中培养。每个处理重复3次,以只接病原菌菌饼为对照。调查菌落生长情况并计算抑菌率,采用邓肯氏新复极差法来比较差异。
1.5 D1菌株对水稻纹枯病菌的防治试验
当水稻幼苗长到三叶一心至四叶一心期,移栽桶(桶高19.5 cm;桶口直径11 cm;桶底直径7.5 cm)装盆栽基质6 kg,将四叶期的水稻秧苗移栽到桶中,每桶3丛,每丛3株,按正常管理。
水稻纹枯病菌接在15 cm的已灭菌稻杆上,25℃培养箱中培养7 d,备用。待水稻进入分蘖末期时接菌稻杆插在稻丛中央诱发纹枯病病。
取2个活化好的D1菌株平板,用无菌水制成孢子悬浮液(10倍显微镜下每视野100个孢子左右),喷湿稻株的方法进行接菌。
试验设6个处理:接病菌24 h后D1菌株处理(T1)、同时接病菌和D1菌株处理(T2)、喷D1菌株24 h后接病菌(T3)、只喷D1菌株(T4),对照组设置为只接病菌(CKP)、只喷无菌水(CKW)。每处理10桶,30丛水稻。处理3周后按水稻纹枯病9级标准[12]调查记载病情。计算病情指数和防治效果,水稻成熟期测各处理产量构成因素及产量。
1.6 水稻纹枯病生防木霉菌D1的鉴定
1.6.1 D1菌株的形态学特性观察 D1菌株接种在直径90 mm的PDA和MEA平板中央,置于25℃培养箱内培养,观察菌落形态和生长速度。取25℃下培养3 d的菌落,在光学显微镜下观察分生孢子梗分枝角度、分生孢子着生情况等形态,测量分生孢子大小、分生孢子梗长度及主轴的宽度。
1.6.2 D1菌株的分子学鉴定 利用ITSrDNA引物(ITS1:3’-TCCGTAGGTGAACCTGCGG-5’;ITS4:3’-TCCTCCGCTTATTGATATGC-5’)进 行PCR扩增。反应体系:模板DNA 1μL,2×TaqMaster Mix 25μL,正反向引物(10μmol·L-1)各2μL,加dd H2O至50μL。反应程序:95℃5 min;95℃15 s;60℃15 s;72℃1 min;72℃5 min;4℃保温。PCR产物回收后送吉林省库美生物科技有限公司测序将序列在NCBI网站(https://www.ncbi.nlm.nih.gov)进行BLAST比对,获取同源性最高的前100个菌株序列,在GenBank网站登录序列,用GeneDoc软件和DNASTAR.Lasergene.v7.1版软件构建系统发育树。
1.7 D1菌株适应性研究
1.7.1 温度和pH 用活化好的D1菌株与水稻纹枯病菌菌株进行对峙培养。分别于10、15、20、25、30、35℃下恒温培养,每处理设4次重复,以只接纹枯病菌菌饼的平板为对照。
将PDA培养基的pH用1 mol·L-1的HCl和1 mol·L-1的NaOH调至4、5、6、7、8、9、10后制成平板。在不同pH的PDA培养基平板上用活化好的D1菌株与纹枯病菌菌株进行对峙培养。每个处理设4次重复,以只接病原菌菌饼的平板为对照。
1.7.2 杀菌剂 用多抗霉素、百菌清、多菌灵、腐霉利、代森锰锌5种药剂制成不同质量浓度的PDA平板(表1),以不加杀菌剂的培养基为对照。将7 mm直径的D1菌饼移接到带药培养基平板中央,置25℃培养箱培养3 d,测量菌丝生长直径,计算抑菌率。以质量浓度和抑菌率建立毒力方程,求出EC50值和EC90值[13]。将各杀菌剂田间常用量代入各毒力方程,得出该用量下对D1菌株的抑菌率。

表1 D1杀菌剂用量Table 1 Fungicides dosage in this study
2 结果与分析
2.1 不同土壤中分离的真菌和木霉菌株
由表2可见,9种植物根际土样中分离到的真菌菌株数和木霉菌菌株数均表现为在农田中较多、树木下的土壤中较少的趋势。其中玉米土样、芹菜土样和辣椒土样中分离到的真菌菌株数较多,为40种以上,其余土样分离到的真菌菌株数较少。

表2 不同土壤中分离的真菌和木霉菌菌株Table 2 Fungi and Trichodermastrains isolated from different soils
9种土样中分离出20株木霉菌菌株,其中玉米土样中分离纯化得最多,共有8株,编号为Y1~Y8;其次是芹菜土样,共6株,编号为Q1~Q6;再次是辣椒地土样,共4株,编号为L1~L4;西红柿土样和丁香树土样分别分离纯化出1株,编号分别为X1和D1;其余土样中未分离出木霉菌菌株。
2.2 木霉菌菌株及发酵浓缩液对水稻纹枯病菌菌株的抑制作用
从表3可以看出,分离的20株木霉菌菌株对水稻纹枯病菌均具有较强的抑菌作用,抑菌率在64.84%~80.82%之间,其中D1菌株的抑制效果最高,为80.82%;其次是Y7和Y5菌株,分别为76.71%和75.34%;再次是L2、L1、L3、Q4菌株,抑菌率在72.60%~73.97%之间,其余菌株的抑菌率在64.84%~69.86%之间。分离的20株木霉菌菌株发酵浓缩液对水稻纹枯病菌的抑菌率在4.53%~69.55%之间,其中D1菌株发酵浓缩液的抑制效果最好,为69.55%;其次为Y2、Y4、L4、Q5菌株发酵浓缩液,抑菌率为55.97%~62.14%;Y1和L3菌株发酵浓缩液抑菌率为48.56%,其余菌株发酵浓缩液的抑菌率在20.99%以下。
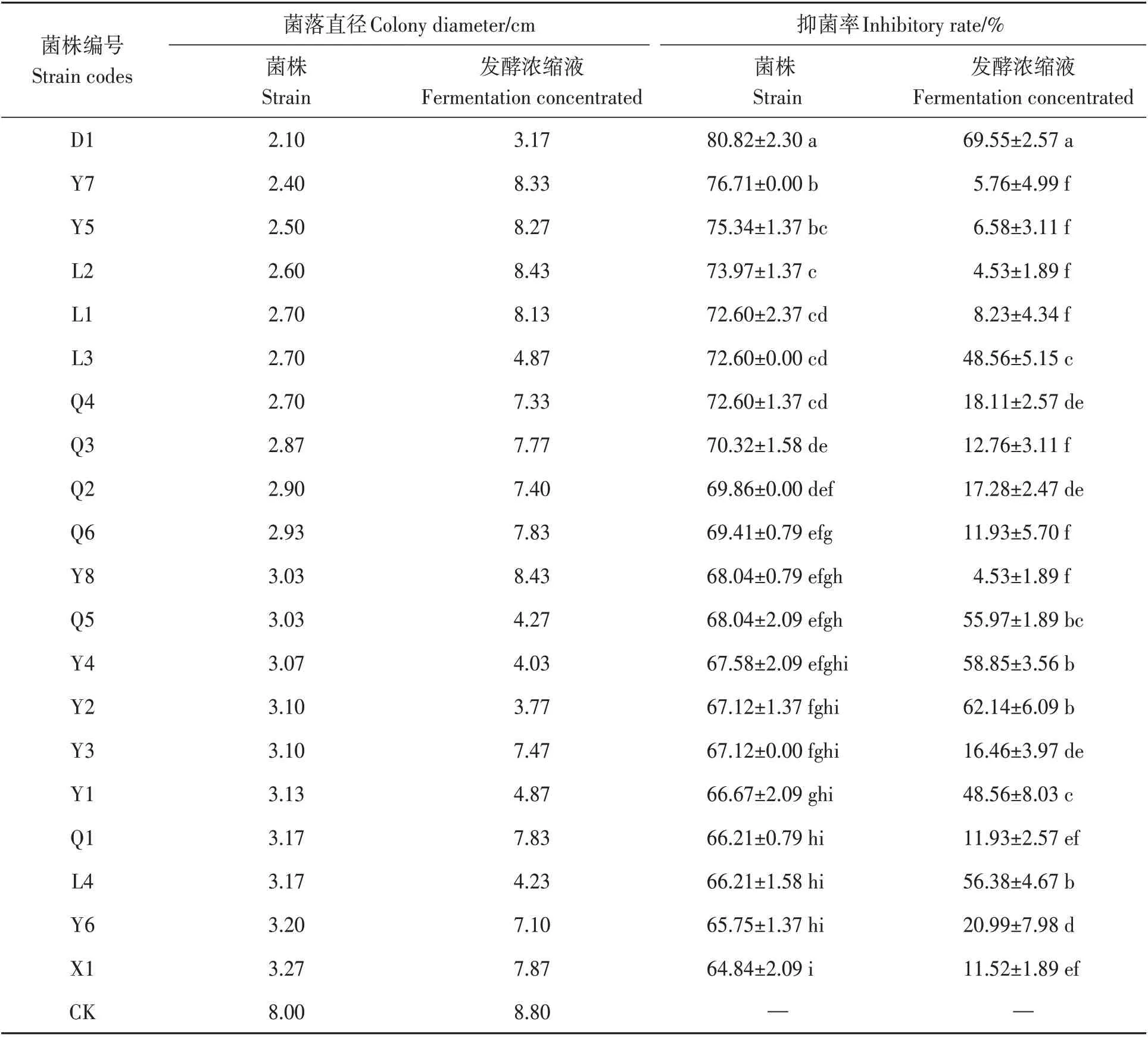
表3 木霉菌菌株及发酵浓缩液对水稻纹枯病菌的抑制作用Table 3 Inhibitory effects of trichoderma strain and fermentation concentrated on rice sheath blight
综合上述,D1菌株及其发酵浓缩液对水稻纹枯病菌的抑制作用较强,因此从这20株木霉菌菌株中选出D1菌株作为水稻纹枯病生防用木霉菌进行进一步研究。
2.3 D1菌株对水稻纹枯病的盆栽防治效果
由表4可见,D1菌株处理的病情指数显著低于只接病菌的对照(CKP),其中先用D1菌株处理24 h后接病菌(T3)的病情指数最低(11.72),防效为67.86%;同时接病菌和D1菌株处理(T2)的病情指数次之(14.19),其防效为61.09%;先接病菌24 h后用D1菌株处理(T1)的病情指数为17.83,其防效为51.12%。

表4 D1菌株对水稻纹枯病的防治效果Table 4 Control effect of strain D1 on rice sheath blight
由表5可见,穗数方面,只用D1处理(T4)、无菌对照(CKW)、D1+病菌不同处理(T1~T3)的穗数显著高于只接病菌的对照(CKP),其中只用D1菌株处理(T4)的穗数最高;穗粒数方面,不同处理的穗粒数显著多于直接病菌的对照(CKP)。其中,只用D1(T4)、无菌对照(CKW)、先D1+后病菌处理(T1)的穗粒数最多,其次为同时病菌+D1处理(T2)和先病菌+后D1处理(T3)的穗粒数;结实率方面,各处理的结实率均显著高于只接病菌的对照(CKP),其中只用D1(T4)、无菌对照(CKW)、D1+后病菌(T1)的结实率最高,其次为病菌+D1同时处理(T2)的结实率,再次为先病菌+后D1处理(T3)的结实率;千粒重方面,各处理的千粒重均显著高于只接病菌处理(CKP),其中只用D1(T4)和无菌对照(CKW)的千粒重最大,其次为病菌+D1的不同处理(T1~T3)的千粒重。

表5 D1菌株处理对水稻产量构成因素及产量的影响Table 5 Effects of D1 strain treatment on rice yield components and yield
产量方面,各处理产量均显著高于只接病菌处理(CKP),其中D1处理(T4)的产量最高,比无菌对照增产11.54%,比只接病菌处理(CKP)的增产121.38%;其次为先D1+后病菌处理(T3)的产量,比只接病菌处理(CKP)的增产96.13%;再次为病菌+D1同时处理(T3)和先病菌+后D1处理(T2)的产量,比只接病菌处理的分别增产65.50%和53.72%。
上述可见,D1菌株不会引起稻株发病,对水稻植株是安全的,并能增加水稻的产量,对水稻生长有一定的促进作用。从D1菌株对水稻纹枯病的防治效果和产量的影响可见,D1菌株对水稻纹枯病有预防和治疗作用,其中预防作用强于治疗作用。
2.4 D1菌株的鉴定
2.4.1 D1菌株的形态学鉴定 D1菌株菌落边缘均匀,菌丝为无色透明绒毛状,呈辐射状生长,后变绿,反面无色,在PDA培养基上2~3 d长满平皿,在MEA培养基上4~5 d长满平皿,产孢少。同心环纹初清晰,间距为1 cm,后不明显(图1)。分生孢子梗从菌丝侧枝产生,有隔膜,分生孢子梗长,主轴宽2.785μm,对生分枝,少间生,直或稍微弯曲的窄烧瓶形,尖端生分生孢子团,含孢子2~7个(图2)。分生孢子单细胞,椭球形,大小为4.085μm×3.470μm,厚垣孢子少。根据《木霉分类与鉴定》[11]以及Bissett的分类系统[14-17],从形态上初步鉴定D1菌株为木霉属。

图1 D1菌株在PDA培养基生长5 d的菌落形态Fig.1 Colony morphology of D1 strain growing on PDA mediumfor 5 d

图2 D1菌株的分生孢子梗Fig.2 Conidipphore stem of D1 strain
2.4.2 水稻纹枯病生防用木霉菌的分子学鉴定D1菌株的ITSrDNA序列大小为586 bp。将其序列在NCBI数据库中进行比对,并在GenBank上进行登录,登录号为MN833491。基于ITSrDNA序列构建系统发育树(图3),D1菌株与T.brevicompactumACCC32814(MF669734.1)、T.brevicompactumTB003(KX092002.1)、T.brevicompactumT205(HQ596986.1)相邻,亲缘关系非常近。结合菌株形态及培养特征,鉴定D1菌株为短密木霉(Trichoderma brevicompactum)。

图3 D1菌株基于ITSrDNA序列同源性菌株的系统发育树Fig.3 Phylogenetic tree of D1 strain based on ITSrDNA sequence homologousstrains
2.5 D1菌株的适应性
2.5.1 D1菌株对8种植物病原菌的抑制作用由表6可见,D1菌株对8种植物病原菌均具有较强的抑菌作用,其中D1菌株对辣椒炭疽病菌的抑菌率最高,为95.18%;其次是人参灰霉病菌和人参立枯病菌;再次是人参锈腐病菌、水稻纹枯病菌、玉米弯孢霉叶斑病菌和人参黑斑病菌的抑菌率;对水稻恶苗病菌的抑菌率最低,为63.03%。综合来看,D1菌株对8种植物病菌都有抑菌作用,抑菌谱较宽。

表6 D1菌株对8种植物病原菌的抑制作用Table 6 Inhibition of D1 strain on 8 kinds of plant pathogenic bacteria
2.5.2 不同条件对D1菌株抑菌作用的影响 在10~35℃范围内,D1菌株对水稻纹枯病菌均有较强的抑菌作用,其中D1菌株在20~30℃对水稻纹枯病菌的抑菌作用最强,抑菌率为76.15%~80.70%,其次是15℃,再次是10℃,35℃抑菌作用最弱(表7)。说明D1菌株在20~30℃有较强的抑菌活性。
在pH 4~10范围内,D1菌株对水稻纹枯病菌的抑菌率在69.60%~78.77%之间,其中pH 4~5时抑菌作用最强,抑菌率为78.57%~78.77%;其次是pH 6~7;pH 8~10抑菌作用最弱(表7)。说明D1菌株在pH 4~5时有较强的抑菌活性。

表7 不同温度和pH下D1菌株对水稻纹枯病菌的抑制作用Table 7 Inhibitory effect of strain D1 on the hyphae of Rhizoctonia solani under different temperature and pH
2.5.3 5种杀菌剂对D1菌株菌丝生长的抑制作用 由表8可见,50%多菌灵和50%腐霉利对D1菌株的毒力最大,其EC50值为0.042和0.301 mg·L-1,EC90值为0.100 mg·L-1和1.510 mg·L-1,田间常用质量浓度下对D1菌株的菌丝生长抑菌率高达100%;其次是1.5%多抗霉素和75%百菌清对D1菌株的菌丝生长抑菌率;80%代森锰锌对D1菌株菌丝生长毒力最小,其EC50值为383.24 mg·L-1,EC90值为5 271.42 mg·L-1,但田间常用质量浓度下的抑菌率仍为75.8%。

表8 不同杀菌剂对D1菌株菌丝生长的抑制作用Table 8 Inhibition effect of different pesticides on the mycelial growth of D1 strain
3 讨论
木霉菌广泛存在于潮湿、通气好、有机质丰富的土壤及植株根际中,大多数种类对植物病菌具有生物防治作用,是近年来学术研究最多的生防真菌种类[18]。本文在分离木霉菌菌株时发现,从玉米、辣椒、芹菜等作物根际土壤中分离的木霉菌较多,在油松、苹果梨树、丁香树、杨树等乔灌木根际土壤中分离的木霉菌较少,可能的原因是木霉菌的分布与植物类型、土壤微生物丰富度、土壤环境等因素有关,这与陈泉等[19]的研究结果类似。
本文采用室内平板对峙培养试验等从20株木霉菌菌株中筛选出D1菌株作为水稻纹枯病生防用木霉菌,经形态学和分子学鉴定为短密木霉(T.brevicompactum)。申君等[20]从蔬菜根际土壤中筛选出1株对辣椒根腐病具有较好防效的拮抗木霉菌Tb1,通过形态观察和18SrDNA基因序列分析,确定Tb1菌株为短密木霉菌,同时对其抑菌谱和稳定性进行测定,以期为设施蔬菜土传病害的绿色防控提供新的菌株资源和理论依据。郭成等[21]筛选的短密木霉菌株GAS1-1对玉米镰孢茎腐病菌(Fusarium graminearum)、玉米腐霉茎腐病菌(Pythium inflatum)和葡萄灰霉病菌(Botrytis cinerea)的抑菌率达60%以上;吴紫燕等[22]发现,2株短密木霉的液体发酵液对小麦纹枯病菌(Rhizoctonia ceralis)、番茄早疫病菌(Alternaria solani)和棉花枯萎病菌(F.vasinfectum)等植物病原菌的抑菌率达72%以上。本研究筛选的短密木霉D1菌株对8种植物病菌均具有较强的抑制作用,其中D1菌株对水稻纹枯病菌、辣椒炭疽病菌、人参立枯病菌和人参灰霉病菌的抑菌率均达79.92%以上,甚至对辣椒炭疽病的抑菌率达到95%;通过盆栽防病试验发现,利用D1菌株处理水稻后水稻产量不仅没有下降还有所增加,比无菌水处理提高了27.41%,说明D1菌株不仅不会引起水稻发病,对稻株是安全的,还能对水稻的生长有一定的促进作用。这与李松鹏[23]关于木霉菌促进水稻生长的研究结果类似。同时,本文发现,D1菌株对水稻纹枯病的防治效果在51.12%~67.86%之间,使用D1菌株处理的水稻结实率、千粒重和产量显著高于只接病菌处理,并且得出D1菌株对水稻纹枯病有预防和治疗作用,其中D1菌株对水稻纹枯病的预防作用强于治疗作用。这与潘玮[24]关于绿色木霉菌对辣椒疫霉菌的防治研究结论基本一致。
D1菌株在20~30℃时对水稻纹枯病菌的抑菌作用最强,为76.15~80.70%,pH 4~5时抑菌作用最强,抑菌率为78.57%~78.77%,说明D1菌株对温度和pH具有较强适应性。李雪婷等[25]发现,当pH 5时菌株S177-377对水稻纹枯病的抑菌作用最强达,高达95.85%,在pH 5时的抑菌率显著(P<0.05)高于其他培养条件下的抑菌率。在田间常用质量浓度下5种杀菌剂对D1菌株的抑菌率均较高,为75.8%~100%,说明在田间应用时应避免这些杀菌剂与D1菌株同时使用,在常年喷施这几种杀菌剂的土壤环境中不适宜施用D1菌株来进行生物防治。其中50%多菌灵、50%腐霉利在田间常用质量浓度下对D1菌株的抑菌率高达100%,原因可能是多菌灵和腐霉利属于治疗性杀菌剂有关。但室内的毒力测定结果只能说明杀菌剂对木霉菌的抑制作用,并不能完全说明杀菌剂和木霉菌共同施用后对病原菌的抑制作用[26],因此针对杀菌剂和木霉菌共同进行植物病害防治的方法还需进一步的研究。

