术前栓塞联合手术切除颅后窝实质性血管母细胞瘤的疗效分析
黄 成 马廉亭 秦尚振 姚国杰 杨 铭 潘 力 胡军民 秦海林
血管母细胞瘤是中枢神经系统较少见的良性富血管肿瘤,好发于颅后窝。中枢神经系统血管母细胞瘤伴视网膜血管瘤和肾囊肿,被称为希-林氏病(VHL)病[1]。颅后窝实质性血管母细胞瘤血供丰富,与脑干等邻近结构关系密切,术中止血困难,手术难度大。本文探讨术前栓塞联合手术切除颅后窝实质性血管母细胞瘤的疗效。
1 资料与方法
1.1 病例入组标准:MRI 显示颅后窝占位,术后病理诊断为实质性血管母细胞瘤;术前KPS评分≥80分;无造影剂过敏史;无心、肺、肝、肾等器官严重疾病;留有完整的临床资料及随访记录。
1.2 研究对象2011年1月至2021年6月手术治疗颅后窝实质性血管母细胞瘤56例,其中21例术前先行栓塞治疗,再行开颅手术切除肿瘤(观察组);另35例直接开颅手术治疗(对照组)。两组基线资料无统计学差异(表1;P<0.05)。
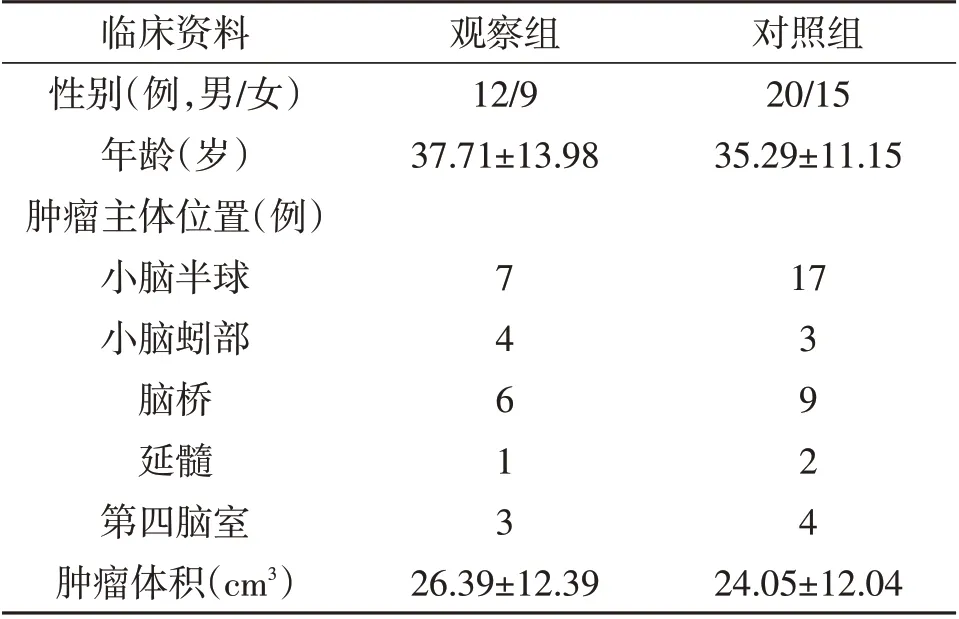
表1 两组病人基线资料
1.3 治疗方法
1.3.1 DSA 检查26 例术前行DSA 检查,显示肿瘤区域造影剂滞留,发现明确供血动脉25 例,其中单支动脉供血3 例(小脑后下动脉供血2 例,小脑上动脉供血1 例);其余22 例为多支动脉供血(小脑上动脉和小脑前下动脉共同供血5 例,小脑前下动脉和小脑后下动脉共同供血7 例,小脑上动脉和大脑后动脉共同供血3 例,小脑后下动脉和椎动脉分支共同供血4 例,小脑后下动脉、小脑前下动脉、小脑上动脉及分支供血1例;椎动脉、枕动脉分支供血2例)。
1.3.2 栓塞治疗 观察组21 例均在全麻下行栓塞治疗;对照组5 例尝试栓塞,其中3 例供血动脉分支细小微导管无法进入导致栓塞失败,2例因供血动脉分支极其迂曲使微导管难以超选越过共干正常血管而放弃栓塞治疗。
麻醉满意后,将导引管置入椎动脉或颈外动脉,用微导管(马拉松微导管或Echelon10 系列微导管)超选进入肿瘤的供血动脉,造影后注入栓塞材料(Onyx胶或NBCA胶)栓塞肿瘤供血动脉。实时复查造影,以入瘤供血血管和肿瘤染色消失为目的,避免误栓正常的供血动脉,并注意栓塞材料不能进入引流静脉。栓塞后即刻造影显示,8 例肿瘤染色完全消失,10例肿瘤染色大部分消失,2例肿瘤染色大部残留,1例造影剂少量外溢。
1.3.3 肿瘤切除术56例均行枕部后正中入路或旁正中入路手术切除肿瘤。按照界面原则,沿肿瘤边缘分离。先逐步离断供血动脉,再处理引流静脉,尽可能完整分离瘤体后行整块切除,术区彻底止血。观察组21例均在栓塞后72 h内行肿瘤切除术。
1.4 评估指标 记录肿瘤切除时间、术中出血量。术后2 周内复查头部MRI 增强(层厚2 mm),以MRI 三维体积分析软件计算肿瘤切除程度;术后1、3 周采用KPS评分评估预后。
1.5 统计学处理 应用SPSS 26.0软件处理;正态分布定量资料以±s表示,采用t检验;非正态分布定量资料以中位数表示,采用Mann-Whitney U 检验;定性资料采用χ2检验或Fisher精确检验法检验;以P<0.05为差异有统计学意义。
2 结果
2.1 治疗结果 与对照组相比,观察组肿瘤切除时间明显缩短(P<0.05),术中出血量明显减少(P<0.05),肿瘤全切除率明显提高(P<0.05),术后3 个月KPS评分明显改善(P<0.05)。见表2。
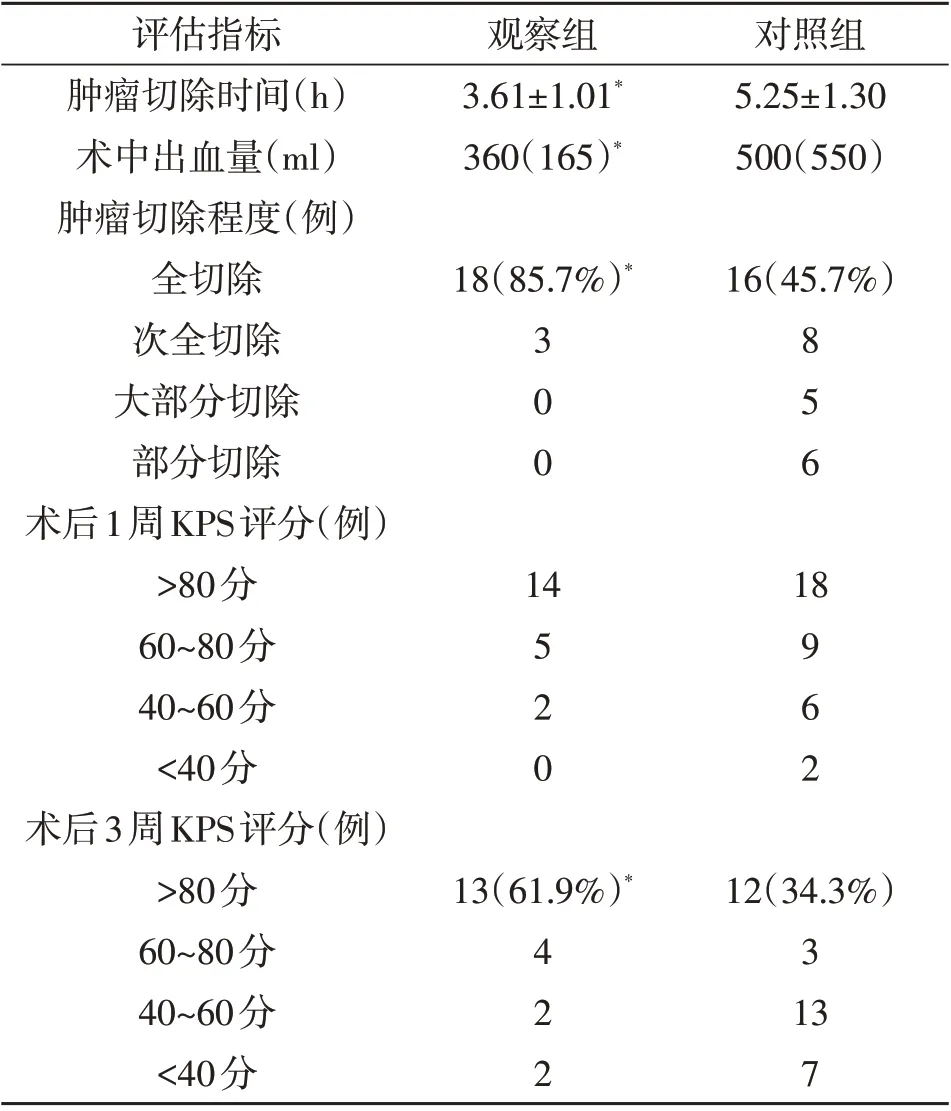
表2 两组治疗结果比较
2.2 典型病例41 岁男性,因行走不稳伴头晕恶心2个月余入院。术前MRI 检查显示颅后窝占位(图1A、1B)。DSA 示病变由小脑上动脉及小脑前下动脉供血(图1C)。行超选肿瘤供血动脉栓塞后(图1D),经枕部后正中入路手术切除肿瘤。术后复查MRI 显示肿瘤全切除(图1E、1F)。术后病理为实质性血管母细胞瘤。术后颅内压增高症状缓解,行走不稳明显改善。
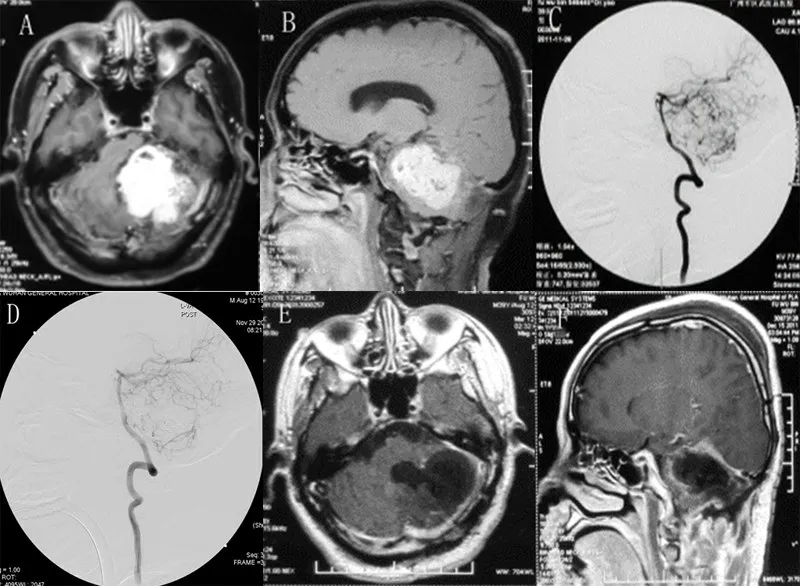
图1 颅后窝实质性血管母细胞瘤术前栓塞联合手术切除前后影像表现
3 讨论
实质性血管母细胞瘤约占血管母细胞瘤的20%,好发于成年男性,多为单发,多见于小脑半球、小脑蚓部、第四脑室及脑干等部位[2]。此类肿瘤供血丰富,由被大量毛细血管网包围的间质细胞组成,血管造影早期可显示不规则团块状或结节状肿瘤染色和早现的粗大迂曲引流静脉。目前,手术是实质性血管母细胞瘤的主要治疗手段,但此类肿瘤多位于颅后窝且毗邻脑干,血供丰富,手术风险高,全切除难度大,术后复发率高。随着介入技术的广泛开展,术前栓塞肿瘤供血动脉极大地提高了此类肿瘤切除的安全性。
3.1 术前栓塞的意义和应用方法 实质性血管母细胞瘤血供丰富,常见供血动脉为小脑前下动脉、小脑后下动脉、大脑后动脉、小脑上动脉以及椎动脉分支等血管,此外颈外动脉系统的枕动脉和脑膜中动脉后支亦可参与供血。此类肿瘤手术切除时出血较多,影响术野的观察,干扰肿瘤的分辨剥离,增大了脑组织保护难度,术后并发症多。了解此类肿瘤的血供情况是提高手术安全性的前提,血管造影可使肿瘤异常血管网染色,并可确认肿瘤供血动脉及引流静脉的位置,所以建议术前常规行脑血管检查了解肿瘤供血动脉来源及引流静脉,必要时行肿瘤供血动脉介入栓塞,以利于制定肿瘤切除方案,减少术中出血,并尽可能地全切除肿瘤。由于此类肿瘤多存在多支供血动脉,因此DSA检查应将双侧椎动脉、颈外动脉包括在内。文献报道,颅后窝实质性血管母细胞瘤在DSA明确肿瘤血供的基础上进行术前超选择栓塞供血动脉,能有效减少术中出血,获得良好的手术视野,缩短手术时间,有利于肿瘤切除[3,4]。
但术前栓塞应严格掌握适应证。一般认为,颅后窝实质性血管母细胞瘤栓塞的血管选择原则为:尽量超选到入瘤血管进行栓塞,避免栓塞与正常脑血管共干的供血动脉,确保不损伤正常脑组织,特别是脑干的血供;其次,对于肿瘤供血动脉细小或迂曲成角、微导管难以到位的病例,操作不当可造成栓塞材料返流导致误栓、导管机械损伤以致出血等严重并发症。本文12例肿瘤供血动脉较细或成角,微导管难以到位而无法完全栓塞。有报道显示实质性血管母细胞瘤过度栓塞可能会增加正常灌注压突破综合征导致的出血风险[5]。本文1 例因致密栓塞导致瘤周出血。因存在误栓风险,有学者认为直径大于3 cm的实性血管母细胞瘤才有术前栓塞的必要[6]。
尽管术前完全栓塞肿瘤供血动脉可大幅度减少肿瘤切除术中出血,提高肿瘤全切率,但误栓可导致难以挽回的永久性神经功能障碍,且缺乏有效补救措施。本文结果显示肿瘤供血动脉部分栓塞仍可明显降低手术难度,缩短手术时间,提高肿瘤全切除率,减少术后并发症,因此,我们认为,术前栓塞的主要目的在于尽量确保安全的前提下减少术中出血,并非要完全阻断肿瘤的血供。我们的经验是优先栓塞深部腹侧及较大供血血管;对脑干深部肿瘤,部分栓塞供血动脉以尽量避免脑干缺血引发严重并发症。
目前,栓塞后最佳手术时机仍存争议。有学者指出栓塞术后3 d 内行手术切除肿瘤可尽量避免继发的肿瘤卒中和瘤周水肿,而体积较大的肿瘤在术前栓塞后可出现肿胀导致体积增大,若合并瘤周水肿甚至可能继发脑疝[7]。张向阳和黄书岚[8]认为栓塞后多数瘤体在1周内明显缩小,故术后1周内行手术治疗可明显减少术中出血。还有研究认为栓塞术后3 周左右肿瘤逐渐坏死、软化后再行手术切除效果更佳[9]。本文观察组21例均在栓塞术后当日或次日手术切除肿瘤,未见继发肿瘤卒中等栓塞并发症。
3.2 显微手术治疗的经验 由于实质性血管母细胞瘤的富血供特征,手术原则为尽量包膜外分离并全切除,且应依照脑动静脉畸形的切除方法,严格遵循由浅入深、逐步推进原则,先逐步离断供血动脉,再游离肿瘤,待引流静脉由鲜红转变成暗红色、瘤体张力降低及体积缩小后,以术中超声确定肿瘤无大的供血动脉残留时,再切断引流静脉,最后切除肿瘤。部分实质性血管母细胞瘤内的供血动脉及引流静脉不易辨别,可利用临时阻断法,即临时阻断此血管,若肿瘤缩小,则为供血动脉;若肿瘤肿胀,则为引流静脉[10]。此外,此类肿瘤内常有异常短路血管,引流静脉常表现为鲜红色、搏动明显,与供血动脉不易鉴别,可电凝长度为血管直径的2倍,从中间切断已电凝的血管,血管断端出血,血管不会退缩,利于进一步原位电凝止血。术前注意常备动脉瘤夹,对较大口径的供血动脉,需行阻断后完成电凝操作,减少出血。
术中应严格在肿瘤与脑组织间的蛛网膜间隙操作,尽量避免瘤内操作,切忌行肿瘤穿刺,这可引发难以控制的肿瘤出血。对深部的肿瘤,可使用术中超声,实时了解肿瘤供血动脉及引流静脉走行,并确定肿瘤周围重要血管位置。对临近脑干的肿瘤,术中电生理监测可有效评估神经功能状态,提高手术安全性。对切除脑干内肿瘤,虽然术前栓塞使肿瘤腹侧供血减少,但仍不可盲目全切除,以免造成脑干功能严重损伤。此外,还应密切关注心率、血压变化,若心率过低,要即刻暂停手术操作。有报道证实亚低温麻醉能降低脑的代谢耗氧量,减轻脑水肿,降低颅内压,增强脑组织对缺血损伤的耐受性,适用于较长时间脑肿瘤手术[11]。另外,肿瘤切除后,周围脑组织恢复正常灌注压,可出现瘤床出血或瘤周水肿,此时应注意控制血压,可有效降低围手术期正常灌注压突破综合征的发生率。

