1例表现为非典型性血管增生的放射性口腔黏膜炎
王显文 陈谦明 江潞
口腔疾病研究国家重点实验室 国家口腔疾病临床医学研究中心四川大学华西口腔医院口腔黏膜病科,成都 610041
放射性口腔黏膜炎(radiation-induced oral mu‐cositis,RIOM)是放射线电离辐射所引起的急性或慢性口腔黏膜损伤,临床常见于头颈部肿瘤接受放射治疗的患者,是放射治疗常见的并发症。RIOM 常因对患者的生活质量造成明显影响,从而阻碍放射治疗的进程,甚至终止治疗,因而成为临床备受关注的放射治疗并发症。RIOM 主要表现为口腔黏膜充血、糜烂和溃疡,患者疼痛明显且常伴有继发性感染和全身症状,放射治疗后引发的口腔黏膜非典型性血管增生未见报道。本文报道1例颌面部恶性肿瘤放射治疗后发生口腔黏膜非典型性血管增生的病例,结合病例的诊治经过及既往文献报道,讨论继发于放射治疗的非典型性血管增生的发生机制并探讨其治疗方案。
1 病例报道
患者,女性,63 岁,出现腭部、舌部糜烂伴疼痛3 年,出现口内黏膜红色丘疹病损1 年。3 年前患者因左舌癌行“原发灶扩大切取+淋巴清扫术+股前外游离皮瓣移植术”,病理诊断为左舌口腔鳞状细胞癌,术后行颌面部放射治疗。放射治疗时,患者口腔黏膜开始出现反复糜烂疼痛,诊断为“放射性口炎”并进行药物治疗。具体用药包括口服强的松和免疫调节剂(中成药),局部使用减轻炎症、促进愈合的中西药口腔制剂联合2%碳酸氢钠溶液含漱。放射治疗结束后症状仍反复,1年前口内黏膜出现广泛红色丘疹样病损。患者确诊干燥综合征10 余年(未规律用药)。否认外伤史、家族史及药敏史。
临床检查:舌背、双侧舌腹、硬腭、软腭黏膜大面积充血,黏膜表面完整,黏膜下可见广泛毛细血管增生;舌背前份丝状乳头萎缩;口内湿润度差,挤压3 对大唾液腺未见明显唾液排泌(图1)。

图1 口内检查Fig 1 Intraoral examination
实验室检查:血常规、血糖、肝肾功、凝血及血沉均未见明显异常。
组织病理检查:右侧舌腹病损活检示血管畸形,伴表面上皮瘤样增生及轻度异常增生(图2)。
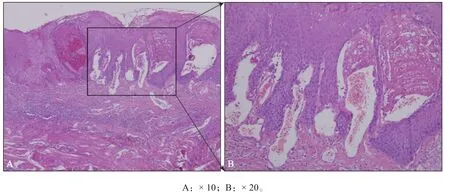
图2 舌黏膜组织病理学检查 苏木精-伊红染色Fig 2 Histopathological examination of tongue mucosa hematoxylin-eosin staining
辅助检查:窄带成像检查示舌背、双侧舌腹、硬腭、软腭黏膜下血管增生(图3)。

图3 口腔黏膜病损窄带成像检查Fig 3 Narrow-band imaging examination of oral mucosal lesions
诊断:RIOM(非典型性血管增生)。
处置:在抗炎、抗感染、缓解症状的治疗原则下,采用局部药物治疗与全身治疗相结合的方案。局部采用复方硼砂含漱液含漱、氟康唑含化的方法治疗细菌及真菌感染;口服沙利度胺利用其抗炎、免疫调节、抑制血管生成及抗肿瘤作用进一步控制炎症减轻症状。1月后患者复诊自诉口内疼痛明显缓解,临床查体发现患者口腔黏膜充血程度较初诊时减轻,黏膜下仍见广泛血管增生,口内湿润度差。
2 讨论
综上结合病史与临床表现,将该病例诊断为以非典型性血管增生为主要表现的RIOM。虽然患者同时伴有10 余年干燥综合征病史,但在既往干燥综合征病例报道中,未见继发皮肤或黏膜上非典型性血管增生的改变。干燥综合征作为一种自身免疫性疾病,具有系统性血管损伤的特征,往往在病损早期即出现了内皮细胞的功能障碍,也是继发心血管系统病变及中枢神经血管炎的基础所在[1]。针对干燥综合征损伤血管病理机制主要包含以下几方面:其一为由于内皮细胞长期暴露于氧化应激状态中,使得血管抗氧化保护机制耗尽,出现了内皮细胞受损伴功能障碍,从而导致内皮细胞凋亡[2];其二为干燥综合征患者存在的血脂异常可进一步加速动脉血管的硬化[3],在干燥综合征继发的脑血管炎性病变中,主要是由于单核细胞炎症所致血管壁纤维素坏死及血管壁纤维化所致[4],干燥综合征所造成的皮肤黏膜上血管炎性病损主要表现为紫癜、荨麻疹损害等[5],可能与血清中高丙种球蛋白血症有关,大量自身抗体沉积与血管壁淋巴细胞浸润相关[6]。针对本病例,患者的病变出现于接受放射治疗后,故10 余年干燥综合征病史的存在并非为导致患者出现非典型性血管增生的直接病因,而是作为辅助因素,在患者接受放射治疗后进一步加重了血管内皮细胞所受损伤,促进了血管增生的出现。
RIOM 是因放射线电离辐射引起的口腔黏膜损伤,口腔黏膜出现充血、糜烂或溃疡。RIOM 是放射剂量累积的结果,一般在累积放射剂量达到15 Gy 时开始出现,放射剂量达到60 Gy 时症状严重。RIOM 好发于口腔的非角化黏膜,如颊黏膜、软腭、舌腹和口底,临床上主要见于头颈部恶性肿瘤使用放射线治疗的患者,发病率为80%~100%[7-8]。 RIOM 可 分 为 5 级 : 0 级 , 无 红 肿 、 疼痛,无吞咽困难;1级,红肿、疼痛,轻度吞咽困难,能进食固体食物;2 级,黏膜炎呈点状分布,中度疼痛,能进半流食;3 级,黏膜炎呈片状分布,病损区域小于等于照射区面积的50%,重度疼痛,仅能进流食;4级,黏膜炎呈片状分布,总面积超过照射区面积的50%,伴出血坏死,需要停止放疗并进行营养支持[9]。根据病程,RIOM 又可分为急性及慢性RIOM,急性RIOM 在放疗后6个月内出现,是由于口腔黏膜基底细胞受辐射损伤与口腔环境改变所致,主要表现为口腔黏膜充血水肿、糜烂伴溃疡,覆盖白色假膜,一般放疗结束后2~4周或采取抗感染、促愈合及止痛等有效治疗措施后1~2 周逐渐愈合。慢性RIOM 由急性RIOM 迁延而来或在放射治疗6个月后出现,以广泛的口腔黏膜萎缩充血为主,且常由于唾液腺广泛受损并继发真菌感染[10]。临床研究[11]发现,RI‐OM 病程后期,有超过50%的患者发展为重型RI‐OM(3级或4级)。
研究认为RIOM的发病机制包括直接机制与间接机制,直接机制是指射线非特异性靶向上皮基底层快速增殖的细胞,导致上皮丧失自我更新能力,黏膜上皮萎缩变薄,临床表现为黏膜糜烂或溃疡;间接损伤机制是指电离辐射通过引起唾液腺的放射性损伤进而导致黏膜损伤的机制[12]。有研究[13]表明,腮腺组织所暴露的射线量达到20~30 Gy 时即可引起唾液分泌量减少或流速减慢。唾液黏度增加,唾液中免疫球蛋白(immunoglobu‐lin,Ig)G、IgA、IgM 含量降低,口腔内呈酸性环境,口腔微生态平衡被破坏,变异链球菌、乳酸菌、念珠菌成为优势菌群,进而继发黏膜损害[10]。与此同时,放射剂量的增加损害了机体的免疫系统,T淋巴细胞及其亚群分布失调,多数患者外周血出现CD4+/CD8+细胞水平下调和自然杀伤细胞(natural killer cell,NK)细胞活性下降,提示机体免疫功能紊乱,进一步促进口腔黏膜炎症的发生和发展[12]。
本病例在接受放疗治疗后即开始出现口内黏膜反复糜烂疼痛,表现为急性RIOM。由于患者罹患干燥综合征,口腔内长期缺乏唾液的清洁、抗菌及保护作用,加速了放射治疗后RIOM 的发生,同时增加了病情控制的难度。随着时间的推移,病情转变为慢性RIOM。值得注意的是,本例RI‐OM 与既往报道病案的不同之处在于,患者的慢性RIOM 除了表现为广泛的黏膜萎缩充血外,还伴有明显广泛的黏膜下血管增生性改变,在窄带成像检查中表现为血管增生扩张呈盘曲状(图3D~F),此改变属于放疗后非典型性血管病变(atypical vascular lesion,AVL)。
根据既往研究报道,AVL 多见于乳腺癌保乳术及术后辅助放疗后,也有病例报道见于经放射治疗后的良性血管瘤[13],镜下表现为位于真皮层内的血管增生性病变,由成簇扩张的薄壁血管为特点[14-15]。在头颈部恶性肿瘤放射治疗后对血管造成的损害中研究最多的是鼻咽癌放射治疗后出现的颈动脉狭窄与斑块形成。目前为止,AVL 在口腔中未见报道。本文首次报道了颌面部放射治疗后口腔黏膜出现的以血管增生性改变为主要变化特点的AVL。
关于在放射治疗后出现血管增生的机制,目前研究认为主要包括3个方面(图4)。首先,辐射可以通过多途径调节乏氧诱导因子-1α(hypox‐ia-inducible factor-1α,HIF-1α)通路,如激活表皮生长因子受体(epidermal growth factor receptor,EGFR)、环氧合酶-2 (cyclooxygenase-2,COX-2)[16]、转化生长因子β(transforming growth fac‐tor-β,TGF-β)、一氧化氮合成酶(nitric oxide syn‐thase,NOS)[17]、胰岛素样生长因子-1(insulinlike growth factor 1,IGF-1)[18]等,促进 HIF-1α 的生成,进一步促进血管内皮生长因子(vascular en‐dothelial growth factor,VEGF)生成,或直接靶向VEGF[19],刺激血管生成。此外,辐射还可对血管系统本身造成影响。在辐射诱导血管损伤的早期,辐射导致血管内皮细胞损伤,此后,细胞应激状态释放的大量活性氧与自由基加重了细胞损伤,通过影响血管内皮因子、炎症因子及生长因子等影响细胞增殖及调节炎症,进而出现功能障碍。广泛的内皮损伤作为血小板聚集及纤维素沉积的启动因素,导致血管萎缩闭塞[20-22]。同时,辐射导致的血管内皮细胞损伤对于处于增殖期的血管尤其明显,该因素进一步加重了原本因肿瘤细胞增殖所致的微环境缺氧,继而促进了血管的生成。另外,辐射还可对淋巴组织造成影响,促进血管淋巴样增生。研究发现经射线照射后残余的肿瘤细胞具有更高的细胞增殖指数Ki-67、促血管生成基因明显上调、微血管密度增高[23-24],说明经辐射后残余肿瘤细胞具有更丰富的血管生成。
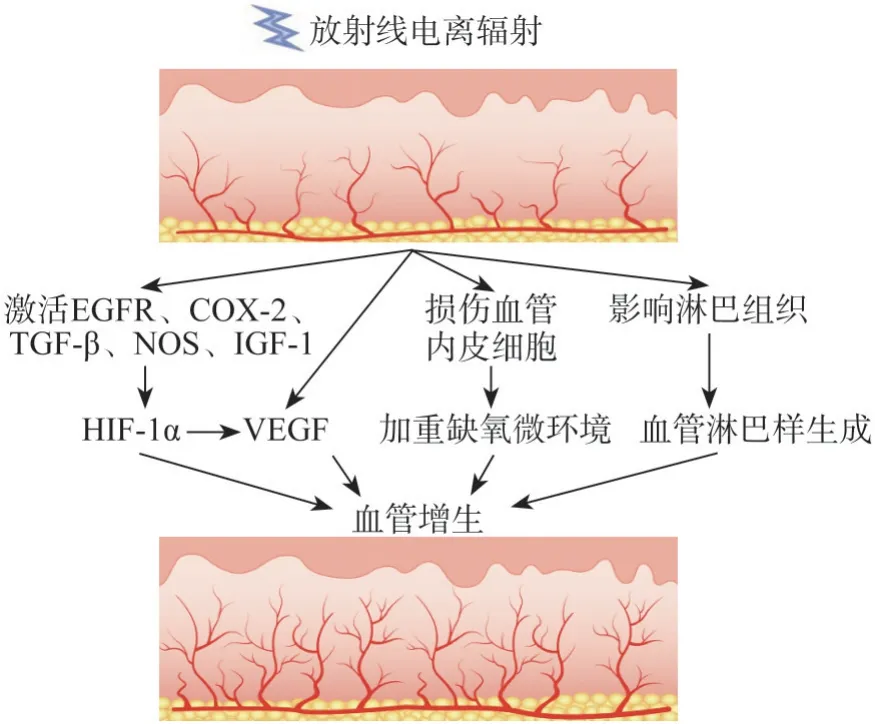
图4 电离辐射导致血管增生的可能机制Fig 4 Possible mechanisms of radiation induced vascular proliferation
针对RIOM的治疗的主要目标在于缓解患者黏膜疼痛,减轻黏膜炎症,促进病损愈合。目前常用于RIOM的治疗药物根据作用机制可以分为以下几类:1)有助于清除活性氧的抗氧化剂,如氨磷汀、维生素E、谷氨酰胺、锌补充剂等;2)可抑制炎症及细胞因子产生的,如姜黄、可乐定口腔贴片、己酮可可碱、盐酸苄达明等;3)蜂蜜、芦荟胶及中药作为多靶点天然制剂,有一定抗炎及促进免疫的作用。除了药物治疗外,低水平的激光疗法及口腔冷冻疗法,也有助于促进损伤组织的再生并预防感染[25]。该病例的治疗,主要采用局部药物治疗与全身药物治疗相结合的方案。局部治疗以抗细菌真菌感染为目的,采用复方硼砂含漱液漱口、氟康唑局部含化;全身治疗选用沙利度胺。研究[26-28]表明,沙利度胺通过对核因子κB 通路以及肿瘤坏死因子-α 的作用,可有效降低放射治疗患者RIOM的发生率及严重程度,推迟其发生时间,减轻炎症反应。从本例患者的治疗效果看,可以认为沙利度胺在一定程度上起到了减轻RIOM患者口腔黏膜炎症并缓解症状的作用。
总之,RIOM 作为头颈部肿瘤放疗常见并发症,其预防和治疗对于患者全身治疗方案的顺利推行和预后均具有积极作用,遗憾的是目前缺乏有效的预防和治疗方案,通过此病案报道,希望给临床医师认识和诊断不同形式的RIOM 提供资料,同时为实现更好的RIOM 临床治疗效果提供参考。
利益冲突声明:作者声明本文无利益冲突。

