刺梨叶片愈伤组织诱导及抗褐化研究
李婷婷,陈 红
(贵州大学/国家林业和草原局刺梨工程技术研究中心,贵阳 550025)
0 引言
刺梨(Rosa roxburghiiTratt)是中国特有的果树资源,具有很高的营养保健价值。近年来,刺梨已作为贵州重要的特色果树产业被大力发展,但现有品种主要是通过野生驯化而来,且品种比较单一,远不能满足广大消费者的多元化需求,因此,开展资源创新及新品种培育势在必行。而植物细胞工程作为资源创新的有效手段,已在月季[1]、桑树[2]、柑橘[3]、火龙果[4]等很多园艺植物上被广泛应用并获得了变异植株。此外通过完善的离体再生体系已成功获得了转基因植株[5-6]。
目前在刺梨上通过植物细胞工程手段创建新材料的研究鲜见报道,其主要原因是刺梨离体再生体系建立极为困难。仅张绿萍等对刺梨花药[7]、未受精胚珠[8]愈伤组织诱导等进行了研究,并分化出少量的类原球茎,但最终未能萌发成植株。由于刺梨含有大量的酚类物质[9-11],容易导致叶片愈伤组织褐化死亡,也限制了刺梨叶片再生体系的建立。基于此,本研究以4种基因型刺梨叶片为试材,研究Vc浸泡处理、取样时间、植物生长调节剂及抗褐化剂对叶片愈伤组织诱导及抑制褐化的影响,以建立和优化刺梨叶片愈伤组织诱导体系,并降低褐化率,为后续刺梨叶片再生体系的建立以及资源创新奠定基础。
1 材料与方法
1.1 试验材料
以贵州大学农学院试验基地‘贵农1号’、‘贵农2号’、‘贵农5号’、‘贵农7号’刺梨新梢幼嫩叶片为材料,于2020年1月—2021年12月进行。
1.2 试验方法
1.2.1 Vc浸泡浓度及时间的筛选 将消毒处理后的叶片分别置于50、100 mg/L的Vc中浸泡8 h、12 h,以不经Vc浸泡为对照处理,具体配比见表1。观察愈伤组织发生时间,培养21天后统计愈伤组织诱导率以及褐化情况,筛选出最适宜愈伤组织诱导的Vc浸泡浓度和时间。
1.2.2 取样时间的筛选 分别在春、夏、秋、冬季采集新梢幼嫩叶片,培养21天后统计愈伤组织诱导率以及褐化情况,筛选出最适宜愈伤组织诱导的最佳采样时间。
1.2.3 植物生长调节剂浓度的筛选 将叶片接种在含有不同浓度的6-BA、NAA、TDZ培养基中,进行正交设计L9(34),具体浓度见表2,培养21天后观察并统计愈伤组织生长情况。

表2 植物生长调节剂浓度配比
1.2.4 不同抗褐化剂的筛选 选取不同浓度的柠檬酸、PVP、AgNO3附加到增殖培养基中,具体抗褐化剂种类及浓度配比见表3,将长势良好的愈伤组织分别接种于不同抗褐化剂培养基中,观察愈伤组织增殖及褐化情况。
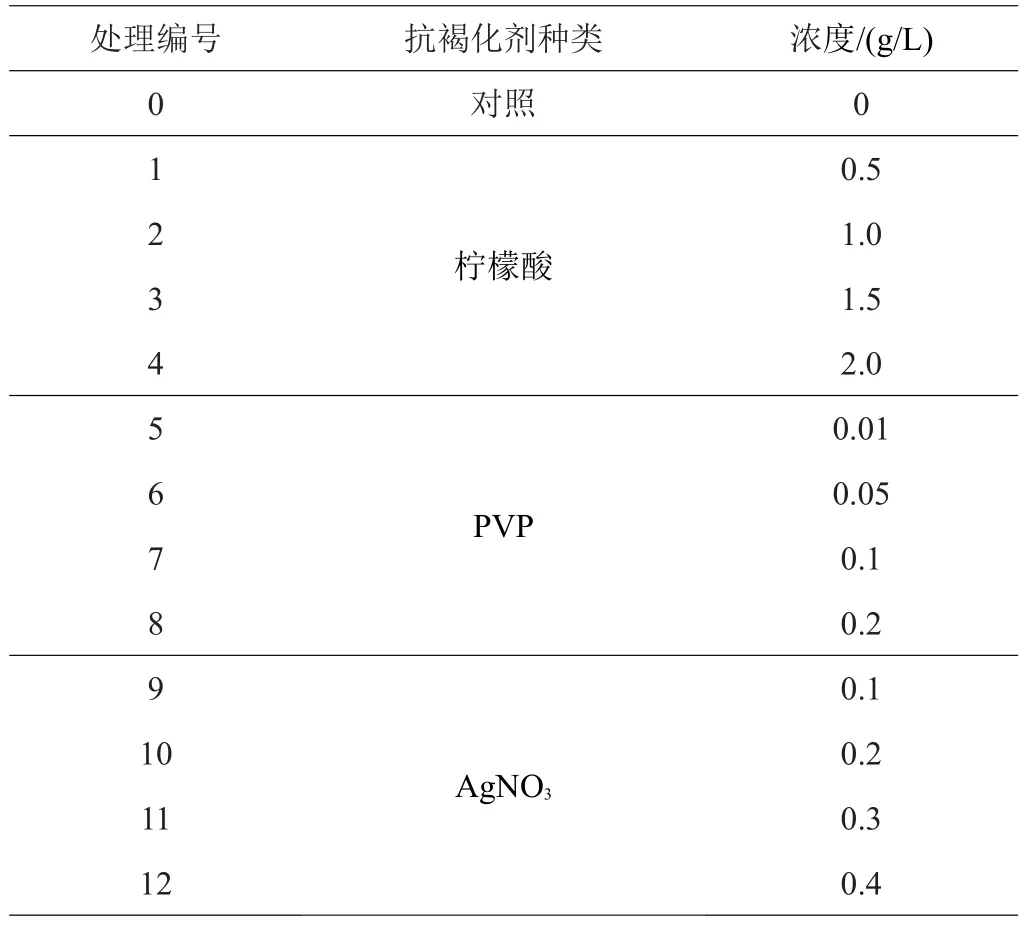
表3 不同抗褐化剂配比
1.3 培养条件
若无特别说明,培养基pH 5.8;叶片大小为0.5 cm×1 cm左右的长条;每个处理接种120个外植体,试验重复3次;光照强度为1500~2000 lx。光照时间为12 h/天,温度为25±0.5℃。
1.4 数据分析
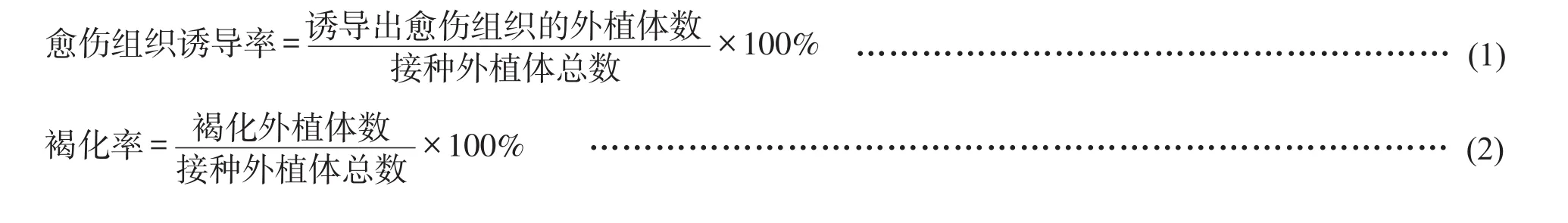
采用Excel 2010软件进行数据整理,用IBM SPSS STATISTIC 23.0软件进行数据分析,并计算愈伤组织诱导率见式(1)和褐化率见式(2)。将愈伤组织的褐化程度采用目视法分为5级,用“+”表示,“+”越多表示褐化程度越高。
2 结果分析
2.1 Vc浸泡预处理对叶片愈伤组织诱导及褐化的影响
由表4可得,不同基因型叶片愈伤组织诱导率均随着Vc浸泡浓度及时间的增加而升高,褐化率随着Vc浸泡浓度及时间的增加而降低,处理组合为M4时,‘贵农1号’、‘贵农2号’、‘贵农5号’、‘贵农7号’诱导率均达到最高值,并且褐化率最低,诱导率分别为97.44%、89.37%、92.16%、94.00%,褐化率分别为1.46%、2.41%、1.13%、3.53%,愈伤组织状态如图1所示,与对照M0相比,显著高于未经Vc浸泡的叶片愈伤组织诱导率,并对愈伤组织的褐化有显著抑制作用。综合诱导率和褐化率分析,M4是4个基因型叶片最适宜的浸泡预处理组合。

表4 Vc浸泡对叶片愈伤组织诱导及降低褐化率的影响

图1 Vc浸泡后不同基因型叶片愈伤组织生长情况
2.2 不同取样时间对叶片愈伤组织诱导及褐化的影响
不同取样时间对叶片愈伤组织诱导及褐化的影响如表5可见,虽然均采取新鲜幼嫩叶片,但随着时间的推迟,叶片愈伤组织诱导率逐渐下降,褐化率逐渐上升。在春季取材,各个基因型叶片诱导率均在90%以上,显著高于夏、秋、冬三个季节的诱导率,且褐化率显著低于夏、秋、冬三个季节的褐化率。3月,‘贵农1号’、‘贵农2号’、‘贵农5号’、‘贵农7号’诱导率均达到最高值,诱导率分别为95.8%、90.71%、91.99%、91.40%,与4、5月不存在显著差异。3月褐化率最低,‘贵农1号’、‘贵农2号’、‘贵农5号’、‘贵农7号’褐化率分别为2.24%、5.68%、3.33%、8.45%,而夏季取样,愈伤组织诱导率最低,褐化率也较高,诱导率在65.33%~75.47%之间。因此,综合诱导率和褐化率分析,4个基因型刺梨叶片最佳取样时间均为春季,3—5月。
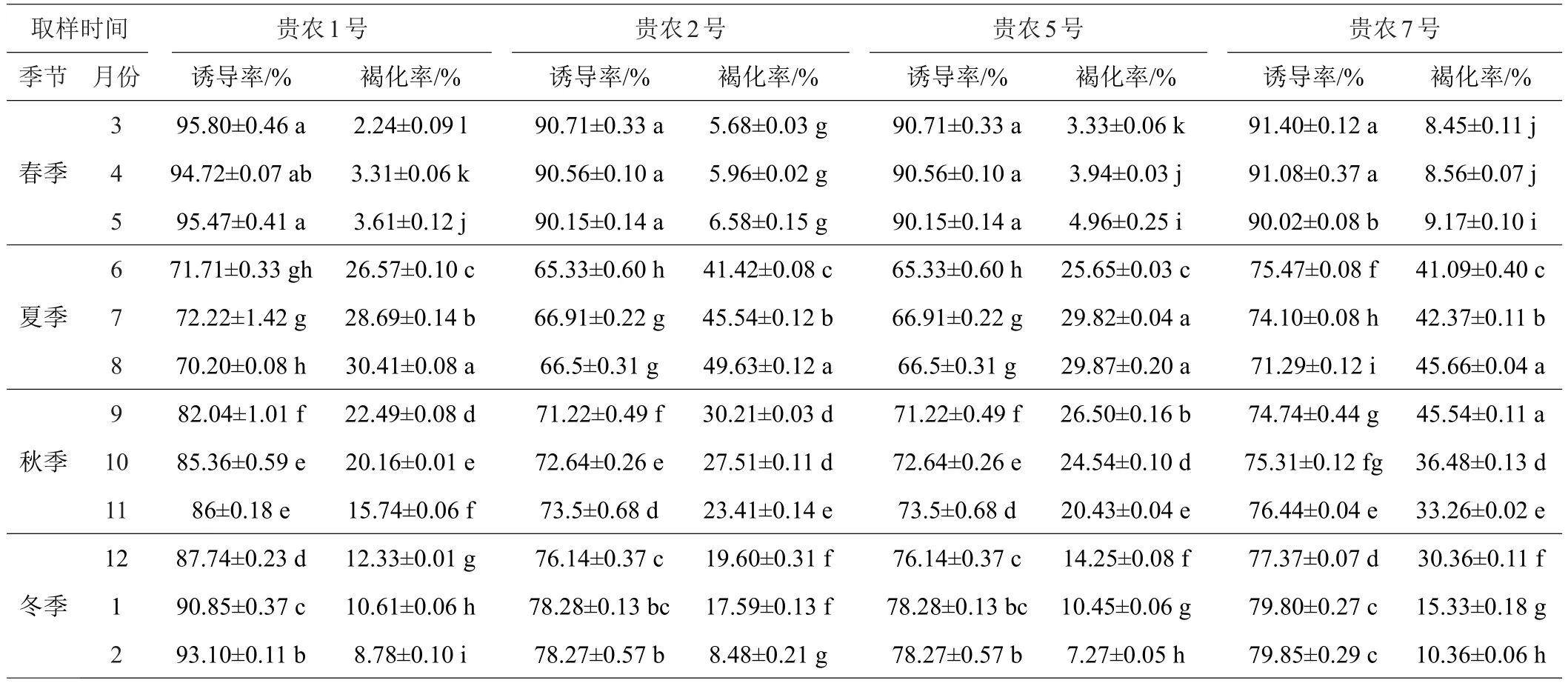
表5 不同取样时间对叶片愈伤组织诱导及褐化的影响
2.3 植物生长调节剂对叶片愈伤组织诱导的影响
不同生长调节剂组合对刺梨叶片愈伤组织的影响如表6可见,各处理均可诱导出愈伤组织,但愈伤组织生长状态略有差异。当处理组合为5时,‘贵农1号’和‘贵农2号’愈伤组织诱导率达到最大值,分别为90.22%和92.34%,均呈嫩绿色致密颗粒状,而‘贵农5号’和‘贵农7号’则在处理6诱导率最高,分别为96.46%和94.78%。经极差分析发现,6-BA、NAA、TDZ在‘贵农1号’和‘贵农2号’试验中发现对愈伤组织诱导的影响大小为6-BA>NAA>TDZ,在‘贵农5号’试验中发现对愈伤组织诱导的影响大小为6-BA>TDZ>NAA,在‘贵农7号’试验中发现对愈伤组织诱导的影响大小为NAA>6-BA>TDZ。以6-BA作为单个因子统计结果显示,随着6-BA浓度的增加诱导率先升高后下降,以NAA作为单个因子统计结果显示,随着NAA浓度的增加诱导率呈先升高后下降,而添加TDZ对‘贵农5号’和‘贵农7号’利于愈伤组织转绿,未添加TDZ的愈伤组织呈黄白色。综上所述,‘贵农1号’和‘贵农2号’最适宜的生长调节剂为1.0 mg/L6-BA+0.5 mg/LNAA,‘贵农5号’和‘贵农7号’最适宜的生长调节剂为1.0 mg/L6-BA+1.0 mg/LNAA+1.0 mg/LTDZ。
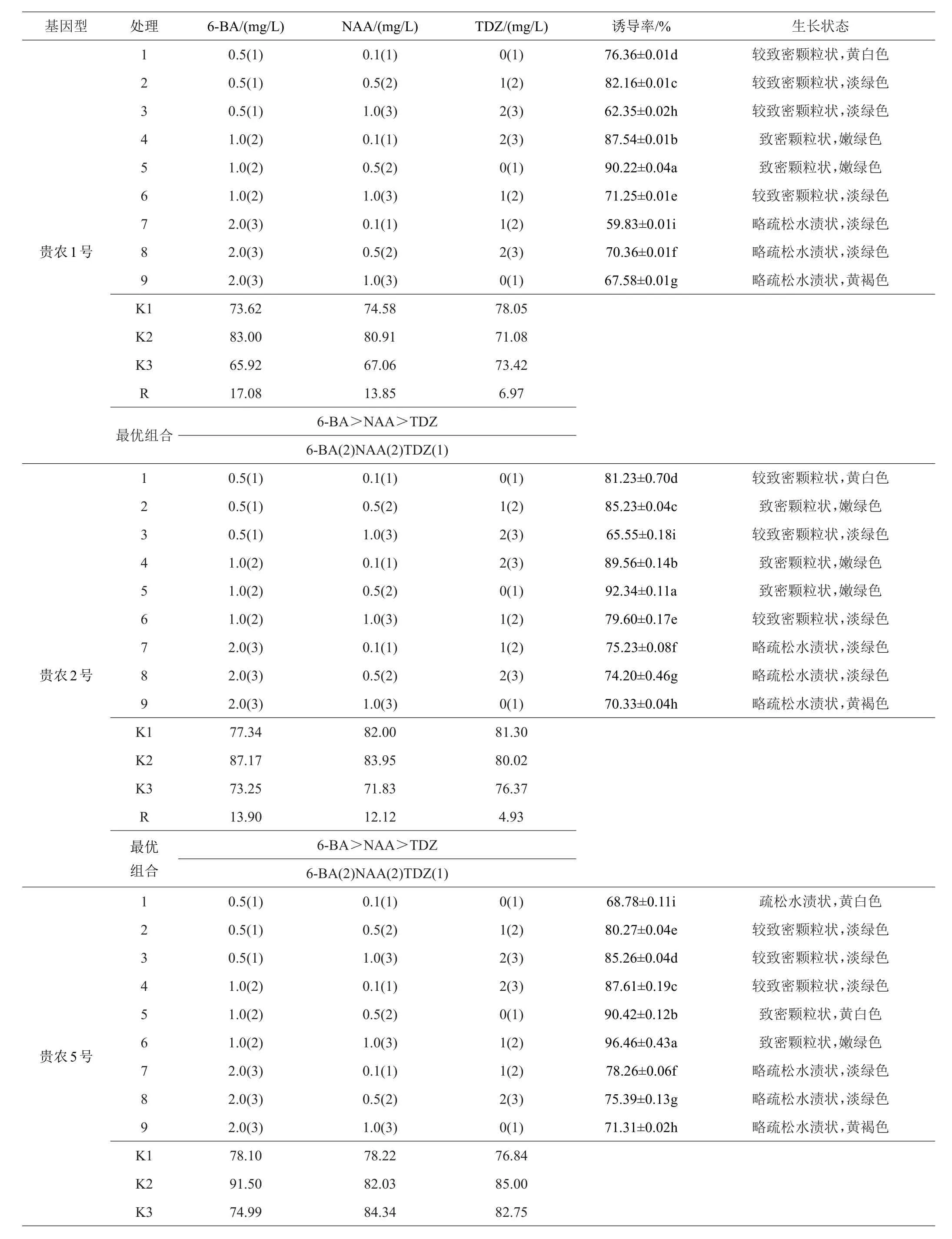
表6 植物生长调节剂对叶片愈伤组织诱导的影响

续表6
2.4 抗褐化剂对叶片愈伤组织增殖及褐化的影响
2.4.1 抗褐化剂对刺梨叶片增殖的影响 由表7可见,在不添加抗褐化剂的增殖培养基中,愈伤组织褐化情况较为严重,不同基因型刺梨叶片愈伤组织增殖系数较低,生长较为缓慢。添加了柠檬酸和AgNO3后,基本随着抗褐化剂浓度的增加褐化程度呈下降趋势,增殖倍数也有所提高,愈伤组织生长较快。‘贵农1号’刺梨,柠檬酸含量为1.0 g/L时,增长倍数最高,为3.01倍,褐化程度也较轻,与1.5 g/L不存在显著差异,AgNO3为0.4 g/L时,增长倍数为8.49倍,与其他处理存在显著差异;对于‘贵农2号’、‘贵农5号’、‘贵农7号’刺梨愈伤组织增殖培养来讲,柠檬酸最适浓度为1.0 g/L,同时褐化程度最低,增殖倍数分别为2.67、3.63、3.28倍,AgNO3最适浓度均为0.4 g/L,增殖倍数分别为8.67、9.37、9.89倍。添加PVP的愈伤组织褐化程度与对照相比,无明显降低,但增殖倍数却逐渐降低,综上所述,愈伤组织的褐化情况是抑制增长的重要因素。上述3种抗褐化剂对4种基因型刺梨叶片愈伤组织增殖培养的效果大小为AgNO3>柠檬酸>PVP。
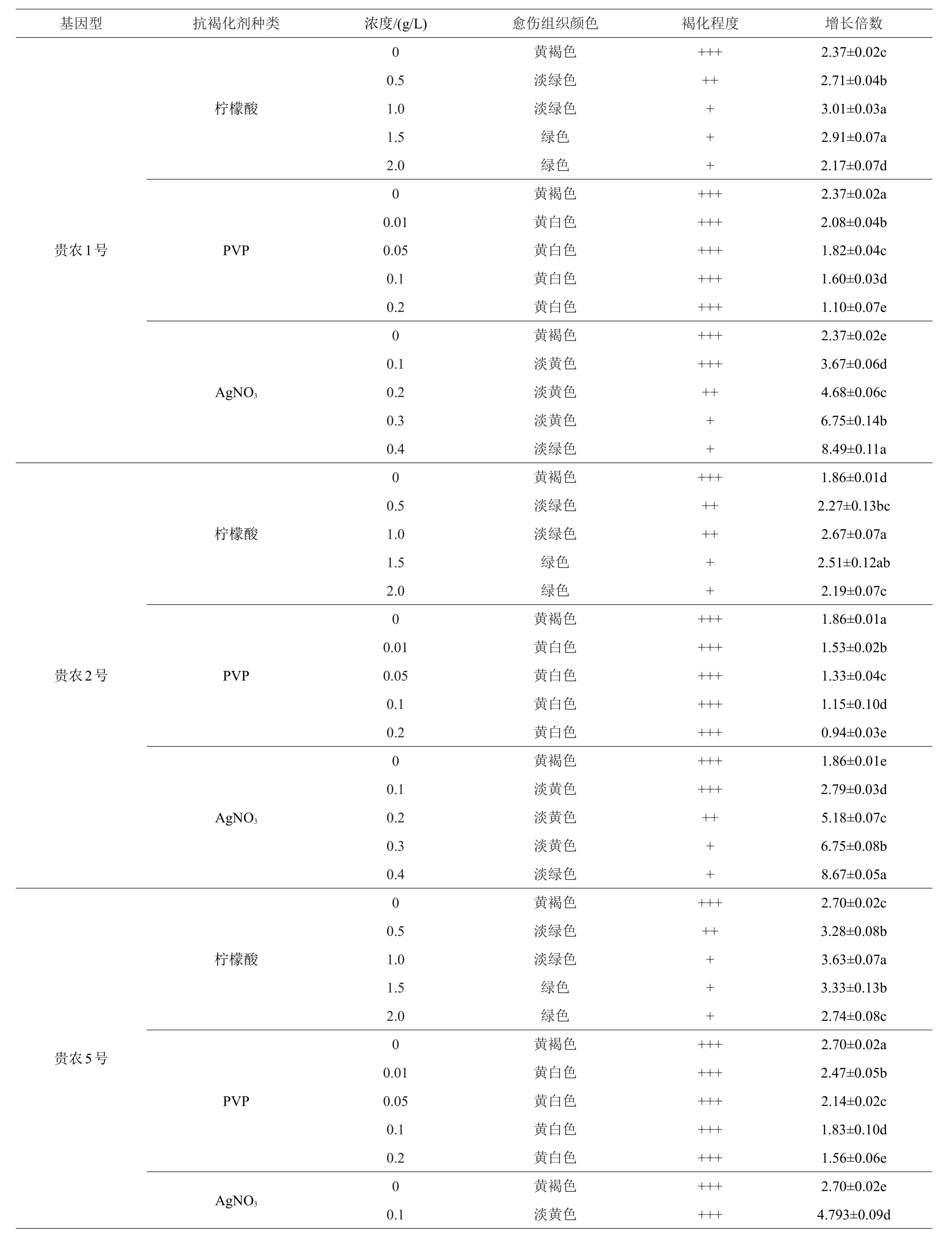
表7 不同抗褐化剂对刺梨叶片愈伤组织增殖及褐化的影响

续表7
2.4.2 3种抗褐化剂对4个基因型愈伤组织褐化率的影响 由表8、9可得,添加柠檬酸、AgNO3与对照相比均可显著降低4个基因型刺梨愈伤组织的褐化率,未添加柠檬酸、AgNO3时,‘贵农5号’的愈伤组织褐化率最低,与其他3个基因型愈伤组织存在显著差异。随着柠檬酸、AgNO3浓度的增加,4个基因型愈伤组织褐化率逐渐下降,在本试验浓度范围内,柠檬酸浓度为2.0 g/L、AgNO3浓度为0.4 g/L时,4个基因型愈伤组织褐化率均达到最低值,以‘贵农5号’愈伤组织褐化率最低,添加柠檬酸愈伤组织褐化率为2.38%,添加AgNO3愈伤组织褐化率为1.29%,显著低于其他3个基因型愈伤组织褐化率,‘贵农7号’愈伤组织褐化率最高,添加柠檬酸愈伤组织褐化率为11.13%,添加AgNO3愈伤组织褐化率为10.14%。综上所述,在这4个基因型中,无论是否添加抗褐化剂,均为‘贵农5号’的褐化率最低。添加抗褐化剂与未添加抗褐化剂愈伤组织对比图如图2所见。

表8 不同浓度柠檬酸对4个基因型刺梨叶片愈伤组织褐化率的影响
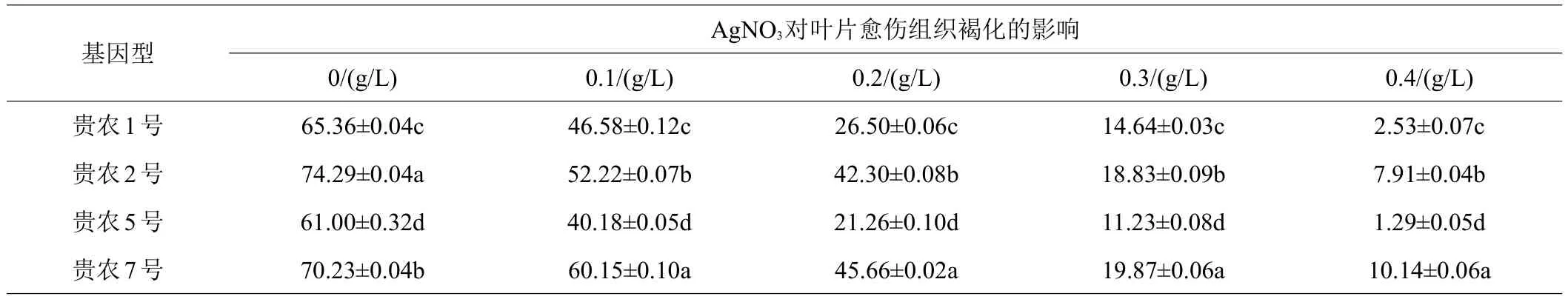
表9 不同浓度AgNO3对4个基因型刺梨叶片愈伤组织褐化率的影响

图2 添加抗褐化剂与未添加抗褐化剂愈伤组织对比图
由表10可得,添加PVP对4个基因型愈伤组织的褐化率并无明显抑制作用,甚至还存在褐化率升高的现象,由此可见,PVP对4个基因型刺梨愈伤组织的褐化率并无显著抑制作用。

表10 不同浓度PVP对4个基因型刺梨叶片愈伤组织褐化率的影响
3 结论
100 mg/LVc浸泡12 h后4种基因型刺梨叶片愈伤组织诱导率最高,褐化率最低;春季(3—5月)为不同基因型叶片最佳取材时间;‘贵农1号’和‘贵农2号’叶片愈伤组织诱导的植物生长调节剂组合为1.0 mg/L6-BA+0.5 mg/LNAA,‘贵农5号’和‘贵农7号’叶片愈伤组织诱导最适宜的植物生长调节剂组合为1.0 mg/L6-BA+1.0 mg/LNAA+1.0 mg/LTDZ;3种抗褐化剂对4种基因型刺梨叶片愈伤组织增殖培养的效果大小为AgNO3>柠檬酸>PVP;添加2.0 g/L柠檬酸或0.4 g/LAgNO34个基因型叶片愈伤组织褐化率最低,PVP对愈伤组织褐化率并无显著抑制,甚至褐化率还会上升。
4 讨论
不同基因型刺梨叶片对6-BA、NAA、TDZ敏感程度不同,对‘贵农1号’和‘贵农2号’叶片愈伤组织诱导的影响大小为6-BA>NAA>TDZ,而‘贵农5号’和‘贵农7号’添加TDZ有利于叶片愈伤组织转绿且生长状态良好,可用于增殖及分化培养,与前人研究一致[12-15],虽然TDZ化学结构与一般的生长素和细胞分裂素不同,但具有两者的生物活性[16-17],并对类原球茎分化成类原球茎束有重要作用[18],也利于月季叶片直接再生[19]。但使用在某些基因型植株上易引起玻璃化现象[20],在后续的试验中,可着重研究TDZ浓度、与其他生长调节剂互作对刺梨叶片愈伤组织的诱导及分化的影响。
刺梨酚类物质含量较高,极易出现褐化,其再生体系尚未建立,可能与褐化有关。本研究发现通过100 mg/LVc浸泡12 h、添加适当浓度的柠檬酸、AgNO3可有效降低褐化率,PVP对刺梨愈伤组织褐化并无明显抑制作用,与张绿萍等研究一致[21-23],但与陈梦倩[24]研究结果略有不同,可能与外植体、树种差异性不同等有关。4个基因型叶片最佳取材时间均为春季,诱导率在90%以上,而在3月份其诱导率均达到最大值,褐化率最低,可能是正处于春梢生长期,生长代谢较为旺盛且新生叶与外界接触时间较短,叶片体内的酚类物质汇聚较少,但与蒲艳等[25]、陈豆豆等[26]研究有所差异,可能与外植体不同、生物学特性不同等有关。虽然通过上述因素可以有效降低褐化率,但若想从根本上解决褐化现象,可能需要从遗传学、分子等多方面进行更深入的研究。
刺梨再生体系至今尚未建立,主要是因为分化非常困难。本研究主要是针对提高刺梨叶片愈伤组织诱导率和降低褐化率进行研究,其他因素对愈伤组织的诱导及抑制褐化是否有影响,如何影响应进一步研究,同时愈伤组织正常诱导的情况下,筛选出分化培养的关键影响因子,以早日建立刺梨叶片离体再生体系。

