ame-miR-79负调控意大利蜜蜂工蜂幼虫肠道中靶基因CYP450和FG的表达
张凯遥,刘佳美,张文德,胡 颖,康育欣,王紫馨,王思懿,钱加珺,赵 萧,张佳欣,陈大福,2,郭 睿,2,*,付中民,2,*
(1.福建农林大学动物科学学院(蜂学学院),福州 350002;2.福建农林大学蜂疗研究所,福州 350002)
意大利蜜蜂Apismelliferaligustica是西方蜜蜂Apismellifera的一个优良亚种,在我国和许多国家的养蜂生产中广泛使用,具有产卵多、采集力强和分泌蜂王浆能力强等特点(梁勤和陈大福,2009)。微小RNA(microRNA,miRNA)是一类长度介于18~24 nt的小非编码RNA(non-coding RNA,ncRNA),主要在转录后水平发挥基因表达调控作用。随着技术手段的持续进步及相关研究的不断深入,大量miRNA在真核生物、原核生物乃至病毒中被鉴定发现,并被证实在生长、发育和免疫等诸多生物学过程中起到重要作用(Ambros,2004;Luetal.,2005)。例如,miRNA可参与调控秀丽隐杆线虫Caenorhabditiselegans的发育时间(Leeetal.,1993),果蝇Drosophila的细胞死亡和脂肪代谢(Xuetal.,2003),哺乳动物的造血功能(Helwaketal.,2013)及植物的叶片发育和花的形态(Reinhartetal.,2002)。前人对蜜蜂miRNA进行了较多研究,结果表明miRNA可参与调节蜜蜂的记忆形成、劳动分工、级型分化、免疫防御及蜂王繁殖等过程(Shietal.,2015;Freitasetal.,2017;Liuetal.,2017;Chenetal.,2020)。
蜜蜂肠道是食物消化、营养吸收和免疫应答的关键部位(梁勤和陈大福,2009)。然而,西方蜜蜂肠道的miRNA(或发育)相关研究较少且主要集中在肠道微生物方面(Kwongetal.,2017;Doschetal.,2021),而关于miRNA调控蜜蜂肠道发育的研究匮乏。此前,熊翠玲等(2018)对意大利蜜蜂工蜂幼虫肠道miRNA进行了转录组测序和分析,共鉴定到560个新miRNA和45个保守miRNA;并通过解析miRNA差异表达谱揭示了差异表达miRNA在意大利蜜蜂工蜂幼虫肠道发育中的潜在调控作用(郭睿等,2018)。miR-79能够抑制家蚕Bombyxmori不同发育时期BmEm4的表达(Xuetal.,2019)。miR-79还可参与对刺参Apostichopusjaponicus代谢速率的抑制(Chen and Storey,2014)。Pedersen等(2013)研究发现miR-79缺失可导致秀丽隐杆线虫表皮中SQV-5和SQV-7的失调进而引起神经发育缺陷。在蜜蜂中,miR-79的相关研究至今仍然缺失,miR-79是否参与调控蜜蜂幼虫的肠道发育尚不清楚。
前期研究中,笔者所在团队对意大利蜜蜂工蜂4-6日龄幼虫肠道组织进行转录组测序,通过生物信息学方法预测到包括ame-miR-79在内的560个miRNA(熊翠玲等,2018)。在此基础上,本研究利用分子生物学手段对预测到的ame-miR-79进行序列验证,然后进行靶向预测和相关分析,进一步通过饲喂相应的模拟物(mimic)和抑制物(inhibitor)分别对意大利蜜蜂工蜂幼虫肠道内的ame-miR-79进行过表达和敲减,并检测过表达和敲减后ame-miR-79及靶基因的表达水平,以期揭示ame-miR-79调控靶基因表达进而调节幼虫肠道发育的潜在作用,为阐明背后的分子机制打下基础。
1 材料与方法
1.1 供试生物材料
本研究中所使用的意大利蜜蜂工蜂幼虫取自福建农林大学动物科学学院(蜂学学院)教学蜂群。
1.2 ame-miR-79的Stem-loop RT-PCR和Sanger测序验证
根据前期预测到的ame-miR-79序列(UAAAGC UAGAUUACCAAAGCA)(熊翠玲等,2018)设计特异性的Stem-loop引物和正向引物及通用的反向引物(表1),委托上海生工生物工程公司进行合成。利用RNA抽提试剂盒(Promega,美国)提取意大利蜜蜂工蜂6日龄幼虫肠道样品的总RNA,利用Stem-loop引物进行反转录,得到的cDNA作为模板进行PCR扩增。PCR产物经1.5%的琼脂糖凝胶电泳检测,切胶回收目的片段,连接pMD-19T载体(TaKaRa,日本),转化大肠杆菌EscherichiacoliDH5α感受态细胞(天根,中国),克隆产物涂于LB固体培养基(含氨苄抗生素),置于37℃生化箱培养过夜。挑取单菌落置于LB液体培养基(含氨苄抗生素)中振荡培养12 h,取少量菌液进行PCR鉴定,结果为阳性的菌液送至上海生工生物工程股份有限公司进行Sanger测序。

表1 引物信息Table 1 Primer information
1.3 意大利蜜蜂工蜂幼虫饲喂与肠道样品制备
将意大利蜜蜂蜂群的子脾提至实验室,使用移虫针将巢房内的意大利蜜蜂工蜂2日龄幼虫快速移至48孔培养板。按照笔者所在团队已建立的方法(郭睿等,2018,2019b)进行意大利蜜蜂工蜂幼虫的人工饲养。根据ame-miRNA-79的核苷酸序列,委托北京擎科生物科技有限公司合成mimic-ame-miR-79(UAAAGCUAGAUUACCAAAGCA,CUUUGG UAAUCUAGCUUUAUU),inhibitor-ame-miR-79(UG CUUUGGUAAUCUAGCUUUA),及对应的阴性对照无义模拟物(nonsense mimic,mimic-NC)(UUCUCC GAACGUGUCACGUTT,ACGUGACACGUUCGGAGA ATT)和无义抑制物(nonsense inhibitor,inhibitor-NC)(CAGUACUUUUGUGUAGUACAA),分别配制含上述模拟物或抑制物的50 μL饲料(终浓度均为20 pmol/g),加入培养板孔内以饲喂3日龄幼虫,每24 h更换一次饲料(体积为50 μL,含有模拟物或抑制物,终浓度为20 pmol/g),连续饲喂3次,饲养幼虫至6日龄。在超净台中分别剖取4,5和6日龄幼虫肠道,小心去除粘附的脂肪体,每3只肠道放入1个无菌的RNA-Free EP管,液氮速冻迅速转移到-80℃超低温冰箱保存备用。本实验进行3次生物学重复。
1.4 RT-qPCR检测ame-miR-79的过表达和敲减效果
利用RNA抽提试剂盒(Promega,美国)分别提取1.3节4,5和6日龄幼虫肠道样品的总RNA,通过反转录试剂盒(艾科瑞,中国)和Stem-loop引物对ame-miR-79进行反转录,得到相应的cDNA作为ame-miR-79的qPCR检测模板。利用Oligo dT引物和Random 6 mers Primer引物反转录得到ame-miR-79的内参基因U6(GenBank登录号:LOC725641)的cDNA模板。
参照SYBR Green试剂的说明书进行qPCR反应。反应在ABI QuantStudio 3荧光定量PCR系统(ABI公司,美国)上进行。反应体系和反应条件按照笔者所在团队前期报道(郭睿等,2018,2019a)设置。
1.5 ame-miR-79的靶向预测与分析
分别采用RNAhybrid+svm_light,miRanda和TargetScan 3种软件对ame-miR-79的靶mRNA进行预测,取预测结果的交集作为可靠的靶mRNA集合,进一步得到相应的靶基因集合。利用Blast工具将上述靶基因比对到GO(https:∥www.omicshare.com/tools/Home/Soft/gogsea)和KEGG(https:∥www.omicshare.com/tools/Home/Soft/pathwaygsea)数据库以获得相应注释。
1.6 靶基因表达量的RT-qPCR检测
根据1.5节靶向预测结果选择细胞色素P450(cytochrome P450,CYP450)基因和fringe糖基化转移酶 (fringe glycosyltransferase,FG)基因进行表达量检测。以1.4节得到的cDNA为模板,利用CYP450和FG的特异性引物进行qPCR检测;以actin(GenBank登录号:AB023025.1)作为内参基因。PCR反应体系和程序参照笔者所在团队的前期报道(耿四海等,2020;祝智威等,2022)设置。每个反应均进行3次技术重复和3次平行重复。
1.7 数据分析
采用2-ΔΔCt法计算ame-miR-79及靶基因CYP450和FG的相对表达量。通过GraphPad prism 8软件进行数据分析和绘图。采用Student氏t检验进行数据显著性分析。
2 结果
2.1 ame-miR-79的表达和序列验证
Stem-loop RT-PCR产物的Sanger测序结果(图1)显示,扩增片段的序列与前期生物信息学预测到的ame-miR-79序列(UAAAGCUAGAUUACCAAAG CA)完全一致,表明ame-miR-79在意大利蜜蜂工蜂幼虫肠道内真实存在。

图1 意大利蜜蜂工蜂幼虫肠道内ame-miR-79扩增片段的Sanger测序Fig.1 Sanger sequencing of the amplified ame-miR-79 fragment in the larval gut of Apis mellifera ligustica workers
2.2 ame-miR-79的过表达和敲减效果
RT-qPCR结果显示,相比于mimic-NC组,mimic-ame-miR-79组的4-6日龄幼虫肠道内ame-miR-79的表达水平皆极显著上调(P<0.01)(图2:A-C);相比于inhibitor-NC组,inhibitor-ame-miR-79组的4和5日龄幼虫肠道内ame-miR-79的表达水平显著下调(P<0.05),而6日龄幼虫肠道内ame-miR-79的表达水平极显著下调(P<0.001)(图2:D-F)。
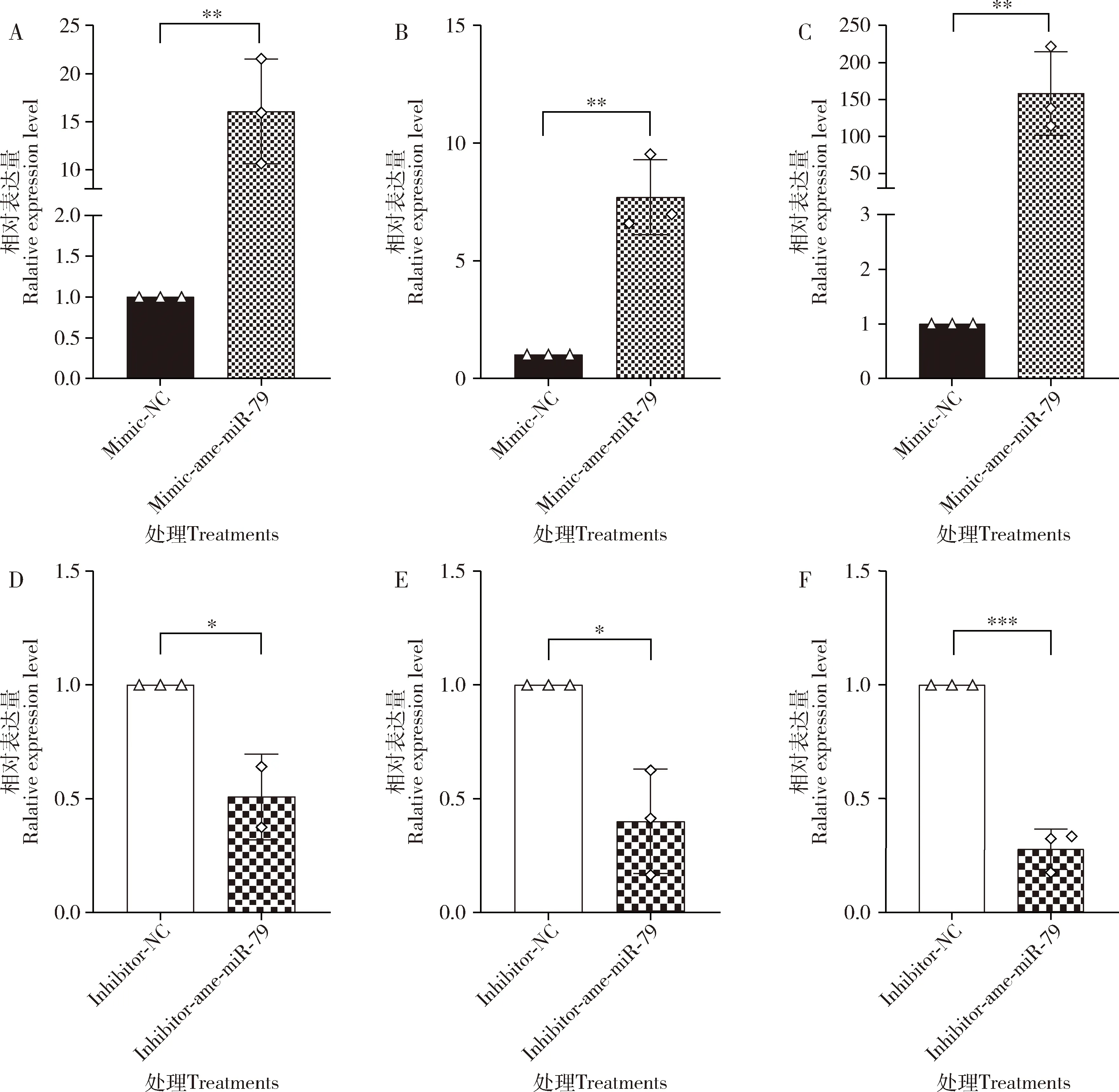
图2 过表达和敲减ame-miR-79后其在意大利蜜蜂工蜂4日龄(A,D),5日龄(B,E)和6日龄(C,F)幼虫肠道内的相对表达量Fig.2 Relative expression levels of ame-miR-79 in the 4-day-old (A,D),5-day-old (B,E) and 6-day-old (C,F) larval guts of Apis mellifera ligustica workers after its overexpression and knockdown无义模拟物(mimic-NC)和无义抑制物(mimic-inhibitor)分别作为mimic-miR-79和inhibitor-miR-79的阴性对照。图中数据为平均值±标准误;柱上星号表示两组间差异显著(*P<0.05,**P<0.01,***P<0.001,****P<0.0001)(Student氏t检验)。图4和5同。Nonsense mimic (mimic-NC) and nonsense inhibitor (inhibitor-NC) were used as the negative controls of mimic-miR-79 and inhibitor-miR-79,respectively.Data in the figure are mean±SE.Asterisks above bars indicate significant difference between two groups (*P<0.05,**P<0.01,***P<0.001,****P<0.0001)(Student’s t-test).The same for Figs.4 and 5.
2.3 ame-miR-79的靶基因预测与数据库注释
靶向预测结果显示,ame-miR-79共靶向791条mRNA,对应303个基因。GO注释结果显示上述靶基因涉及分子功能、细胞组分和生物学进程3个大类,可注释到催化活性、大分子复合物和细胞进程等27个GO条目(图3:A);KEGG注释结果显示上述靶基因还可注释到氧化磷酸化、胰岛素信号通路及昆虫激素的生物合成等179条KEGG通路(图3:B)。
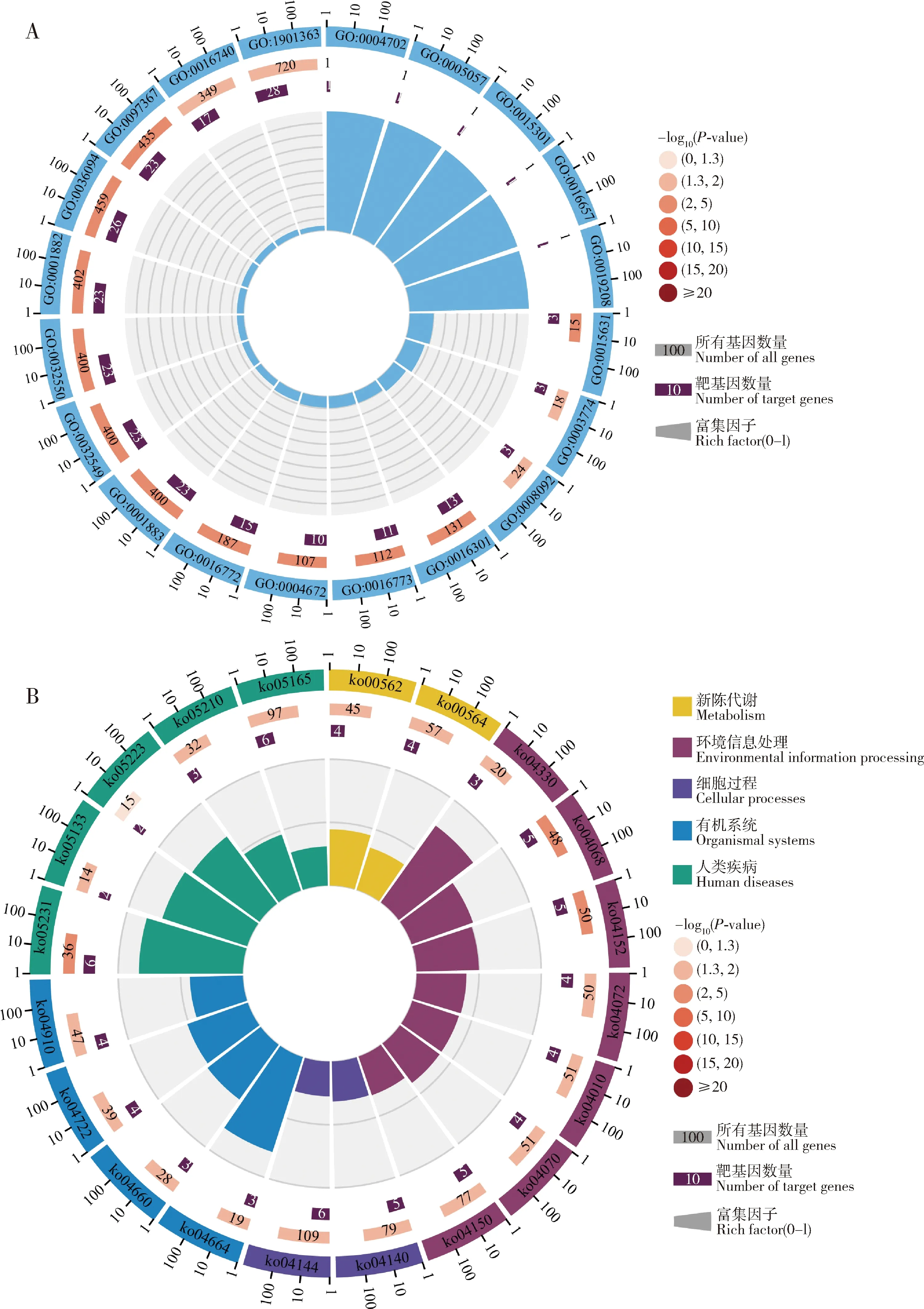
图3 意大利蜜蜂ame-miR-79的靶基因的GO(A)和KEGG(B)注释Fig.3 GO (A) and KEGG (B) annotation of target genes of ame-miR-79 of Apis mellifera ligustica
2.4 过表达和敲减ame-miR-79后其靶基因P450和FG的相对表达量
RT-qPCR检测结果显示,相较于mimic-NC组,CYP450在mimic-ame-miR-79组的4(P<0.0001)和5(P<0.01)日龄幼虫肠道内的表达水平均极显著下调,而在6日龄幼虫肠道内上调表达(P>0.05)(图4:A-C);相较于inhibitor-NC组,CYP450在inhibitor-ame-miR-79组的4日龄幼虫肠道内的表达水平极显著上调(P<0.01),在6日龄幼虫肠道内上调表达(P>0.05),而在5日龄幼虫肠道内下调表达(P>0.05)(图4:D-F)。
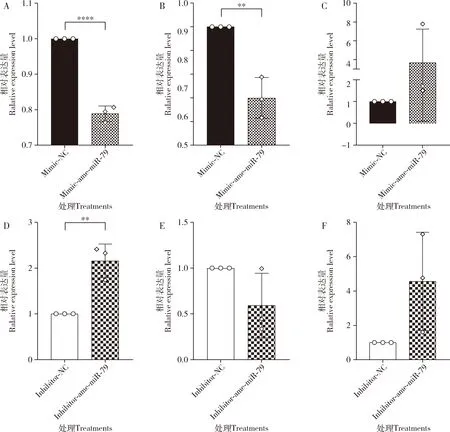
图4 过表达和敲减ame-miR-79后CYP450在意大利蜜蜂工蜂4日龄(A,D),5日龄(B,E)和6日龄(C,F)幼虫肠道内的相对表达量Fig.4 Relative expression levels of CYP450 in the 4-day-old (A,D),5-day-old (B,E) and 6-day-old (C,F) larval guts of Apis mellifera ligustica workers after overexpression and knockdown of ame-miR-79
相较于mimic-NC组,mimic-ame-miR-79组中5日龄幼虫肠道内FG的表达水平显著下调(P<0.05),4日龄幼虫肠道内FG下调表达(P>0.05),而在6日龄幼虫肠道内FG上调表达(P>0.05)(图5:A-C);相较于inhibitor-NC组,inhibitor-ame-miR-79组中4日龄幼虫肠道内FG的表达水平显著上调(P<0.05),5(P<0.01)和6(P<0.001)日龄幼虫肠道内FG的表达水平均极显著上调(图5:D-F)。

图5 过表达和敲减ame-miR-79后FG在意大利蜜蜂工蜂4日龄(A,D),5日龄(B,E)和6日龄(C,F)幼虫肠道内的相对表达量Fig.5 Relative expression levels of FG in the 4-day-old (A,D),5-day-old (B,E) and 6-day-old (C,F) larval guts of Apis mellifera ligustica workers after overexpression and knockdown of ame-miR-79
3 讨论
本研究中,我们从自然蜂群中移取意大利蜜蜂工蜂2日龄幼虫,从3日龄到6日龄连续饲喂模拟物(或抑制物),并检测4-6日龄幼虫肠道内ame-miR-79的过表达和敲减效果、2个靶基因的相对表达量,主要是出于3方面的考虑,一是意大利蜜蜂工蜂的幼虫期为1-6日龄,1日龄幼虫很小,人工移取易导致幼虫受伤死亡且剖取肠道的难度很大,前期预实验结果显示人工移取2日龄意大利蜜蜂工蜂幼虫放入恒温恒湿箱饲养,至6日龄仍可保持较高的成活率;二是我们前期利用sRNA-seq对意大利意蜂工蜂4-6日龄幼虫肠道进行了测序和分析(郭睿等,2019b),本研究中的ame-miR-79是前期研究基础上筛选出来的;三是模拟物和抑制物在幼虫肠道内发挥作用需要一定时间,而3日龄幼虫刚刚饲喂模拟物(或抑制物),可能仅发挥微弱的过表达(或敲减)效果。
前期研究中,笔者所在团队研究证实通过饲喂模拟物和抑制物能有效实现对意大利蜜蜂工蜂幼虫肠道内ame-miR-13b的过表达和敲减(祝智威等,2022)。本研究发现,饲喂mimic-ame-miR-79后,意大利蜜蜂工蜂4-6日龄幼虫肠道内ame-miR-79的表达水平皆显著上调,而饲喂inhibitor-ame-miR-79后4-6日龄幼虫肠道内ame-miR-79的表达水平均显著下调 (图2),说明幼虫肠道内的ame-miR-79被有效地过表达和敲减。以上结果共同表明通过饲喂模拟物和抑制物对意大利蜜蜂工蜂幼虫肠道内的miRNA进行过表达和敲减是一种可行且高效的方法。
靶向预测结果显示,ame-miR-79共靶向303个基因,涉及催化活性、大分子复合物和细胞进程等27条GO功能条目,以及氧化磷酸化、胰岛素信号通路及昆虫激素生物合成等179条KEGG通路(图3),说明ame-miR-79潜在参与调节意大利蜜蜂工蜂幼虫肠道生长和发育的诸多方面。细胞色素P450是一类重要的氧化代谢酶,参与昆虫的内源物质代谢及外源物质的解毒(Ohkawaetal.,1998)。研究表明细胞色素P450可通过参与蜕皮类固醇和保幼激素等的生物合成在昆虫的发育和繁殖中起到重要作用(Whiteetal.,1980;Huberetal.,2007),也能够参与西方蜜蜂体内杀虫剂的代谢过程(Zhangetal.,2019)。本研究中,生物信息学预测结果显示ame-miR-79与CYP450之间存在潜在的负调控关系。RT-qPCR检测结果显示过表达ame-miR-79后,意大利蜜蜂工蜂4和5日龄幼虫肠道内CYP450的表达量均为极显著下调;而敲减ame-miR-79后CYP450在4日龄幼虫肠道内的表达水平为极显著上调,在6日龄幼虫肠道内上调表达(图4)。上述结果表明在意大利蜜蜂工蜂幼虫肠道内ame-miR-79负调控CYP450的表达。需要强调的是,过表达ame-miR-79后CYP450在6日龄幼虫肠道内上调表达,敲减ame-miR-79后CYP450在5日龄幼虫肠道内下调表达,体现出ame-miR-79与CYP450之间的正调控关系。推测不同日龄幼虫肠道内靶基因CYP450表达趋势的不一致与幼虫个体差异性有关,或者CYP450在个别日龄幼虫肠道内的表达还受到其他因素(如长链非编码RNA和环状RNA的竞争性结合)的共同调节。
FG编码fringe糖基转移酶,在Notch信号通路中属于“修饰分子”,其对Notch信号通路的糖基化修饰能改变Notch受体对不同配体的敏感性(杨曦等,2021)。Notch信号通路广泛存在于脊椎动物和无脊椎动物,在进化上高度保守,通过细胞间的相互作用参与调节细胞增殖与分化及组织和器官发育(Previsetal.,2015)。FG在高尔基体中起到糖基转移酶的作用,它可以修饰Notch的表皮生长因子模块,并改变Notch与配体Delta结合的能力(Brückneretal.,2000)。此外,FG也被证实与果蝇和小鼠等的发育密切相关(Wu and Rao,1999;Jineketal.,2006)。但在蜜蜂中,FG基因的相关研究迄今仍然缺失。本研究中,过表达ame-miR-79后FG在4日龄幼虫肠道内下调表达,在5日龄幼虫肠道内的表达水平为显著下调;敲减ame-miR-79后,FG基因在4日龄幼虫肠道内的表达量为显著上调,5和6日龄幼虫肠道内的表达量均为极显著上调(图5)。以上结果表明在意大利蜜蜂工蜂幼虫肠道内ame-miR-79负调控FG的表达。推测ame-miR-79通过负调控FG表达潜在调节Notch信号通路进而影响幼虫肠道发育。
下一步的研究重点是通过体外转录得到CYP450和FG的dsRNA,再通过饲喂法对意大利蜜蜂工蜂幼虫肠道内的CYP450和FG进行沉默以探究其功能,进而结合本研究的结果进一步阐明ame-miR-79调控肠道发育的分子机理。综上,本研究证实意大利蜜蜂工蜂幼虫肠道内ame-miR-79真实存在,通过饲喂模拟物和抑制物能分别实现幼虫肠道内ame-miR-79的有效过表达和敲减,并揭示ame-miR-79负调控意大利蜜蜂工蜂幼虫肠道内CYP450和FG的表达。

