玉米自交系苗期对低温胁迫的响应机制研究
丁焓赟, 何序晨, 方 芳, 宋博文,2, 剧佳华,2, 刘家丰,胡 晋,2, 关亚静,2, 胡伟民,2
(1.浙江大学农业与生物技术学院, 杭州 310058;2.海南浙江大学研究院, 海南 三亚 572025)
玉米是我国三大粮食作物之一,面积和总产均居我国三大粮食作物之首,是人类和畜禽的重要食物来源,也是重要的工业和医药原料,与人民生活息息相关[1]。作为典型的喜温C4植物,玉米对冷害比较敏感,且适应能力差[2]。低温胁迫会影响玉米种子萌发,延迟出苗时间,降低田间出苗率,抑制幼苗正常的生长发育,极大地限制玉米栽培范围和产量潜力[3-4]。
低温胁迫对玉米生长和发育期间的生理生化代谢有明显影响。研究表明,低温胁迫会导致玉米生物膜系统的损伤,这种损伤与自由基和活性氧引起的膜脂过氧化有关。丙二醛(MDA)是膜脂过氧化的重要产物之一,在低温胁迫下,MDA的大量积累会使膜透性增加,从而破坏生物膜的完整性。因此,通过测定MDA含量可以大致了解膜脂过氧化程度,以间接推断膜系统的损伤程度和植物的抗冷性[5-7]。低温胁迫可导致植物细胞中活性氧(ROS)的产生和清除之间的平衡紊乱,可能导致蛋白质降解、膜损伤、酶失活等[8]。为应对ROS的大量积累所造成的损伤,植物在长期的进化过程中形成了一套比较完善的活性氧清除系统,其中由过氧化物酶(POD)、超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和抗坏血酸过氧化物酶(APX)等组成的抗氧化酶系统,在清除ROS过程中发挥了重要的保护作用[9]。渗透调节物质的积累是植物在受到环境胁迫时一种普遍的代谢适应现象。其中,可溶性糖可结合细胞内的一些大分子形成氢键来稳定细胞膜并帮助维持细胞内渗透压,进而提高植物对温度胁迫的耐受性[10]。脯氨酸(Pro)不仅具有渗透调节功能,还有助于稳定亚细胞结构,清除活性氧,以及在胁迫条件下缓冲细胞氧化还原电位,同时在缓解胁迫带来的压力时通过快速分解可以提供足够的还原剂,以支持线粒体氧化磷酸化并产生ATP修复胁迫引起的损伤[11]。在多种环境胁迫下,植物体内的Pro合成增加,降解减弱,从而积累Pro来提高植物的胁迫抗性[12]。
苗期是玉米生长发育的关键时期,也是对低温较为敏感的时期,此时遭遇低温,会导致田间出苗率和幼苗整齐度下降,降低农田经济效益,对农业生产十分不利。我国长江中下游地区玉米春播时间一般在3月中下旬,此时气候不稳定,苗期往往会受到连续几天的低温影响,并且这种现象所造成的危害,在甜玉米自交系上表现得尤为明显。本试验采用抗冷型和冷敏感型材料各2份,在室内培养箱3 ℃条件下进行苗期5 d低温胁迫处理,测定苗期叶片的生理生化变化和相关基因表达,研究和分析甜玉米自交系对低温胁迫的响应机制,为抗性品种的鉴定和选育提供参考。
1 材料与方法
1.1 材 料
在前期田间和室内双向鉴定的基础上,选用抗冷型和冷敏感型甜玉米自交系各2份,其中抗冷型为11号(S 29-1-1-2,种质来源:温带)和18号(S 40-4-3-1-2-3,种质来源:温带×热带);冷敏感型为56号(T 5-5-1-1-1-3-1,种质来源:温带×亚热带)和69号(T 46-3-5-3,种质来源:亚热带),4个自交系均为浙江大学选育。
荧光定量PCR试验所用RNA提取试剂盒购自北京华越洋生物科技有限公司;反转录试剂盒(PrimeScriptTMRT reagent Kit)购自北京Takara公司;荧光定量试剂盒(AceQ qPCR SYBR Green Master Mix)购自南京诺唯赞生物科技有限公司。
1.2 方 法
1.2.1低温处理及取样
实验采用基质培养。挑选健康、大小均匀的甜玉米种子,0.5%的次氯酸钠溶液消毒5 min,清水洗净后播于培养盒内,每盒30粒,合并3盒为1个重复。将其分为低温组和正常生长组,每组3次重复,并置于25 ℃培养箱中发芽。低温处理参照石云素[13]的方法并略作修改。待玉米幼苗长到2叶1心时,置于3 ℃培养箱中处理5 d,再置于25 ℃、12 h光照培养箱中恢复生长3 d。分别于低温处理0 d、1 d、5 d及恢复生长1 d、3 d 时取样进行生理生化指标测定;分别于低温处理0 d、1 d、3 d、5 d及恢复生长3 d时取样,液氮速冻后保存于-80 ℃冰箱用于后续基因表达量的测定。取样时均取幼苗同一部位叶片,所有指标测量重复3次。
1.2.2生理生化指标测定
采用蒽酮比色法[14]测定Pro含量;采用茚三酮显色法[14]测定可溶性糖含量。
取0.2 g叶片在pH值为7.8的磷酸缓冲液(PBS)中冰浴研磨成匀浆,4 ℃,10 000 r/min离心15 min,弃沉淀,上清液即为待测酶液。SOD活性测定采用氮蓝四唑(NBT)光化还原法[15];POD活性测定参照赵文赛[16]的方法并略作修改;CAT活性测定采用过氧化氢比色法[17];APX活性测定采用抗坏血酸比色法[18];谷胱甘肽还原酶(GR)活性测定参照Knorzer等[19]的方法并略作修改。
1.2.3荧光定量PCR(qRT-PCR)检测
以经过低温胁迫处理及正常生长的玉米幼苗叶片为试验材料,提取总RNA,反转录获得cDNA,并以此为模板,以ZmActin为内参基因,用LightCycler®96荧光定量仪进行扩增。反应总体积20 μL,包含100 ng cDNA(1 μL),7.4 μL ddH2O,上、下游引物各0.8 μL,10 μL SYBR®Green Master Mix。qPCR反应程序为:95 ℃ 5 min;95 ℃ 10 s,60 ℃ 30 s,95 ℃ 15 s,共45个循环。
采用Primer 5.0设计特异性引物(表1),引物由杭州擎科梓熙生物技术公司合成。数据分析采用LightCycler®96 system软件和2-ΔΔCT法。

表1 实时定量PCR引物Table 1 Real-time quantitative PCR primers
2 结果与分析
2.1 低温胁迫对甜玉米自交系苗期生长的影响
由图1可知,低温处理前,4个甜玉米自交系幼苗均为2叶1心,长势良好,叶色浓绿。3 ℃低温处理1 d后,各自交系幼苗均未发生显著变化。低温处理5 d后,11号自交系幼苗仍未发生明显变化;18号自交系少部分幼苗叶片边缘失水萎蔫皱缩,并伴有青黑色;而56号自交系部分幼苗叶片开始萎蔫下垂,胚芽鞘变为褐色;69号自交系幼苗也出现叶片失水萎蔫的现象。恢复生长1 d后的自交系相较于低温处理第5天无明显变化。恢复生长3 d后,11号和18号自交系虽有部分幼苗叶色发黄,但植株已恢复正常生长,叶片伸展,植株增长;而56号和69号自交系叶片萎蔫失水严重,已全部枯死。由此可见,11号与18号自交系抗冷性较强,而56号与69号自交系抗冷性差。两个敏感型材料相比,56号自交系对低温胁迫更敏感,在恢复生长3 d后基本干枯倒伏;69号自交系主要表现为叶片枯萎但茎秆大部分完好,只有部分幼苗出现倒伏情况。在后续生理生化指标和基因表达分析取样时,56号与69号自交系恢复生长3 d后的样品选取尚未完全死亡的幼苗叶片进行分析。

图1 低温处理期间及恢复生长后甜玉米自交系幼苗的生长情况 Fig.1 Growth of sweet corn inbred line seedlings during low temperature treatment and after recovery
2.2 生理生化指标
2.2.1低温胁迫对玉米幼苗可溶性糖含量的影响
可溶性糖是植物抵抗低温的重要保护性物质,能降低冰点,提高原生质保护能力,保护蛋白质胶体不致遇冷变性凝聚。由图2 A可以看出,11号和18号自交系在低温处理早期可溶性糖含量基本不变,69号自交系幼苗可溶性糖含量略有下降。11号、18号自交系在低温处理5 d后可溶性糖含量迅速上升,与处理前相比,分别上升88.1%和302.5%;69号自交系可溶性糖含量也有所升高,但仅上升30.8%。恢复生长期间,11号、18号和69号自交系可溶性糖含量均有所下降,恢复生长3 d比低温处理5 d时分别下降了24.0%、61.5%、78.3%,但11号和18号自交系可溶性糖含量仍高于处理前的水平,而69号则显著低于处理前的含量。56号自交系在整个低温处理和恢复生长阶段可溶性糖含量均维持在较低水平,未出现较大幅度的变化。
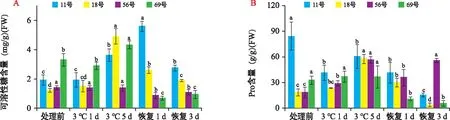
注:图中小写字母表示同一自交系不同处理间数据的差异显著性(p<0.05)。下同。 图2 不同甜玉米自交系在低温胁迫及恢复生长期间可溶性糖(A)和Pro(B)含量的变化 Fig.2 Changes of soluble sugar(A)and proline(B)contents of different sweet corn inbred lines during low temperature stress and recovery of growth
2.2.2低温胁迫对玉米幼苗Pro含量的影响
如图2 B所示,11号自交系Pro含量在低温处理期间表现为先迅速下降而后上升,至恢复生长阶段再次降低,总体来看,整个处理过程中Pro含量始终低于处理前的水平,恢复生长第3天降幅为81.8%。18号、56号自交系在低温处理期间Pro含量都逐渐上升,处理5 d后含量达到最高,与处理前相比分别上升了212.0%和208.0%;在恢复期18号和56号自交系的表现存在差异,18号自交系Pro含量持续下降,而56号自交系呈先降低后升高的趋势。69号自交系Pro含量在低温处理阶段基本不变,恢复正常温度后Pro含量迅速降低,其表现与冷敏感型56号自交系完全不同。
2.2.3低温胁迫对玉米幼苗POD活性的影响
由图3 A可以看出,11号自交系在低温处理期和恢复生长早期POD活性未发生显著变化,在恢复生长第3天则显著升高,上升幅度为59.7%。18号自交系POD活性一直处于上升趋势,恢复生长第1天上升幅度达110.4%,恢复生长第3天有所下降,但POD活性仍高于低温处理前水平。56号自交系在低温处理期间POD活性也持续上升,比处理前上升了65.2%,但在恢复生长阶段显著降低,与低温处理5 d时相比,恢复生长第3天POD活性下降了43.0%,低于处理前水平。69号自交系POD活性在整个处理时期表现为持续下降的趋势,恢复生长第3天降幅达到82.1%。
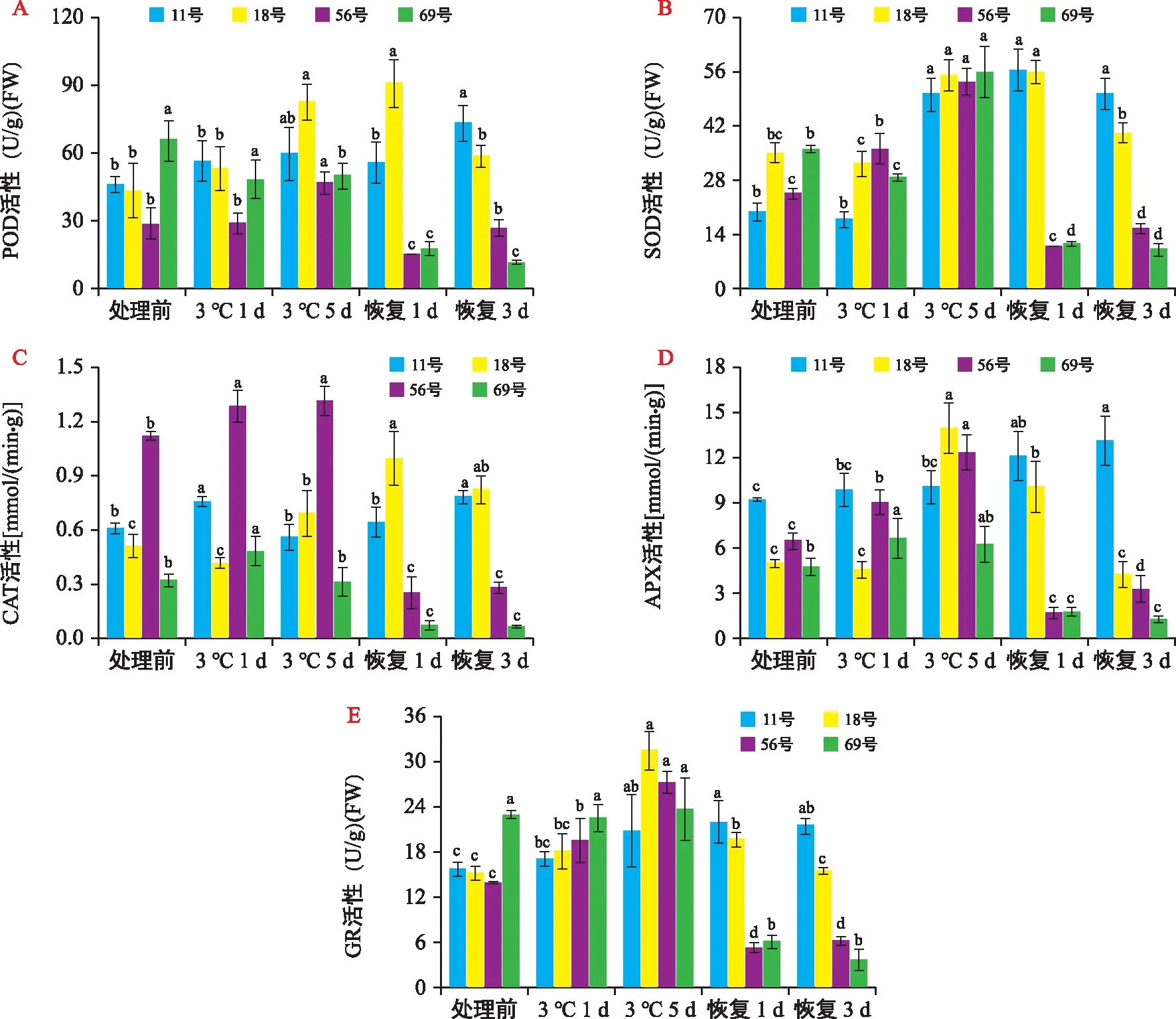
图3 不同甜玉米自交系在低温胁迫及恢复生长期间抗氧化酶活性的变化 Fig.3 Changes of antioxidant enzyme activities of different sweet corn inbred lines during low temperature stress and recovery of growth
2.2.4低温胁迫对玉米幼苗SOD活性的影响
抗性不同的甜玉米自交系在低温胁迫下SOD活性变化基本一致(图3 B)。在低温胁迫早期,SOD活性变化较小,而低温胁迫5 d后4个甜玉米自交系SOD活性均显著升高,与处理前相比分别上升153.2%、57.8%、116.7%和55.4%;但在恢复生长阶段,抗冷性不同的自交系之间表现出显著差异,11号自交系SOD活性变化不显著,18号自交系SOD活性略微下降,比低温胁迫5 d时仅下降27.2%,而冷敏感型自交系56号和69号在恢复期SOD活性骤然下降,降幅分别达到71.1%和81.8%。
2.2.5低温胁迫对玉米幼苗CAT活性的影响
抗冷型11号和18号自交系CAT活性变化与其POD活性变化相似(图3 C),11号自交系总体呈平缓上升的趋势,18号自交系则表现为先升后降,最高上升95.3%。56号自交系CAT的初始活性较高,在低温处理期间略微上升,而后在恢复生长期迅速下降,最高降低了74.8%;69号自交系也存在相似的变化,恢复生长期最高降低了80.3%,但与其他自交系相比,其CAT活性始终保持在较低水平。
2.2.6低温胁迫对玉米幼苗APX活性的影响
如图3 D所示,11号自交系在整个低温处理及恢复生长阶段均呈现稳步上升的趋势,在恢复生长第3天,其APX活性达到最高,比处理前上升了42.2%。18号自交系APX活性在低温处理第5天出现大幅度上升,与处理前相比上升了177.6%,随后在恢复期开始下降,至恢复第3天回落至处理前活性水平。56号自交系的变化趋势与18号自交系类似,在低温处理第5天APX活性上升幅度为90.6%,但是在恢复期活性迅速下降且显著低于处理前水平。69号自交系APX活性与其他3个自交系相比,低温处理期变化幅度不大,而恢复期表现与冷敏感型56号自交系相同,活性迅速下降。
2.2.7低温胁迫对玉米幼苗GR活性的影响
由图3 E可以看出,11号、18号和56号自交系在低温处理阶段GR活性持续上升,变化趋势相似,而69号自交系则未发生显著变化。在恢复期,56号和69号自交系GR活性大幅下降,恢复生长第1天与低温处理5 d时相比,降幅分别达到77.1%和84.2%,并显著低于处理前水平;18号自交系在恢复生长第3天回落至处理前水平;11号自交系在恢复期未发生显著变化,与处理第5天相比,仍保持较高的GR活性。
2.3 相关基因表达
2.3.1低温胁迫对玉米幼苗Pro合成和降解相关基因表达的影响
已有研究表明,Δ1-吡咯啉-5-羧酸合成酶(Δ1-pyrroline-5-carboxylate synthetase,P 5 CS)是谷氨酸途径合成Pro的关键酶,而脯氨酸脱氢酶(Proline dehydrogenase,ProDH)是Pro降解的主要限速酶[20]。如图4所示,18号自交系ZmP5CS表达量在低温处理第1天小幅度上升,随后略微下降,至恢复生长第3天则显著升高,比处理前增加102.6%;而56号自交系ZmP5CS表达量在低温处理第1天小幅度降低,恢复生长期没有显著变化,总体来看56号自交系ZmP5CS表达量在整个处理及恢复生长阶段变化趋势较平稳。18号和56号自交系ZmProDH表达量均呈先升后降的趋势,不同的是18号、56号自交系ZmProDH表达量分别在低温处理第3天和第5天达到峰值,与处理前相比增幅分别为280.3%和270.5%,随后在恢复生长第3天均迅速下降,显著低于处理前水平,与峰值相比分别下降了92.4%和98%。

图4 低温胁迫下不同甜玉米自交系Pro合成和降解基因的表达Fig.4 Expression of proline synthesis and degradation genes in different sweet corn inbred lines under low temperature stress
2.3.2低温胁迫对玉米幼苗抗氧化酶相关基因表达的影响
由图5可以看出,抗冷型18号自交系SOD相关基因ZmSOD3表达量在低温处理第1天显著上升,随后迅速回落至处理前的水平,低温处理5 d又显著升高,至恢复生长第3天其表达量达到峰值,比处理前增加119.6%;而ZmSOD4表达趋势完全不同,在低温处理第1天其表达量显著上升,随后迅速下降,至低温处理结束前一直保持较低水平,恢复期略有上升但仍显著低于处理前水平;ZmSOD9表达趋势与ZmSOD3相似,但表达量的首个峰值出现在低温处理第3天,随后开始回落,至恢复生长第3天又显著上升,比处理前增加411.0%。18号自交系CAT相关基因ZmCAT1和ZmCAT2表达趋势相同,均在低温处理第3天表达量达到峰值,与处理前相比增幅分别为279.8%和239.3%;而ZmCAT3随着低温处理时间增加,表达量显著下降,但在恢复生长第3天后大幅升高,并显著高于处理前。APX相关基因ZmAPX2在低温处理阶段表达量未发生显著变化,在恢复生长第3天略有下降,比处理前降低35.4%。GR相关基因ZmGR表达趋势与ZmCAT1和ZmCAT2相似,但其表达量在低温处理第1天显著升高,增幅为246.8%,之后迅速回落,至恢复生长第3天又恢复到处理前的水平。
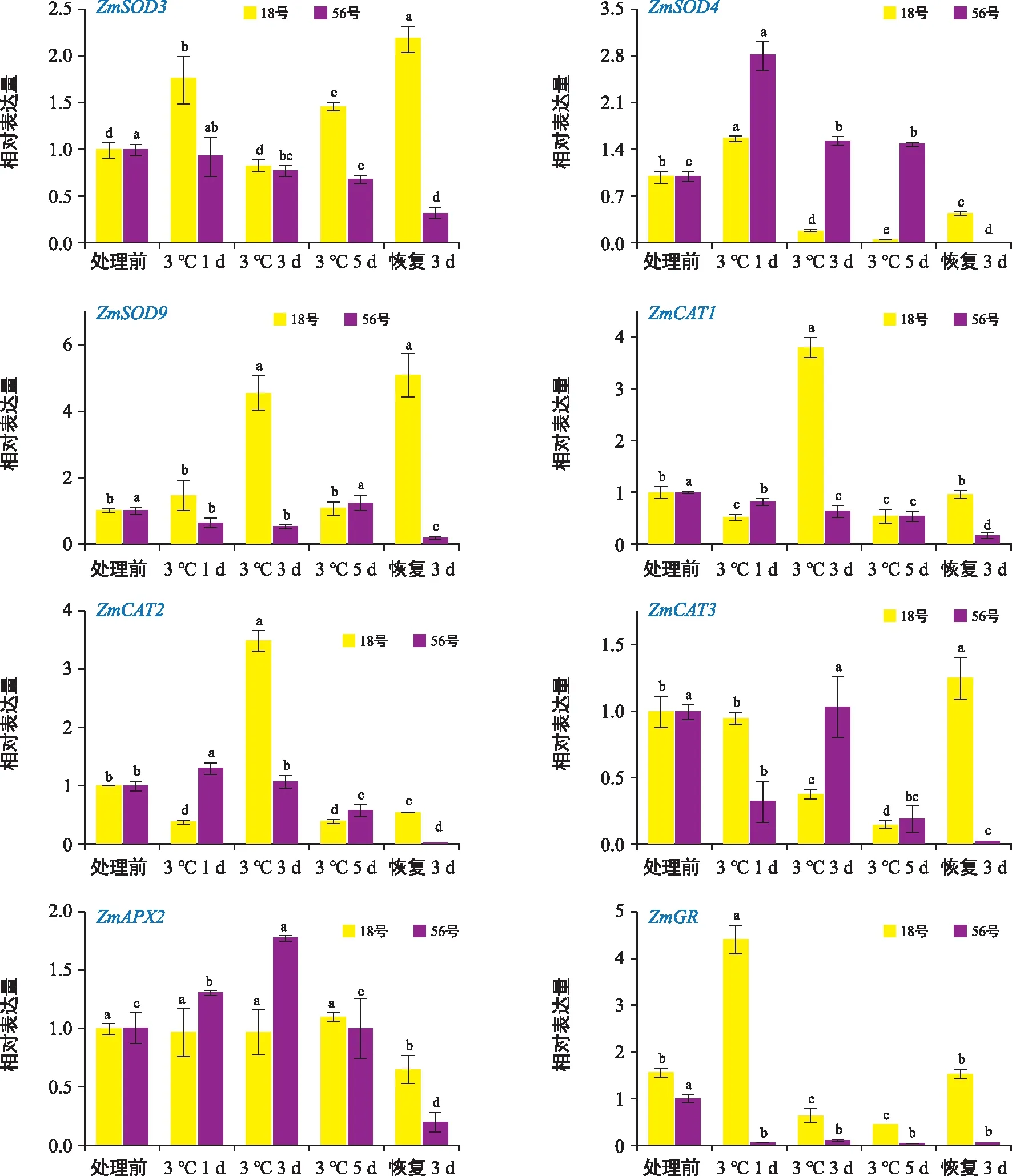
图5 低温胁迫下不同甜玉米自交系抗氧化酶相关基因的表达 Fig.5 Expression of antioxidant enzymes related genes in different sweet corn inbred lines under low temperature stress
对于冷敏感型56号自交系,其ZmSOD3、ZmSOD9、ZmCAT1和ZmCAT2在低温处理及恢复生长阶段整体表现为下降的趋势,且表达量保持在较低水平;ZmSOD4表达量在低温处理第1天显著升高,上升幅度为182.0%,随后显著降低,但仍然高于处理前水平,到恢复生长第3天却急剧下降,基本检测不到其表达量。ZmCAT3在低温处理第1天表达量显著下降,第3天又迅速回升,之后持续下降,至恢复生长第3天表达量显著低于处理前水平。而ZmAPX2表达量表现为先升高后降低的趋势,低温处理第3天达到峰值,与处理前相比上升了78.2%,恢复生长第3天又迅速下降,与处理前相比总降幅为80.2%。ZmGR表达量在整个低温处理及恢复生长阶段都很低,基本检测不到。
3 结论与讨论
3.1 低温胁迫对玉米幼苗生长的影响
低温是典型的环境胁迫因素之一,对植物生长发育有重要的影响。一般认为,低温胁迫会使植物能量产生和物质合成受阻,消耗增强,当植物长期处于低温下就会造成饥饿状态,严重影响植物的正常生长发育甚至导致死亡。本试验通过对4个不同抗性的甜玉米自交系进行苗期3 ℃、5 d低温处理发现,在低温处理早期其生长状态均未发生显著变化,但在低温处理末期,抗冷型自交系仍保持正常生长状态,而冷敏感型自交系出现较为明显的叶片萎蔫甚至下垂的现象;恢复生长后抗冷型自交系幼苗已开始正常生长仅有少部分叶色发黄,而56号和69号自交系绝大多数失水死亡。由此说明,低温对植物体造成的伤害程度不仅取决于低温的程度,还取决于低温持续时间。低温胁迫时间较短、程度较轻,会使细胞的生活力降低、植物的生长停滞,如果低温胁迫时间过长或温度过低,则可能延缓植物的生长发育,严重时甚至会导致植物死亡。
3.2 低温胁迫对可溶性糖含量的影响
可溶性糖作为细胞主要的渗透调节物质之一,在植物遭受低温胁迫时可通过其含量的增加来提高细胞渗透势,从而减缓细胞失水,提高植物的抗冷性。通过糖的代谢,可溶性糖产生其他代谢产物,保护细胞膜系统免受逆境伤害[21]。研究表明,可溶性糖的含量是冷驯化完成程度的标志性指标,与植物抗冷性呈正相关[22]。在本试验中,抗冷性不同的4个甜玉米自交系幼苗在低温胁迫早期可溶性糖含量均未发生显著变化,而随着低温胁迫时间延长,抗冷性强的11号和18号自交系可溶性糖含量显著升高,而抗冷性弱的69号自交系可溶性糖含量仅升高30.8%。由此可见,一般情况下,低温会诱导玉米幼苗可溶性糖含量的升高,其积累的程度与抗冷性存在较强的相关性,这也与自交系幼苗在低温胁迫下的生长表现相一致。抗冷型自交系在恢复期可溶性糖含量下降缓慢,恢复生长第3天可溶性糖含量仍高于处理前的水平;但冷敏感型自交系在恢复正常生长温度第1天,其可溶性糖含量急剧下降,并显著低于处理前的水平,无法维持细胞渗透势,从而导致细胞严重失水,形态上表现为失水萎蔫甚至枯死。
3.3 低温胁迫对Pro代谢的影响
在逆境下Pro的积累主要包括三方面原因:一是Pro合成加强,二是Pro氧化作用受抑制,三是低温抑制了蛋白质合成,蛋白质的分解大于合成,也就抑制了Pro渗入蛋白质的过程[23]。已有研究表明,玉米游离Pro含量与抗冷性呈正相关[24]。在本试验中,除11号自交系外,其他3个自交系在低温胁迫期间Pro含量均显著上升,这与前人研究基本相符。虽然在多种非生物逆境胁迫下Pro的降解减弱或被抑制,但Pro降解过程在维持细胞内氧化还原状态的平衡,以及提供胁迫恢复后植物恢复正常生长的能量源方面有着重要作用[25]。因此,这可能是4个自交系在恢复生长后Pro含量降低的主要原因,但56号自交系在恢复正常生长第3天,Pro含量的异常升高可能与Pro降解途径受阻等有关,而69号自交系在恢复生长后幼苗失水萎蔫严重可能导致了Pro含量的急剧下降。
胁迫条件下Pro合成酶基因P5CS的表达量增加,降解酶基因ProDH的表达量降低[26];而且胁迫条件下P 5 CS酶活性增加,ProDH酶活性降低,游离Pro的积累增加[27]。因此,目前比较一致的结论为:在多种非生物胁迫下,植物体内的Pro合成增强,降解减弱,从而引起Pro的积累,提高植物对胁迫的抗性。本试验通过对甜玉米自交系幼苗叶片中ZmP5CS和ZmProDH的表达量分析发现,在低温胁迫下,抗冷性强的18号自交系ZmP5CS的表达量略有上升,并且在恢复期显著升高,而抗冷性弱的56号自交系ZmP5CS的表达量未发生较为明显的变化;ZmProDH在18号和56号自交系中的表现则基本相似,均在低温胁迫期间出现表达高峰,这一现象与前人研究不相符。不仅如此,对比测得的叶片Pro含量可以看出,Pro代谢基因的表达模式与实际Pro含量的变化趋势并不一致,这可能与低温胁迫影响Pro代谢途径中关键酶的活性有关。此外,干旱和低温均能活化Pro合成的2条途径,且干旱胁迫下Pro的积累更依赖于鸟氨酸途径[26-27]。因此,低温对鸟氨酸途径造成的影响或许也会导致这一现象发生。
3.4 低温胁迫对抗氧化酶系统的影响
POD作为内源活性氧清除剂,能够在低温逆境中清除体内过量的H2O2,维持活性氧代谢的平衡,保持膜结构的稳定性,从而减轻或消除伤害。本试验结果表明,抗冷性强的自交系在低温胁迫期POD活性持续上升,尤其是18号自交系上升幅度达到了110.4%;抗冷性弱的56号自交系上升幅度只有65.2%。说明抗冷型自交系的POD活性更容易受到低温诱导。在恢复期POD活性同样处于较高的水平,这与冯玉磊等[28]、王晓楠等[29]的结论基本相同。
玉米中SOD同工酶主要是铜锌超氧化物歧化酶(Cu/Zn-SOD)、锰超氧化物歧化酶(Mn-SOD)和铁超氧化物歧化酶(Fe-SOD)。其中SOD 3编码线粒体Mn-SOD,SOD 4、SOD 9编码细胞质型Cu/Zn-SOD[30]。本试验发现,4个甜玉米自交系中SOD活性在低温胁迫初期均未发生显著变化,但是随着低温胁迫时间的延长,第5天的SOD活性均显著升高,说明低温胁迫5 d后玉米幼苗内氧自由基含量有了较多的积累,植株开始通过增加SOD活性应对低温损伤产生的应激反应以清除多余的氧自由基。而在恢复期抗冷型和冷敏感型自交系表现出极大差异,抗冷性强的11号和18号自交系仍保持较高的SOD活性,但冷敏感型的56号和69号自交系SOD活性骤然下降,显著低于处理前的水平,说明低温胁迫所积累的伤害已经对幼苗的正常生长及生理代谢造成了严重影响,从而使SOD活性降低;相反,抗冷性强的自交系幼苗为了防止受到进一步伤害而保持着较高的酶活性。从qPCR分析中可以看出,18号自交系ZmSOD3、ZmSOD4以及56号自交系ZmSOD4表达量在低温胁迫初期显著升高,说明在低温胁迫初期幼苗就开始响应低温危害;而且ZmSOD3、ZmSOD4和ZmSOD9表达量出现峰值的时间为第1天至第3天,这与酶活性的趋势略有不同,可能是因为从基因转录至翻译成蛋白质这一过程需要其他的酶参与,而低温对这些酶的活性存在一定影响,从而使得基因表达与酶活性表现之间存在一种滞后现象。在恢复生长期SOD合成相关基因的表达量与酶活性的表现较为一致,尤其是冷敏感型56号自交系在恢复生长末期基本检测不到SOD合成相关基因的表达量,说明低温已经对幼苗造成不可逆的损伤。
CAT、APX、GR活性在各个自交系之间的表现趋势大致相同,其中11号自交系酶活性水平持续上升,在恢复期依然保持较高的酶活性;18号自交系表现为先升后降,但在恢复期只有APX和GR活性回落到处理前水平,说明抗坏血酸-谷胱甘肽循环在低温胁迫阶段参与了活性氧的清除。56号自交系的3种酶活性虽然在低温处理期也显著上升且酶活性水平较高,而在恢复期有明显的骤然下降趋势,这可能与恢复正常温度后植株叶片萎蔫、细胞正常生理代谢活动受阻等有关,相应的酶活性也随之骤降;同理,69号自交系在恢复阶段酶活性降低的原因可能也是如此。从基因表达水平上看,18号自交系在低温处理期CAT活性升高是ZmCAT1、ZmCAT2和ZmCAT3共同作用的结果,而在胁迫后的恢复期ZmCAT3表达量显著上升,对后期酶活性的维持可能起着主导作用;ZmAPX2和ZmGR的表达趋势与酶活性的变化大致相同。而56号自交系ZmCAT1一直保持较低的表达水平,ZmCAT2在低温处理第1天显著上升,ZmCAT3在低温处理早期却显著下降,低温处理第3天又显著上升,随后显著下降,因此CAT活性升高可能先后与ZmCAT2和ZmCAT3有较为密切的关系;ZmAPX2在56号自交系中的表达与酶活性表现基本一致,而ZmGR则基本检测不到其表达,与酶活性表现存在较大出入,可能与转录和翻译后的一系列调控有关。除此之外,基因表达与酶活性峰值出现差异的原因可能与SOD类似。
总的来说,在低温胁迫1 d后玉米自交系的部分抗氧化酶活性开始产生变化,在处理5 d时变化最为显著,与Burnett等[31]的研究基本相符。同时,结合抗氧化酶活性变化以及基因表达水平变化可以发现,抗冷型自交系在低温胁迫下抗氧化酶基因的表达量整体高于冷敏感型自交系,表明抗冷型自交系在低温逆境时能建立更强的抗氧化防御机制来清除活性氧,从而保护植物细胞免受毒害。
自交系幼苗为了应对低温胁迫,通过提高细胞可溶性糖及Pro含量,以维持正常渗透势及氧化还原状态的平衡,并提供胁迫解除后植株正常生长所需的能量源,同时也需要多种抗氧化酶共同参与清除活性氧。因此,从响应机制来看,可溶性糖与Pro的积累以及多种抗氧化酶的共同参与可能是玉米幼苗抗冷性形成的重要途径,同时恢复期也是其响应机制的关键时期。

