诃黎勒酸和诃子酸的提取、分离工艺优化Δ
陈九妹,朱麒臻,鞠成国,张强,王巍(辽宁中医药大学药学院,辽宁 大连 116600)
诃子为使君子科植物诃子Terminalia chebulaRetz.或绒毛诃子T.chebulaRetz.var.tomentellaKurt.的干燥成熟果实,具有涩肠止泻、敛肺利咽的功效,主要用于治疗久泻久利、咽痛音哑,现收载于2020年版《中国药典》(一部)[1]。诃子具有抗炎、抗氧化、抗肿瘤等作用[2-3],在蒙、藏医药方剂中使用广泛。鞣质类成分是诃子的主要化学成分,其含量达23.6%~37.4%,主要包括没食子酸、诃子次酸、鞣花酸、诃黎勒酸、诃子酸等成分[4],具有抗炎、抗氧化、抗肿瘤等作用[5]。本课题组前期通过对10批不同产地诃子药材含量分析发现,诃黎勒酸平均含量约10%,诃子酸平均含量约7%,含量较高[6]。有研究从诃子植物亲缘学、传统药效药性、临床应用、化学成分等方面进行分析得出,诃黎勒酸和诃子酸为诃子的质量标志物[7];也有研究认为,诃黎勒酸、诃子酸含量与诃子药材的品种、性状、质量均具有相关性[8],因此这2个成分可作为诃子药材质量控制及质量溯源的重要指标。目前,有研究采用大孔吸附树脂富集后结合制备型高效液相色谱、高速逆流色谱等方法分离制备诃黎勒酸、诃子酸,但分离过程复杂、产率低、成本高[9-10]。为此,本研究以诃黎勒酸和诃子酸含量为指标,优化2种成分的提取、分离工艺,得到其纯品,旨在为诃子药材药效物质研究及质量控制提供基础。
1 材料
1.1 主要仪器
本研究所用主要仪器有Agilent 1100型高效液相色谱仪(美国Agilent公司)、FA1004B型分析天平(上海精密科学仪器有限公司)、DFT-100型粉碎机(温岭市林大机械有限公司)、410HTD型数码超声波清洗机(深圳市洁拓超声波清洗设备有限公司)等。
1.2 主要药品与试剂
诃黎勒酸对照品(批号PRF8112302)、诃子酸对照品(批号PRF8071201)均购自成都普瑞法科技开发有限公司,纯度均大于98%;甲醇为色谱纯,乙醇、磷酸均为分析纯,水为超纯水。诃子药材于2019年购自河北安国药材市场(产地云南),经辽宁中医药大学药学院翟延君教授鉴定为使君子科植物诃子T.chebulaRetz.的干燥成熟果实。
2 方法与结果
2.1 诃黎勒酸和诃子酸含量测定方法的建立
2.1.1 色谱条件 以Diamonsil Plus C18(250 mm×4.6 mm,5 μm)为色谱柱,以0.1%磷酸溶液(A)-甲醇(B)为流动相进行梯度洗脱(0~8 min,5%B→10%B;8~15 min,10%B→25%B;15~25 min,25%B;25~30 min,25%B→30%B;30~50 min,30%B→45%B;50~55 min,45%B);进样量为 10 μL;流速为 1.0 mL/min;柱温为30 ℃;检测波长为270 nm。
2.1.2 混合对照品溶液的制备 取诃黎勒酸、诃子酸对照品适量,精密称定,加甲醇制成诃黎勒酸、诃子酸质量浓度分别为418、413 μg/mL的混合对照品溶液。
2.1.3 供试品溶液的制备 取诃子粉末(过四号筛)约0.1 g,精密称定,置于具塞锥形瓶中,精密加入70%甲醇50 mL,密塞,称定质量,超声处理(功率240 W,频率40 kHz,下同)20 min,放冷,再次称定质量,用70%甲醇补足减失的质量,摇匀,滤过,取续滤液,即得。
2.1.4 专属性试验 取上述供试品溶液、混合对照品溶液和空白溶液(70%甲醇),按“2.1.1”项下色谱条件进样分析,记录色谱图(图1,空白图略)。结果显示,各待测成分的色谱峰与相邻峰分离度均大于1.5,空白溶液无干扰。
2.1.5 线性关系考察 取“2.1.2”项下混合对照品溶液适量,用甲醇逐级稀释,制得诃黎勒酸质量浓度分别为209.0、104.5、52.25、26.13、13.06、6.531、3.266 μg/mL,诃子酸质量浓度分别为206.5、103.3、51.63、25.81、12.91、6.453、3.227 μg/mL的系列线性工作溶液,取上述系列线性工作溶液,按“2.1.1”项下色谱条件进样分析,记录峰面积。以待测成分的质量浓度为横坐标(X)、峰面积为纵坐标(Y)进行回归分析。结果显示,诃黎勒酸的回归方程为Y=11.815X-9.087 9(r=0.999 9),诃子酸的回归方程为Y=11.846X-4.200 0(r=0.999 9),表明诃黎勒酸质量浓度在3.266~209.0 μg/mL、诃子酸在3.227~206.5 μg/mL范围内线性关系良好。
2.1.6 精密度试验 取“2.1.3”项下供试品溶液,按“2.1.1”项下色谱条件连续进样6次,记录峰面积。结果显示,诃黎勒酸、诃子酸峰面积的RSD分别为0.72%、0.89%(n=6),表明方法精密度良好。
2.1.7 稳定性试验 取“2.1.3”项下供试品溶液,分别于室温下放置0、2、4、8、12、24 h时按“2.1.1”项下色谱条件进样分析,记录峰面积。结果显示,诃黎勒酸、诃子酸峰面积的RSD分别为0.98%、1.10%(n=6),表明供试品溶液在室温下放置24 h内稳定性良好。
2.1.8 重复性试验 取诃子粉末,共6份,按“2.1.3”项下方法平行制备供试品溶液,再按“2.1.1”项下色谱条件进样分析,记录峰面积并按外标一点法计算样品含量。结果显示,诃黎勒酸、诃子酸含量的RSD分别为1.30%、1.20%(n=6),表明方法重复性良好。
2.1.9 加样回收率试验 分别称取已知诃黎勒酸和诃子酸含量的诃子粉末0.05 g,共6份,精密称定,分别加入相当于样品中各成分含量100%的混合对照品溶液,按“2.1.3”项下方法制备供试品溶液,再按“2.1.1”项下色谱条件进样分析,记录峰面积并计算加样回收率。结果显示,诃黎勒酸、诃子酸的加样回收率分别为99.36%(RSD=0.55%,n=6)、99.78%(RSD=0.83%,n=6),表明方法准确度良好。
2.1.10 样品中2种成分的含量测定 取诃子样品,按“2.1.3”项下方法制备供试品溶液,再按“2.1.1”项下色谱条件进样分析,记录峰面积并按外标一点法计算样品含量。平行测定3次,取平均值。
2.2 诃黎勒酸和诃子酸的提取工艺优化
2.2.1 单因素实验 (1)根据本课题组前期研究数据,分别对超声提取、回流提取及常温浸渍等3种提取方式进行考察。取诃子粉末5 g,共3份,精密称定,1份置于具塞锥形瓶中,精密加入70%乙醇50 mL,密塞,超声处理40 min;1份置于圆底烧瓶中,精密加入70%乙醇50 mL,加热回流2 h;1份置于具塞锥形瓶中,精密加入70%乙醇50 mL,摇匀,密塞,静置24 h。取上述各提取液,滤过,于水浴蒸至近干,真空干燥,分别取相当于0.1 g诃子粉末的干膏,按“2.1.10”项下方法测定诃黎勒酸、诃子酸含量。结果显示,采用超声提取时诃黎勒酸、诃子酸含量最高(图2A),故选择超声提取。(2)乙醇体积分数考察。取诃子粉末5 g,共11份,精密称定,置于具塞锥形瓶中,分别精密加入不同体积分数的乙醇(0、10%、20%、30%、40%、50%、60%、70%、80%、90%、100%)50 mL,密塞,超声处理40 min,放冷,滤过,于水浴蒸至近干,真空干燥,各取相当于0.1 g诃子粉末的干膏,按“2.1.10”项下方法测定诃黎勒酸、诃子酸含量。结果显示,当乙醇体积分数为70%时,诃黎勒酸、诃子酸含量最高(图2B),故选择乙醇体积分数为70%。(3)液料比考察。取诃子粉末5 g,共6份,精密称定,置于具塞锥形瓶中,分别以不同液料比(5∶1、10∶1、15∶1、20∶1、25∶1、30∶1,mL/g)精密加入70%乙醇,密塞,超声处理40 min,放冷,滤过,于水浴蒸至近干,真空干燥,各取相当于0.1 g诃子粉末的干膏,按“2.1.10”项下方法测定诃黎勒酸、诃子酸含量。结果显示,当液料比为25∶1、30∶1(mL/g)时,诃黎勒酸、诃子酸的含量较高,且趋于稳定(图2C),考虑到节省试剂,故选择液料比5∶1、15∶1、25∶1(mL/g)进行后续研究。(4)提取时间考察。取诃子粉末5 g,共6份,精密称定,置于具塞锥形瓶中,精密加入70%乙醇125 mL,密塞,分别以不同超声时间(10、20、30、40、50、60 min)处理,放冷,滤过,于水浴蒸至近干,真空干燥,各取相当于0.1 g诃子粉末的干膏,按“2.1.10”项下方法测定诃黎勒酸、诃子酸含量。结果显示,当提取时间为10、20 min时,诃黎勒酸、诃子酸的含量均较高(图2D),考察到提取完全,故选择提取时间10、20、30 min进行后续研究。(5)物料粒径考察。取诃子粉末5 g,共6份,分别按不粉碎和粉碎过10目筛、过24目筛、过65目筛、过120目筛、过200目筛处理后,精密称定,置于具塞锥形瓶中,精密加入70%乙醇125 mL,密塞,超声处理20 min,放冷,滤过,于水浴蒸至近干,真空干燥,各取相当于0.1 g诃子粉末的干膏,按“2.1.10”项下方法测定诃黎勒酸、诃子酸含量。结果显示,当物料粒径为120目时,诃黎勒酸、诃子酸的含量均较高,且趋于稳定,与200目时无差异(图2E),加之诃子肉的纤维性较强,不易于粉碎为较细的粉末,故选择物料粒径24、65、120目进行后续研究。
2.2.2 正交实验设计 根据单因素实验结果及参考相关文献[11-12],选择以物料粒径(A)、液料比(B)、提取时间(C)、提取次数(D)为考察因素,采用L9(34)表进行正交实验。由于诃黎勒酸、诃子酸均为指标成分,故将两者的权重系数均设置为0.5。采用加权平均法进行综合评价,综合评分=诃黎勒酸含量/诃黎勒酸含量最大值×0.5×100+诃子酸含量/诃子酸含量最大值×0.5×100。综合评分越高,表示该工艺参数下所得目标产物越多[13]。正交实验设计的因素与水平见表1,正交实验设计方案与结果见表2,方差分析结果见表3。

表1 正交实验的因素与水平
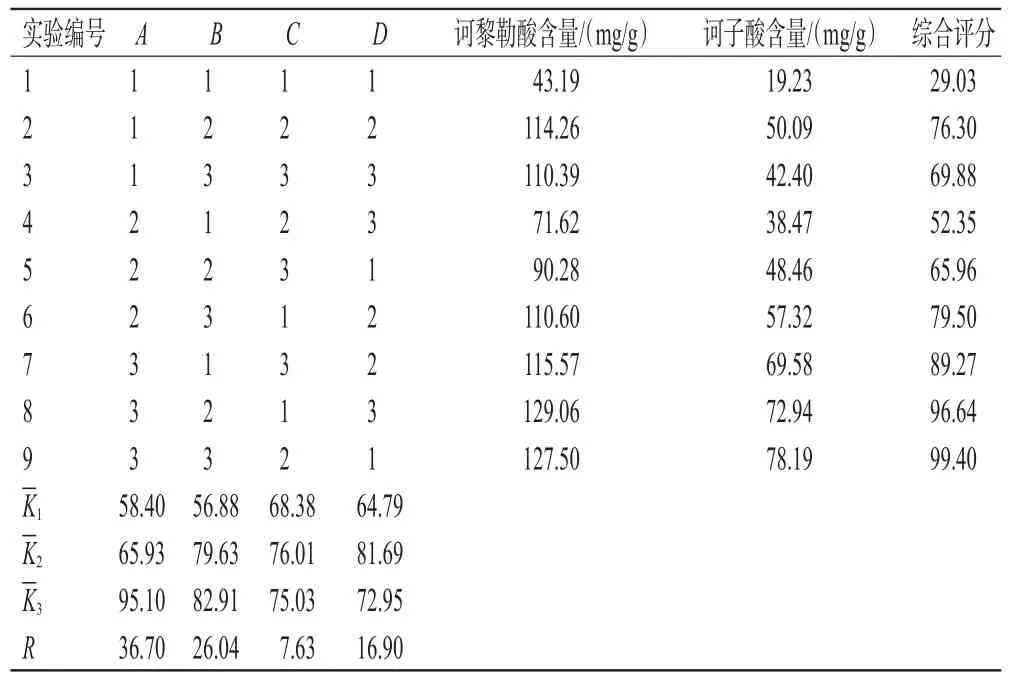
表2 正交实验设计方案与结果
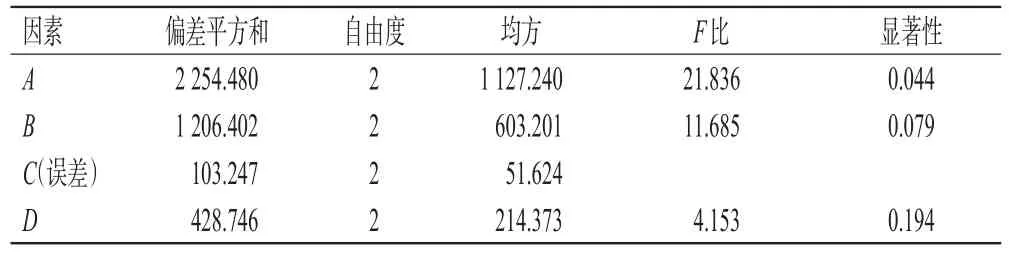
表3 方差分析结果
由表3可知,提取结果的影响顺序为A>B>D>C,因素A对诃黎勒酸及诃子酸含量有显著影响(P<0.05),其他3个因素无显著影响(P>0.05)。结合表2结果,得到最佳提取工艺为A3B3C2D2,即物料粒径120目,液料比25∶1(mL/g),提取时间20 min,提取次数2次。
2.2.3 诃黎勒酸和诃子酸的提取工艺验证 取诃子粉末50 g,共3份,按“2.2.2”项下最佳提取工艺参数进行提取,放冷,滤过,于水浴蒸至近干,真空干燥,各取相当于0.1 g诃子粉末的干膏,按“2.1.10”项下方法测定诃黎勒酸、诃子酸含量,平行测定3次。结果显示,平均综合评分为99.33分(RSD=0.68%),表明所得最佳提取工艺简单可行。结果见表4。
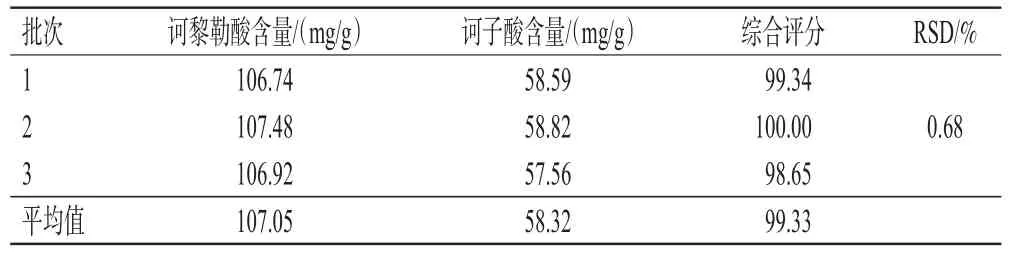
表4 诃黎勒酸和诃子酸提取工艺的实验验证结果(n=3)
2.3 诃黎勒酸和诃子酸的分离工艺优化
2.3.1 上样液浓度的考察 按“2.2.3”项下最佳提取工艺提取,将提取液减压回收溶剂至近干,用35%甲醇制成2种不同质量浓度的上样液(1.0、0.5 g/mL),以十八烷基键合硅胶反相填料(ODS)用量与上样生药量比为10∶1.5(g/g)上样,以甲醇-水(35∶65,V/V)洗脱,每个柱体积收集1份洗脱液,按“2.1.10”项下方法测定。结果显示,当上样液浓度为1.0 g/mL时,由于溶液浓度高、黏度大,容易堵塞色谱柱,并且吸附速度较慢,可能造成死吸附;当上样液浓度为0.5 g/mL时,诃黎勒酸、诃子酸累积洗脱量高于浓度为1.0 g/mL时诃黎勒酸和诃子酸累积洗脱量,故选择上样液浓度为0.5 g/mL。结果见图3。
2.3.2 洗脱溶剂的考察 按“2.2.3”项下最佳提取工艺提取,将提取液减压回收溶剂至近干,用20%甲醇制成质量浓度为0.5 g/mL的上样液,以ODS与上样生药量比10∶1(g/g)上样,以不同洗脱溶剂[洗脱溶剂Ⅰ为甲醇-水(1∶4→1∶3→3∶7,V/V),洗脱溶剂Ⅱ为甲醇-水(1∶4→3∶7,V/V)]洗脱,每个柱体积收集1份洗脱液,按“2.1.10”项下方法测定。结果显示,以甲醇-水(1∶4→1∶3,V/V)洗脱时,得到的诃黎勒酸含量较低,且诃黎勒酸纯度降低;以甲醇-水(1∶4→3∶7,V/V)洗脱时,得到的诃黎勒酸纯度较高。因此以甲醇-水(1∶4,V/V)洗脱诃黎勒酸,甲醇-水(3∶7,V/V)洗脱诃子酸。结果见图4。
2.3.3 ODS用量与上样生药量比值的考察 按“2.2.3”项下最佳提取工艺提取,将提取液减压回收溶剂至近干,用20%甲醇制成质量浓度为0.5 g/mL的上样液,分别以不同ODS用量与上样生药量比值(10∶1、10∶1.5、10∶2,g/g)上样,以甲醇-水(1∶4,V/V)洗脱诃黎勒酸,甲醇-水(3∶7,V/V)洗脱诃子酸,每个柱体积收集1份洗脱液,按“2.1.10”项下方法测定。结果显示,当ODS用量与上样生药量比值为10∶1(g/g)时,第1个柱体积虽有诃黎勒酸流出,但无诃子酸流出,表明此时色谱柱不超载;当ODS与上样生药量比值为10∶1.5(g/g)时,第1个柱体积只有极少量诃黎勒酸流出,表明此时色谱柱亦不超载;当ODS用量与上样生药量比值为10∶2(g/g)时,第1个柱体积除了有大量诃黎勒酸流出之外,还可检测到少量的诃子酸,证明此时色谱柱已超载,故选择ODS用量与上样生药量比值为10∶1.5(g/g)。结果见图5。
2.3.4 诃黎勒酸、诃子酸的分离工艺验证 取诃子粉末3 g,共3份,按“2.2.3”项下最佳提取工艺提取,将提取液减压回收溶剂至近干,用20%甲醇制成质量浓度为0.5 g/mL的上样液。取ODS 20 g,湿法装柱,以初始流动相平衡后,取上样液上样,待液面下降至柱床顶部,以甲醇-水(1∶4,V/V)洗脱,收集第2~10个柱体积的流分得到诃黎勒酸,然后继续甲醇-水(1∶4,V/V)洗脱至第17个柱体积后,改为甲醇-水(3∶7,V/V)洗脱,收集第2~5个柱体积的流分得到诃子酸。分别减压回收溶剂,得到的产品经重结晶后按“2.1.10”项下方法测定,计算总得率,并采用面积归一化法计算产品纯度,平行测定3次。结果见表5。

表5 诃黎勒酸和诃子酸分离工艺验证结果(n=3)
3 讨论
诃黎勒酸和诃子酸的分子结构中存在多个没食子酰基,极性较强[14],因此在提取过程中考察了不同体积分数乙醇为提取溶剂时对诃黎勒酸、诃子酸含量的影响。当乙醇体积分数为70%时,诃黎勒酸、诃子酸含量均较高。在确定提取溶剂的前提下对其他参数进行正交实验,确定最佳提取工艺为70%乙醇超声提取,粒径120目,液料比25∶1(mL/g),提取时间20 min,提取次数2次。经3次实验验证,所得提取工艺重复性好,稳定性好,简单可行。
在诃黎勒酸和诃子酸的分离过程中,根据诃黎勒酸和诃子酸的结构及性质,选择ODS作为固定相,这有效避免了使用硅胶作为填料时对组分的死吸附,降低了诃黎勒酸、诃子酸的损失,提高了生产效率;反相色谱的流动相以水为底剂,减少了有机溶剂的使用,降低了对实验人员的危害及环境污染,适用于诃黎勒酸和诃子酸的大量生产。在诃黎勒酸和诃子酸分离工艺参数的确定中,以高效液相色谱法进行检测,最终确定以甲醇-水(1∶4,V/V)为初始洗脱剂,冲洗2个柱体积后大极性成分即可出柱完全,继续收集1~9个柱体积的洗脱液可得到诃黎勒酸;再以甲醇-水(3∶7,V/V)洗脱,收集1~5个柱体积的洗脱液可得到诃子酸;当诃黎勒酸和诃子酸在洗脱液中的纯度达到80%以上时,通过回收溶剂可得到结晶,经过重结晶即可制得诃黎勒酸及诃子酸纯品。
综上所述,所建立的诃黎勒酸和诃子酸的提取、分离工艺简单可行。

