仙芪消渴饮治疗糖尿病肾脏病的潜在作用机制
刘梦阳,李海勇,郭燕,张富赓,刘征堂
1.中国中医科学院西苑医院老年病科(北京100091);2.苏州市中西医结合医院康复科(苏州215101);3.北京香山社区卫生服务中心中医科(北京100093);4.天津市环湖医院药剂科(天津 300350)
糖尿病肾脏病(diabetic kidney disease,DKD)是由糖尿病导致的慢性肾脏疾病(chronic kidney disease,CKD),是目前引起终末期肾脏疾病(End-stage renal disease,ESRD)最主要的原因[1]。文献报道我国2 型糖尿病患者DKD患病率为20%~40%[2-3];与不合并DKD的糖尿病病人相比,DKD病人死亡率更高。
糖尿病肾脏病属于中医“水肿”、“关格”范畴。中国中医科学院西苑医院老年病科自2型糖尿病作为临床路径以来,通过不断梳理,经层次聚类和复杂网络分析得到:糖尿病由早中期进展至晚期,病性由实转虚、病位由上中二焦转向下焦,核心处方由以清利湿热、凉血散瘀、疏达上中二焦郁滞的“桑蚕饮”(科室另一自拟方)过渡到以补肾填精、利湿化浊为法的六味地黄汤类方。科室自拟仙芪消渴饮,针对糖尿病肾功能受损这一并发症疗效显著[4]。
网络药理学以网络靶标为核心,对药物与疾病的机制性关联进行系统化、可视化地揭示解构;因其研究思路和学科特点与中医药整体观念不谋而合,故近年来已被广泛应用于中药研发[5-6]。分子对接是将配体分子置于受体分子活性位点区域并通过几何互补、能量互补等原则找到二者的最佳结合模式[7]。本研究拟借助网络药理学和分子对接法探索仙芪消渴饮治疗糖尿病肾脏病的核心药效团及其作用机制,以期为优化临床路径、经典名方再开发提供循证医学依据。
1 材料与方法
1.1 活性成分收集和靶点预测
应用数据库TCMSP(http://tcmspw.com/tcmsp.php)以药物口服生物利用度(oral bioavailability,OB)≥30%,类药性(drug-likeness,DL)≥0.18 作为筛选条件,依次搜索仙芪消渴饮中的10味中药得到各自的活性成分;再通过文献挖掘予以补充后查询出相应靶点信息。
1.2 确定DKD相关靶点
1.2.1 提取基因芯片样本信息 登录GEO数据库(https://www.ncbi.nlm.nih.gov/),输入“diabetic kidney disease”进行检索,筛选出同时含有DKD 肾组织和对照肾组织的人源基因芯片并从中提取样本数据。
1.2.2 获取差异基因(DEGs)序列 首先,通过Perl脚本将DKD 相关基因芯片的样本数据分组条理化;之后在R3.6.2 环境下,按照P.Val<0.05、|log2(FC)|>0.5 的条件依托Bioconductor(www.bioconductor.org/)功能包筛选出DKD 肾组织较对照肾组织显著上调、下调的差异基因序列,合为DKD 相关靶点;同时绘制相应的热图和火山图。
1.3 创建“中药复方成分-疾病-靶点网络”
利用韦恩图(Venn Diagram)确定仙芪消渴饮治疗DKD的潜在作用靶点,即二者靶点之交集。通过Cyto⁃scape3.7.2软件将“中药复方成分-疾病-靶点网络”可视化。
1.4 分析靶蛋白互作网络
利用Cytoscape3.7.2 插件Bisogenet 构建蛋白互作网络(protein-protein interaction,PPI);CytoNCA 插件对其进行拓扑分析,先后点击Centralities 下“degree(DC)”、analyze、DC>61 和Centralities 下“Betweeness(BC)”、analyze、BC>600,得到PPI核心网络。
1.5 挖掘PPI核心网络功能模块
利用MCODE插件的聚类算法寻找基因簇,从而实现对PPI 核心网络的模块化分析。在操作过程中分别设定“Degree Cutoff”、“Node Score Cutoff”、“K-Core”和“Max.Depth”,依次为2、0.2、5、100。
1.6 GO功能富集分析及KEGG通路富集分析
运行R3.6.2软件以P<0.05作为靶基因筛选条件,借助Bioconductor 功能包实现GO 和KEGG 分析;同时根据P.adjust分别绘制柱状图和气泡图。
1.7 分子对接
选取PPI 核心网络中Degree 参数大于中位数且与显著性较强的富集分析结果密切相关的重要靶点(HSP90AA1、CDK2、ESR1、MDM2)作为蛋白受体,相应的药物成分(槲皮素、熊竹素、食脂素、木犀草素)作为配体。分别应用PDB(http://www.rcsb.org/)和Pubchem数据库(https://pubchem.ncbi.nlm.nih.gov/)筛选出靶点蛋白三维结构和药物成分二维结构。运用PyMol 软件删除靶点蛋白三维结构上的水分子及小分子配体并保存为pdb 格式。运行ChemBio3D 软件将药物成分二维结构转换为三维结构并对其进行优化(选择“calcula⁃tions”-“MM2”-“Minimize Energy”-“Run”),保存为mol2 格式。应用AutoDock 软件将二者转化为PDBQT格式并确定活性口袋。最后使用Vina软件进行分子对接,利用Pymol软件将对接结果可视化。
2 结果
2.1 仙芪消渴饮活性成分收集和靶点预测结果
经筛选仙芪消渴饮各中药所含活性成分分别为山药16 个、山茱萸20 个、熟地2 个、牡丹皮11 个、茯苓15个、泽泻10 个、黄芪20 个、仙灵脾(淫羊藿)23 个、北沙参8个、甘草92个;在剔除重复项后共得到193个活性成分,按照OB 值由高至低排序后选取前20 项结果展示见表1。通过TCMSP数据库搜索后共得到潜在靶点245个,部分靶标展示见表2。

表1 仙芪消渴饮部分活性成分基本信息Table 1 Active ingredients in Xianqixiaoke Decoction

表2 仙芪消渴饮部分靶点基本信息Table 2 Targets of Xianqixiaoke Decoction
2.2 DKD相关靶点
2.2.1 基因芯片筛选结果与样本数据 研究共纳入样本69例,其中实验组(DKD 肾组织)19 例、对照组50例;源自GEO数据库DKD基因芯片(编号:GSE30122)。
2.2.2 差异基因(DEGs)序列的确定 经筛选共得到638个差异基因,将该差异基因序列确定为DKD 相关靶点,所绘制的差异热图,见图1(图中仅显示前20 位上调和下调基因)和差异火山图,见图2。

图1 差异基因热图Figure 1 Heat map of DEGs
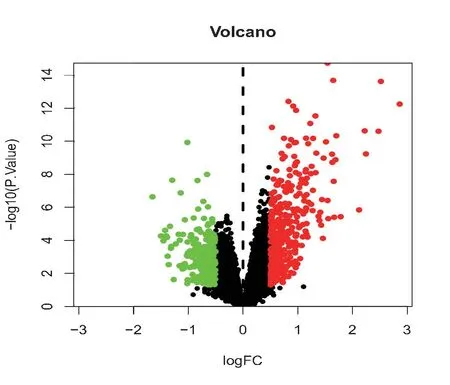
图2 差异基因火山图Figure 2 Volcano plot of DEGs
2.3 “中药复方成分-疾病-靶点网络”构建结果
仙芪消渴饮治疗DKD 的潜在作用靶点共24个,见图3。

图3 药物靶点-疾病靶点韦恩图Figure 3 Venn diagram of drug target-disease target
图4 为经Cytoscape3.7.2 软件可视化处理后的“中药复方成分-疾病-靶点网络”图,即中药复方调控网络图,它共包含124个节点、167条边:其中24个天蓝色三角形节点代表24 个靶基因;另外100 个不同颜色的节点代表来自不同中药且与靶基因相关联的活性成分,绿色代表“甘草”、黄色代表“黄芪”、粉色象征“牡丹皮”、灰色视为“山药”、紫色表示“山茱萸”、棕色视为“仙灵脾”、红色则象征多种中药共同所有;“多药共有”成分集中在槲皮素(quercetin)为甘草、仙灵脾、黄芪、牡丹皮、北沙参共有,山萘酚(kaempferol)为甘草、仙灵脾、黄芪、牡丹皮共有,芒柄花黄素(formononetin)、异鼠李素(isorhamnetin)、毛蕊异黄酮(calycosin)、熊竹素(jaranol)均为甘草、黄芪共有,常春藤甙元(heder⁃agenin)为黄芪、茯苓共有,豆甾醇(stigmasterol)为山茱萸、熟地、北沙参、茯苓共有,食脂素(DFV)为甘草、仙灵脾共有。

图4 中药复方调控网络图Figure 4 Interaction network diagram of Chinese herbal compound
2.4 靶蛋白互作网络分析
在Bisogenet 插件中导入仙芪消渴饮与DKD 共有的24个蛋白基因,初步得到一个包括1 761个节点、36 776 条边的PPI 网络;运行CytoNCA 插件先后按DC>61、BC>600 对其进行拓扑分析,分别创建出包括378个节点、13 690条边和包括44个节点、454条边的两个新的子网络,后者即PPI核心网络,见图5。

图5 PPI 网络拓扑分析Figure 5 Network topology analysis of PPI
2.5 PPI核心网络模块化分析
通过MCODE插件围绕PPI核心网络挖掘提炼出2 个关键的功能模块,见图6。

图6 PPI核心网络的2个功能模块Figure 6 Two functional modules of PPI core network
2.6 富集分析
GO分析具体结果见图7~9:功能模块1BP共涉及90 个条目,主要包括蛋白酶体介导泛素依赖的蛋白质分解代谢过程(proteasome−mediated ubiquitin−depen⁃dent protein catabolic process)、蛋白酶体蛋白质分解代谢过程(proteasomal protein catabolic process)、细胞对胞外刺激的反应(cellular response to extracellular stimu⁃lus)、有丝分裂细胞周期中的G1/S信号转换机制(G1/S transition of mitotic cell cycle)、对由IRE1介导的未折叠蛋白反应的调控(regulation of IRE1−mediated unfolded protein response);CC共涉及17个条目,主要包括COP9信号复合体(COP9 signalosome)、黑色素体(Melano⁃some)、色素粒(pigment granule)、黏附斑(focal adhe⁃sion)、细胞-基底黏着连接(cell −substrate adherens junction)、细胞-基质间连接(cell−substrate junction)、cullin-环泛素连接酶复合物(cullin−RING ubiquitin li⁃gase complex);MF 共涉及12 个条目,主要包括细胞粘附分子结合(cell adhesion molecule binding)、泛素蛋白连接酶结合(ubiquitin protein ligase binding)、泛素样蛋白连接酶结合(ubiquitin−like protein ligase binding)、参与蛋白质折叠的蛋白质结合(protein binding involved in protein folding)、错误折叠蛋白质结合(misfolded pro⁃tein binding)。

图7 GO生物过程分析(前20)Figure 7 GO biological process analysis(top 20)
功能模块2BP得到535条结果,主要包括对未折叠蛋白的反应(response to unfolded protein)、DNA 损伤检控点(DNA damage checkpoint)、DNA 完整性检控点(DNA integrity checkpoint)、细胞周期过程的负向调节(negative regulation of cell cycle process);CC 共涉及36个条目,主要包括富含纤维胶凝蛋白-1的颗粒腔(fico⁃lin−1−rich granule lumen)、分泌颗粒腔(secretory gran⁃ule lumen)、细胞质囊腔(cytoplasmic vesicle lumen)、囊泡腔(vesicle lumen);MF共涉及65个条目,主要包括无序域特异性结合(disordered domain specific binding)、泛素蛋白连接酶结合(ubiquitin protein ligase binding)、泛素样蛋白连接酶结合(ubiquitin−like protein ligase binding)。
KEGG 分析结果,见图10:功能模块1 共富集6 条通路,主要包括细胞分裂周期(Cell cycle)、泛素介导的蛋白水解作用(Ubiquitin mediated proteolysis)、PI3KAkt信号通路(PI3K−Akt signaling pathway);功能模块2共富集28 条通路,主要包括前列腺癌(Prostate can⁃cer)、内质网蛋白加工(Protein processing in endoplas⁃mic reticulum)、甲状腺激素信号通路(Thyroid hormone signaling pathway)、细胞分裂周期(Cell cycle)、PI3KAkt信号通路(PI3K−Akt signaling pathway)。

图8 GO细胞组分析(前20)Figure 8 GO cellular component analysis(top 20)
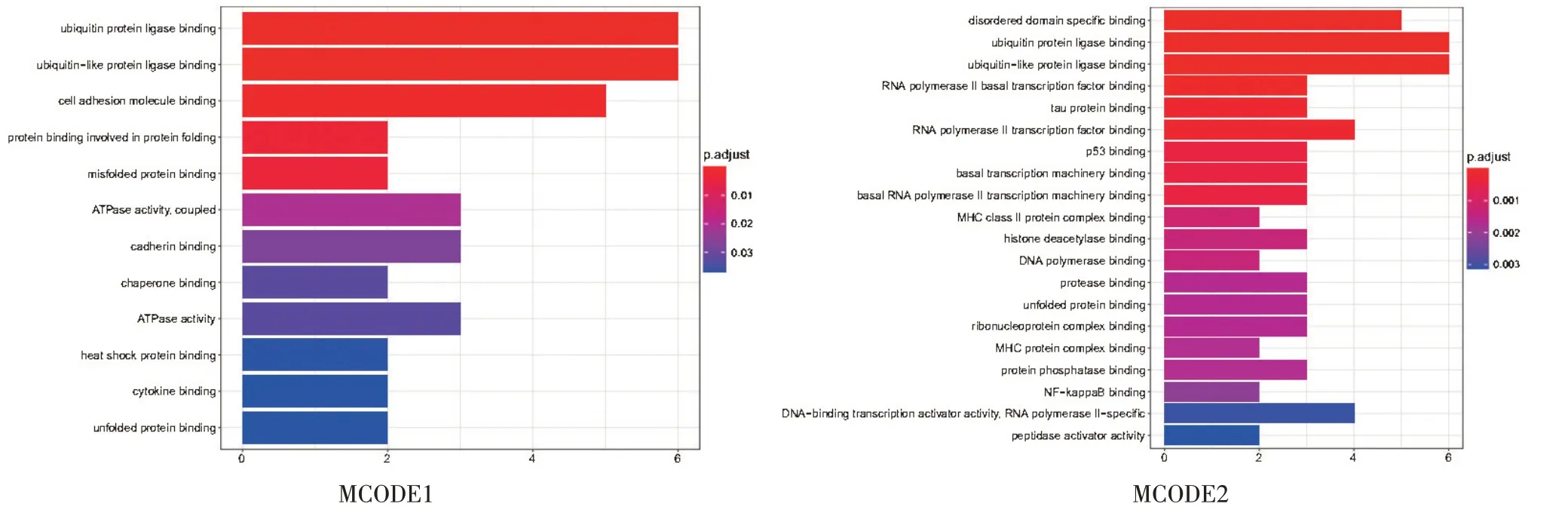
图9 GO分子功能分析(前20)Figure 9 GO molecular function analysis(top 20)

图10 KEGG分析(前20)Figure 10 KEGG analysis(top 20)
2.7 分子对接验证
如表3 所示,仙芪消渴饮药效分子与蛋白靶标(HSP90AA1、CDK2、ESR1、MDM2)的最低结合能均小于0,说明配体与受体均可以自发结合、形成最佳复合体。仙芪消渴饮可通过调节以上靶标发挥治疗作用。分子对接模式,见图11。

图11 仙芪消渴饮分子对接模式图Figure 11 Molecular docking diagram of Xianqixiaoke Decoction

表3 仙芪消渴饮有效成分分子对接结果Table 3 Molecular docking results of active ingredients of Xianqixiaoke Decoction
3 讨论
仙芪消渴饮共涉及193 个活性成分、24 个关键靶点。对从PPI 核心网络中挖掘出的2 个模块进行富集分析剔除重复项后发现:GO 分析共得到588 个生物学过程、47 个细胞组分、72 个分子功能;KEGG 分析共富集30 条通路。由此可见,仙芪消渴饮通过多成分、多靶点、多通路对糖尿病肾脏病进行干预。
从中药复方调控网络可以看出,仙芪消渴饮中与作用靶点密切相关的核心药物为甘草、仙灵脾、黄芪、山药。据文献报道甘草及其有效成分可对糖尿病肾脏病起到一定防治作用:甘草的醇和水提取物都能对抗高糖刺激所诱导的肾小球系膜细胞过度增殖并易化肾小球系膜细胞基质降解[8];甘草酸不仅能抑制氧化应激、减少肾脏细胞凋亡,还可通过调控转化因子-β1/Smads 信号通路抑制高糖诱导的细胞外基质蛋白在肾小球和肾小管间质中的过度沉积,延缓DKD 进展[9-10];而甘草次酸在降低血糖、血脂、改善肾功能的同时下调肾组织层黏连蛋白、α-平滑肌蛋白的表达从而改善系膜区纤维化及肾小管萎缩[11]。仙灵脾及其有效成分可通过上调内皮NO合成酶发挥松弛血管、抑制血小板聚集和在一定程度上遏止血管平滑肌细胞过度增殖的作用[12],还能明显改善慢性肾功能不全的症状与相关生化指标,其作用机制可能为①通过上调肾组织中超氧化物歧化酶、谷胱甘肽过氧化物酶水平,下调丙二醛水平,减轻氧化应激损伤;②通过下调白介素1β、白介素6及单核细胞趋化蛋白-1水平,下调炎症反应水平;③通过下调转化生长因子β、血管内皮生长因子、磷酸化p65 表达,阻止肾组织纤维化;④下调caspase-3 表达,抑制肾组织细胞凋亡[13]。目前已证实黄芪有利于糖尿病病人糖原合成、改善胰岛素抵抗,使机体血糖维持稳定;在此基础上,杨丽等[14]研究发现黄芪可改善肾组织免受过度表达的内皮素-1 和转化生长因子β1 的破坏作用,从而抑制肾小球硬化及基质堆积;宋恩峰等[15]研究发现黄芪能抑制2型糖尿病肾病大鼠的肾脏肥大及肾脏局部肿瘤坏死因子-α和血管内皮生长因子表达,从而减少蛋白尿。山药及其有效成分不仅增加胰岛素分泌、改善受损胰岛β细胞功能,还对肾功能有一定保护作用,其机制可能与抑制高糖激活的醛糖还原酶/P38丝裂原活化蛋白激酶/环磷腺苷效应元件结合蛋白信号通路有关[16]。
磷脂酰肌醇3 激酶/蛋白激酶B(Phosphoinositide 3 Kinese/Protein KinaseB,PI3K/AKT)信号通路参与调控细胞的生长、增殖、凋亡、分化[17]。PI3K 被激活后转变成第二信使磷脂酰肌醇-3,4,5-三磷酸(PIP3),PIP3进而将AKT 活化为磷酸化AKT(p-AKT),p-AKT 可通过阻断促凋亡分子Bad 与Bcl-2/Bcl-xL 结合而抑制细胞凋亡[18]。研究表明在糖尿病肾病进程中,通过调节PI3K/Akt 通路活性,不仅能够改善肾脏足细胞表型、减轻足细胞损伤,还能在一定程度上抑制系膜细胞增生,[19]。
研究证实,亚临床甲状腺功能减退是糖尿病肾病的独立危险因素[20]。伴有亚临床甲状腺功能减退的老年糖尿病病人糖尿病肾病发生率更高,并与促甲状腺素水平呈正相关;适度补充左旋甲状腺素片,可减少蛋白尿,让糖尿病肾病进程减缓。[21]
泛素-蛋白酶体系统(ubiquitin-proteasome-system,UPS)是一种能量依赖性、高度选择性地调控蛋白质降解的重要系统[22],又称泛素蛋白酶体通路。研究发现丝裂原活化蛋白激酶磷酸酶-1泛素化降解增加可使丝裂原活化蛋白激酶通路脱磷酸化减少、磷酸化增强,导致该通路持续活化、肾脏损伤加重,由此提示UPS参与了糖尿病肾病的发生[23]。
在GO 功能分析结果中,“IRE1介导的未折叠蛋白反应的调节”“对未折叠蛋白的反应”等条目均与内质网应激(endoplasmic reticulum stress,ERS)密切相关。内质网是细胞内的重要细胞器,参与各种蛋白的加工合成。在高血糖、氧化应激、脂质代谢障碍状态下未折叠蛋白增多,当超过内质网的处理能力时导致ERS 从而诱发未折叠蛋白反应[24]。IRE1为内质网Ⅰ型跨膜蛋白,ERS发生时IRE1α磷酸化,一方面通过激活转录因子XBP-1S,诱导内质网分子伴侣GRP78/CHOP 的表达,增加蛋白质的折叠能力,恢复内质网正常功能,促进细胞生存;另一方面,持续的ERS可启动IRE1α-JNK通路介导细胞凋亡[25-26]。此外,相关研究表明与靶蛋白相结合的可能药效分子槲皮素、熊竹素、食脂素、木犀草素均具有一定肾脏保护作用。槲皮素不仅能调节血糖还可减轻肾小球足细胞损伤[27];而其通过抑制高糖引起的氧化应激来保护肾单位的机制与木犀草素有异曲同工之妙[28-29]。熊竹素作用于细胞周期蛋白依赖性激酶2(CDK2),CDK2表达异常与肾小球系膜细胞增殖、肾小球硬化有关[30]。食脂素可与雌激素受体(ESR1)结合,借助激素发挥调节肾素-血管紧张素系统、改善肾脏缺血状态、减轻炎性反应、抗凋亡、维持线粒体稳态等功效[31]。
4 结论
本研究解析了仙芪消渴饮治疗糖尿病肾脏病是通过多成分、多靶点、多通路起效的可能作用机制,认为其核心药效团主要通过泛素-蛋白酶体系统、内质网应激、PI3K-Akt信号通路、甲状腺激素信号通路等途径发挥肾脏保护作用,进而为提高临床疗效及经典名方再开发提供了循证医学支撑。
(利益冲突:无)

