神经生长因子对小鼠颌骨骨髓间充质干细胞增殖及成骨分化的影响*
王雅迪 张鹤扬 秦巧臻 黑俊皓 江小霞 刘一涵 贺慧霞
颌骨骨髓间充质干细胞(jaw bone marrow mesenchymal stem cells,JBMMSCs)是从颌骨中分离得到的具有高度增殖、迁移活性及分化潜能的一类成体干细胞。JBMMSCs起源于外胚层,在颌面部胚胎发育期由颅神经嵴(CNC)细胞从神经管迁移到颅骨前区,形成面部和前颅骨的一些骨骼和软骨[1,2]。JBMMSCs可在一定诱导条件下向成骨细胞(通过膜内成骨直接形成骨)、脂肪细胞、软骨细胞(通过软骨内成骨形成骨和软骨)、神经细胞等分化[3-5]。有研究表明[6,7],JBMMSCs在增殖及成骨分化方面的能力明显优于BMSCs(bone mesenchymal stem cells,BMSCs),且具有临床上易得、与颌骨同源等优势,成为目前修复颌骨缺损领域研究的热点。
另一方面,颌骨缺损常由颌面部创伤、肿瘤、感染等引起,而这些因素都会极大的损伤颌骨周围神经,骨损伤导致的神经纤维损伤后,其周围骨组织的自然愈合及骨形成的时间会明显延长,这表明,神经系统与骨组织代谢密切相关[8]。神经生长因子(nerve growth factor,NGF)是神经营养因子中的一类,它能使中枢神经元和外周神经元加速生长、促进发育,修复损伤的神经系统。同时,在骨代谢、成骨分化中有促进作用[9-11]。近年来,有研究证实NGF 能促进中胚层来源的长骨骨髓间充质干细胞的成骨分化及骨形成,但未见NGF 对外胚层来源的JBMMSCs 功能的影响研究。因此,本文拟探讨NGF对JBMMSCs增殖及成骨分化作用的影响,为其用于颌骨骨缺损的修复与再生筛选合适的作用浓度,为其临床应用提供一定的理论基础。
1.材料和方法
1.1 实验材料
1.1.1 主要试剂 α-MEM 培养基(gibco,Ameican),胎牛血清(Excell,China),胰蛋白酶(BioFrox,American),地塞米松、抗坏血酸C、β-甘油酸钠、NGF(Peportech,American),FITC标记 的抗体CD45,APC 标记的 抗体CD29、90,CCK-8 试剂盒(Sigma,American),碱性磷酸酶(ALP)检测试剂盒(Sigma,American)、反转录试剂盒(TOYOBO,American)、qRT-PCR 试剂(上海生工生物,中国)、RIPA 裂解液(Solarbio,China)、BCA 蛋白定量试剂盒(上海贝博生物科技公司,China),OPN、RUNX2、MCM-2、Ki67 抗体(Abcam,American)。
1.1.2 仪器 细胞培养箱(Thermo,American),离心机(Thermo,American),流式细胞仪(BD,American),倒置显微镜(Olympus,American),FTC-3000P 实时荧光定量 PCR 仪(Funglyn Biotech Inc,American),酶标仪(Thermo,American),凝胶成像系统(Bio-rad,American)。
1.2 方法
1.2.1 JBMMSCs 的提取及鉴定 将新生BL3C57 小鼠处死后,于75%的乙醇浸泡5 min,无菌条件下取下颌骨,剪为约1 mm3大小的组织块;收集后加入胰酶消化约20 min,弃胰酶,加入α-MEM 培养基,于37℃、5%CO2、100%饱和湿度培养箱培养。48 h 后半量换液,72 h 后完全更换培养基,以后每3 d 换1次,细胞80%~90%融合消化、传代。本研究经中国人民解放军军事医学研究院实验动物管理与使用委员会批准(IACUC-DWZX-2021-759)。
1.2.2 JBMMSCs的鉴定 取P2代对数期生长的JBMMSCs(下同),胰酶消化后收集,用α-MEM培养基重悬并调整细胞密度至1×105/ml,使用FITC标记的抗体CD45、APC标记的抗体CD29、CD90的单克隆抗体于4℃冰箱内避光孵育30~40 min,用PBS洗涤3遍后进行流式细胞术分析。
1.2.3 分组及处理 根据NGF 浓度设为四组,处理方法如下:0 ng/ml NGF组、10 ng/ml NGF组、50 ng/ml NGF组、100 ng/ml NGF组[20-22]。分别以含有上述浓度NGF 的培养基进行培养JBMMSCs,每3 d换液1次。
1.2.4 CCK-8 检测增殖 取JBMMSCs 以每孔4×103个细胞的密度接种于96 孔板中,24 h 后更换为含不同浓度NGF(0、10、50、100 ng/ml)的完全培养基。分别在第0、1、3、5、7 d 时,每孔加入10 μl CCK-8 溶液,继续孵育2 h,使用酶标仪检测450 nm波长处各孔A值。
1.2.5 碱性磷酸酶染色(ALP)取JBMMSCs以每孔3×104个细胞的密度接种于24 孔板中,24h后更换为含不同浓度NGF(0、10、50、100ng/ml)的完全培养基,每3d换液1次,诱导7d后,PBS洗涤3次,4%多聚甲醛溶液固定30-60min,根据ALP试剂盒说明配置染液,室温避光孵育4h后,PBS 洗涤3次,使用BIX 显微镜观察。Image J软件分析各组ALP染色的光密度。
1.2.6 qRT-PCR基因表达检测 取JBMMSCs以3×105个/孔的密度接种于六孔板中,以上述分组进行培养3 d后[23],根据说明书使用总RNA 提取试剂盒提取细胞总RNA,分光光度计检测mRNA浓度及纯度。然后使用Hifair® Ⅱ1st Strand cDNA Synthesis SuperMix for qPCR (gDNA digester plus)试剂盒去除基因组DNA并反转录1μgmRNA。在NCBI上查找ALP、OPN、RUNX2、BMP2、Ki67、MCM-2及内参GAPDH的mRNA序列,Primer 5软件设计引物,引物序列见(表1),由生工生物工程股份有限公司合成,使用Hieff® qPCR SYBR Green Master Mix进行qPCR,每个反应使用同一cDNA 样品进行3次重复。扩增程序为:预变性95℃5 min,1个循环;变性95℃10 s,退火/延伸60℃30 s,40个循环。采用2-ΔΔCt方法计算目标基因相对于内参基因GAPDH表达量。

表1 增殖及成骨相关基因引物序列
1.2.7 Western blot 蛋白表达检测 取JBMMSCs 以3×105个/孔的密度接种于六孔板中,以上述分组培养3 d 后用RIPA 裂解液裂解细胞并提蛋白,BCA 法测蛋白浓度后,与loading buffer 混合为20 μg 蛋白样本,100℃煮沸后,加入SDS-PAGE 进行电泳,随后电转移至PVDF 膜,5%脱脂牛奶室温封闭PVDF 膜1 h,OPN、Ki67、RUNX2、MCM-2(1∶1000)一抗于4℃孵育过夜;次日,1×TBST 洗PVDF 膜3 遍,每遍5 min 后室温孵育1∶2000 稀释的二抗1 h,再次洗PVDF 膜3遍,每遍10 min,在凝胶成像系统中显影得到蛋白条带,根据灰度值分析蛋白表达量。
1.3 统计学方法 采用SPSS 18.0 统计软件进行数据分析,计量资料以均数±标准误(Mean±SEM)表示,多组间比较用方差分析,若方差齐则两两比较用t 检验,P<0.05 为组间差异有统计学意义。
2.结果
2.1 JBMMSCs 形态学观察 原代培养的JBMMSCs 4 h贴壁,6 h细胞伸展呈纺锤状、短梭形或多角形,细胞集落融合成片,呈玫瑰花状生长。3~4 d 汇合达90%进行消化、传代。传代后的细胞增殖速度明显减慢,但细胞体积略变大,形态较为均一,胞浆丰富,紧贴于皿底(图1)。
图1 倒置相差显微镜下观察JBMMSCs形态
2.2 JBMMSCs 流式表型分析 流式细胞术检测结果:JBMMSCs 表面相对特异性标志物:CD29(99.6%)、CD90(79%)阳性表达,CD45(0.1%)阴性表达。表明本实验所用的JBMMSCs 与骨髓来源间充质干细胞具有相似表型(图2)。
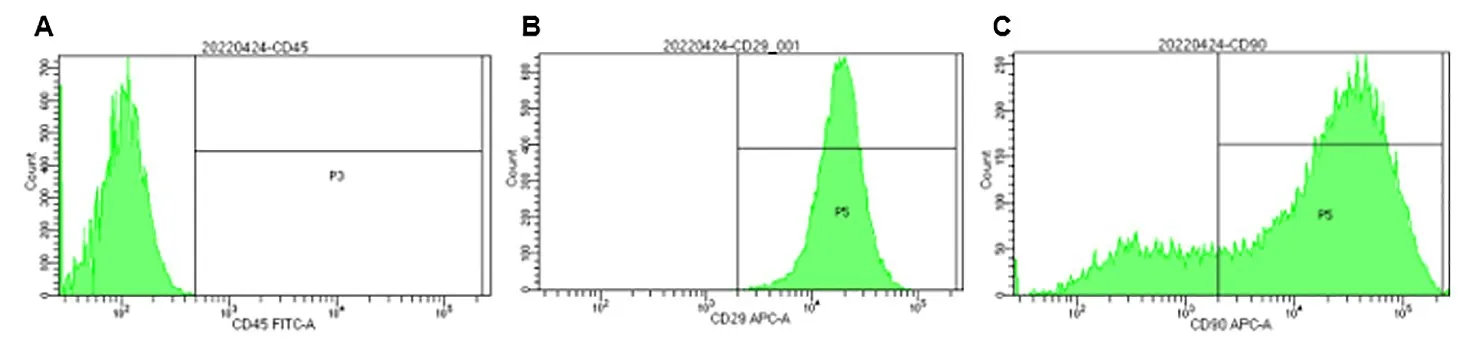
图2 流式细胞仪检测JBMMSCs的表型
2.3 CCK-8 细胞增殖检测 不同浓度NGF 刺激JBMMSCs 后CCK-8 检测结果表明:随着培养时间延长,各组细胞增殖明显增加。与对照组比较,第3 d 时100 ng/ml组细胞呈现增殖趋势;第5 d时50 ng/ml、100 ng/ml组细胞增殖显著(P<0.05,P<0.0001),第7 d各组均较对照组细胞增殖速度显著增加,其中50 ng/ml、100 ng/ml组JBMMSCs细胞活力均高度显著增加(P<0.001)。以上结果可表明,NGF可促进JBMMSCs增殖,其促进作用具有NGF浓度和时间依赖性(图3)。

图3 不同浓度的NGF对JBMMSCs增殖能力的影响(*P<0.05,***P<0.001,****P<0.0001,Mean±SEM,n=6)
2.4 ALP活性检测 成骨诱导培养至第7 d,ALP染色胞浆呈现蓝紫色,随着NGF浓度增加,细胞增多,胞浆染色加深。当NGF在浓度大于50 ng/ml时,细胞呈团块状,胞浆染色呈深紫蓝色,表明ALP活性明显增强。图像灰度半定量分析结果显示50 ng/ml、100 ng/ml组ALP 活性显 著高 于0 ng/ml组及10 ng/ml组(P<0.05)(图4)。

图4 不同浓度NGF对JBMMSCs ALP染色结果的影响
2.5 Real-timePCR 增殖及成骨相关基因检测 不同浓度的NGF 处理JBMMSCs 3 d,可见与0 ng/ml组比较,各组ALP、OPN、BMP2、RUNX2的表达量均显著升高(P<0.05),其中50ng组、100ng组更显著(P<0.0001)。此外,Ki67、MCM-2 的表达量随着浓度的升高而升高,而100 ng/ml NGF 时表达量却呈明显下降趋势(P<0.05)(图5)。
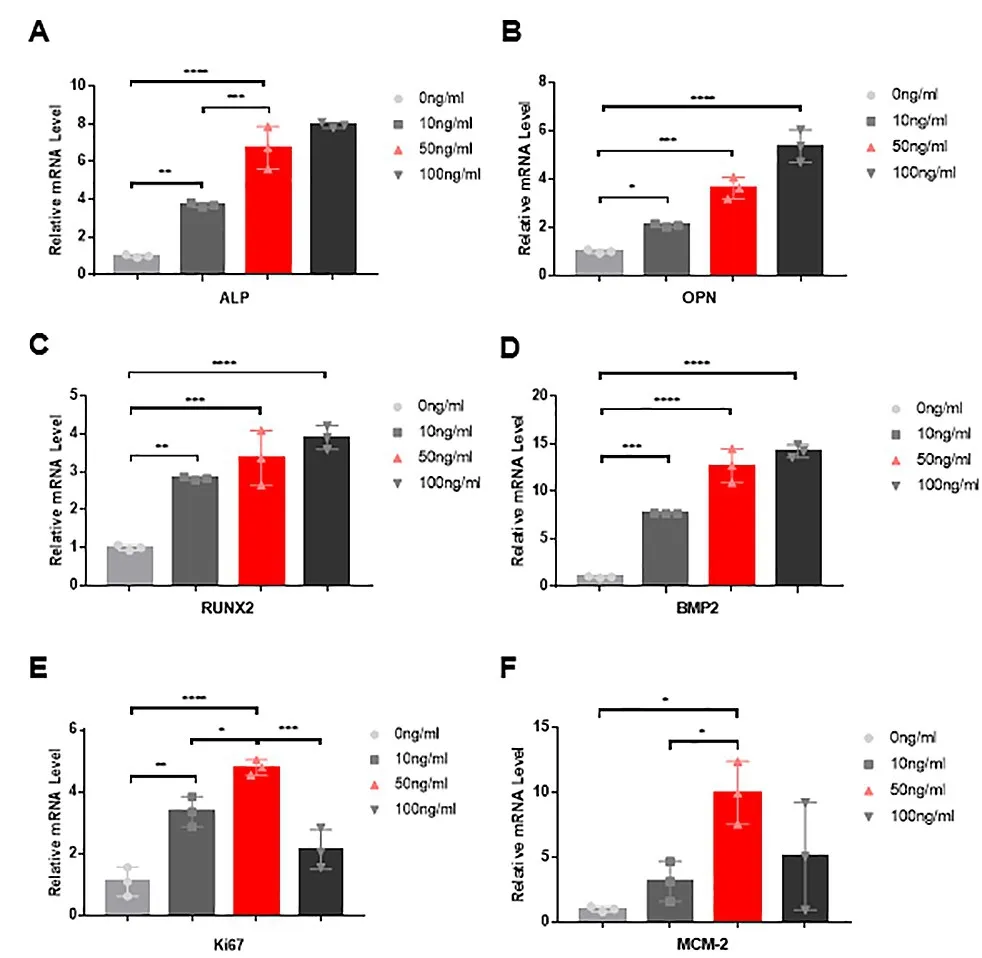
图5 qRT‑PCR检测不同浓度NGF对JBMMSCs成骨及增殖相关基因表达的影响(A‑F)随着NGF浓度的增加,ALP、OPN、RUNX2、BMP2的mRNA表达量也随之增加;Ki67、MCM‑2在NGF 50 ng/ml时表达量达到最高,100 ng/ml NGF时表达量却呈下降趋势(*P<0.05,**P<0.01,***P<0.001,****P<0.0001,Mean±SEM,n=3)
2.6 Western blot 检测增殖及成骨相关蛋白表达 NGF 处理JBMMSCs 3 d,WB 结果显示:OPN、Ki67、MCM-2 表达随着NGF 浓度升高而升高(P<0.05),而RUNX2 在低浓度时mRNA 表达呈浓度依赖性,而在100 ng/ml高浓度时呈下降趋势(P<0.001)(图6)。

图6 WB检测不同浓度NGF对JBMMSCs增殖及成骨相关蛋白表达
3.讨论
提高下颌骨缺损修复效果、减少其延迟愈合或不愈合,始终是口腔临床医学中亟待解决的重要课题。近来,越来越多的研究表明骨骼感觉神经在骨骼损伤修复过程中发挥重要的作用,NGF 也因此受到越来越多的关注。NGF 作为最早发现的细胞生长调节因子,具有营养神经元和促进突起生长的双重生物学功能[9],此外,NGF 还可通过其高亲和力的受体原肌球蛋白受体激酶A (TrkA)诱导骨骼神经再生,进而对骨修复后期的发生的血运重建和骨基质沉积发挥促进作用[8,12,13]。Grills[14]等人在肋骨骨折的大鼠模型中首次发现,在骨折断端处的骨膜祖细胞、成熟或不成熟的骨细胞、部分软骨细胞中均有NGF 的出现,以旁分泌和自分泌的形式作用于骨折端的成骨细胞。Li Z[11]等人的研究发现,在骨折小鼠的组织学切片中显示骨膜基质祖细胞和骨折相关的巨噬细胞中NGF 的表达显著上调,且反应性骨膜中富含NGF的CGRP+TrkA+的感觉神经纤维活化明显;通过注射TrkA 抑制剂1NMPP1抑制其活性,可发现感觉神经纤维数量的减少,更重要的是骨折处血运重建减缓,骨折处组织愈合显著延迟,这说明NGF可能通过TrkA 调控骨组织修复。同样的,Asaumi[15]等人在大鼠股骨骨折模型中发现,NGF、脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)和神经营养因子-3(neurotrophins-3)的mRNA 表达水平在骨折修复过程中增加,且在骨折发生的第二天其NGF 的值达到顶峰,明确了NGF 在骨损伤修复中的重要促进作用。新出现的证据表明[9,13],NGF 除了可诱导神经生长并促进其存活,NGF 还可与其低亲和力受体P75 结合,促进细胞向骨组织受损处迁移,促进骨愈合。综上所述,NGF 不仅能够在周围神经损伤时发挥维持、保护及再生的作用,同时能够促进细胞向骨组织损伤处迁移,上调成骨基因表达,并加快损伤周围的骨组织愈合速度。但这些研究多集中在股骨、肋骨等骨组织,而NGF对颌骨损伤修复的作用尚未见报道。
颅颌面骨是由外胚层的神经嵴细胞发育而来,其骨形成的方式为膜内成骨,不同于由中胚层的间叶细胞发育而来的长骨—软骨成骨[1,2]。哺乳动物颅面骨的修复及再生需要多种类型的细胞和外在诱导因子的共同作用,与躯干骨不同,颌骨的发育形成和愈合不需要软骨作为基础,而是由间充质祖细胞凝聚而成[11,12,16]。JBMMSCs 作为颌骨组织中骨形成的关键细胞,具有明确的定向成骨分化能力。近年来,越来越多的学者发现JBMMSCs 的成骨分化能力要明显优于BMSCs。Aghaloo 等人[6]对原代颌骨与长骨骨髓间充质干细胞进行比较研究,通过qRT-PCR 发现:JBMMSCs 中碱性磷酸酶活性、成骨细胞矿化等基因表达量明显高于BMSCs。更重要的是,植入裸鼠后,颌骨骨髓间充质干细胞形成的钙结节较长骨骨髓间充质干细胞所形成的钙结节大70%,骨矿化程度是长骨骨髓间充质干细胞的3 倍。本实验与之相似,Brandon 等人[7]比较了猪颌骨与长骨骨髓间充质干细胞的体外增殖、成骨分化特性和基因表达的不同。结果显示JBMMSCs 的增殖和成骨分化能力明显强于BMSCs,此外,通过微阵列分析发现404个高丰度的基因,其中334个基因与成骨和成血管相关,48个基因的差异表达至少升高1.5 倍,颅神经嵴相关基因BMP44 在颌骨髓间充质干细胞中高表达。本课题前期实验初步证实JBMMSCs 具有自我增殖、更新及多向分化能力,可作为种子细胞适用于同源性骨缺损的修复与再生。然而,单纯JBMMSCs 的成骨分化能力依旧较差[17]。因此,研究外胚层细胞来源的NGF 对同样来源于外胚层的JBMMSCs 增殖及成骨分化能力的影响,以及可能的理论机制,对提高JBMMSCs 的成骨分化及增殖效率,进而修复颌骨缺损具有重要意义。
NGF的浓度对其作用效果有重要影响。崔国胜[18]等人研究NGF对大鼠骨髓基质细胞成骨分化的影响,选用100 ng/ml NGF为终浓度进行实验,结果表明:NGF可能通过TrkA受体,在一定程度上促进大鼠骨髓基质细胞向成骨细胞分化、增强其矿化能力,且此促进作用可以被TrkA受体抑制剂K252a阻断。此外,汪琼等人[19]研究了NGF对脂多糖诱导的成骨细胞炎症反应的影响,选用100 ng/ml NGF对成骨细胞进行刺激,发现:高中剂量的NGF可显著抑制LPS诱导的成骨细胞一氧化氮的释放,该浓度下细胞活力不受影响。本实验对比研究了不同浓度NGF 对JBMMSCs的作用,结果发现,一定浓度的NGF能够有效的提高JBMMSCs的增殖及成骨分化能力,但不同浓度NGF作用不尽相同。50 ng/ml NGF能有效提高JBMMSCs的增殖能力且其增殖能力随NGF浓度的增加而提高,同时Ki67、MCM-2等基因及蛋白的表达在一定浓度范围内也随浓度增加而增加,但100 ng/ml NGF时,Ki67、MCM-2的表达却呈下降趋势。不同浓度NGF对JBMMSCs分化的影响也呈现此特点。JBMMSCs 表达ALP、OPN、RUNX2、BMP2等成骨相关基因,而且随着NGF剂量的加大,ALP、OPN、RUNX2、BMP2的基因及蛋白表达也随之升高,但在100 ng/ml时,这些基因及蛋白表达却下降。这表明:NGF在一定浓度范围内呈现浓度依赖性,浓度过高作用反而下降。本实验浓度筛选结果表明:50 ng/ml NGF刺激能有效提高外胚层来源的JBMMSCs 增殖及成骨分化能力,该浓度为应用JBMMSCs 修复骨缺损、促进骨再生的最佳浓度。50 ng/ml NGF的刺激与正常干细胞最为接近,可模拟最佳的体内修复环境。可见,给予不同浓度NGF对应用JBMMSCs治疗颌骨缺损等疾病具有重要意义。
综上所述:本研究检测了不同浓度NGF 对小鼠JBMMSCs 增殖及成骨分化的影响,为NGF 应用于颌骨缺损、骨代谢性疾病所致的骨质不佳、骨量不足进行骨修复和再生治疗提供一定的理论和实验依据。也为进一步研究神经刺激在颌骨修复再生中的作用奠定基础。

