促炎症消退介质Maresin1对高糖环境下肾小球系膜细胞纤维化的干预作用观察
唐诗,万明,高原
成都医学院第二附属医院核工业四一六医院内分泌科,成都 610051
糖尿病肾病(DN)突出病理表现为肾小球系膜病变,细胞外基质合成增多,最终导致肾小球硬化和间质纤维化[1]。持续高血糖作用会使肾小球内葡萄糖浓度增高,导致DN进展。葡萄糖转运蛋白1(GluT-1)作为调节葡萄糖进入肾脏细胞的主要载体,可调节葡萄糖浓度并激活下游细胞因子及信号转导通路[2]。转化生长因子β1(TGF-β1)与肾小球硬化及肾小管间质纤维化有关[3]。现已证实,持续葡萄糖作用可促使肾小球系膜细胞(MC)中TGF-β1表达升高,TGF-β1通过激活多种细胞内信号通路,导致GluT-1过表达,造成MC对葡萄糖摄取增加,最终导致纤连蛋白(FN)、Ⅳ型胶原等多种细胞外基质成分累积[4-5]。研究表明,氟伐他汀干预可抑制高糖引起的MC中GluT-1过表达、减少TGF-β1的合成,从而抑制细胞外基质积聚,延缓DN进展[6]。Maresin1是促炎症消退介质中的一种[7-8],有着强大的抗炎效果[9-10]。有研究发现,Maresin1可通过抑制TGF-β1诱导上皮—间充质转化,减少FN的合成与表达,从而延缓肺纤维化进展[11]。2021年8月—2022年3月,本研究观察了Maresin1对高糖环境下小鼠MC纤维化的干预作用,探索Maresin1能否通过抑制肾小球系膜细胞早期纤维化而延缓小鼠DN进展。现报告如下。
1 材料与方法
1.1 细胞与主要实验材料小鼠肾小球系膜细胞株(中国科学院),Maresin1(美国Cayman Chemical公司),TGF-β1、GluT-1、β-actin引物(上海生工生物工程有限公司),琼脂糖(西班牙Biowest公司),胎牛血清(澳大利亚Bovogen公司);小鼠FN、Ⅳ型胶原ELISA检测试剂盒(北京诚林生物科技有限公司),总RNA提取试剂盒(北京天根生化公司),逆转录试剂盒、扩增试剂盒(日本Toyobo公司),低糖DMEM培养基(美国Hyclone公司)。
1.2 细胞分组与干预方法体外培养小鼠MC,将细胞分为NC组、OP组、HG组、M1+HG组、M2+HG组、M3+HG组、M2+NC组。NC组、OP组、M2+NC组培养于含5.6 mmol/L葡萄糖及10%胎牛血清的低糖DMEM培养基中,OP组在培养基中加入24.4 mmol/L的甘露醇,M2+NC组以10 nmol/L的Maresin1预处理30 min。HG组、M1+HG组、M2+HG组、M3+HG组培养于含30 mmol/L葡萄糖及10%胎牛血清的高糖DMEM培养基中,M1+HG组、M2+HG组、M3+HG组分别给予1、10、100 nmol/L的Maresin1预处理30 min[12]。各组均置于37℃、5%CO2培养箱中培养。根据前期实验结果,高糖环境下,MC中TGF-β1、GluT-1 mRNA及FN、Ⅳ型胶原表达于培养48 h达峰值,培养72 h仍保持高表达,故选择培养48 h后、待细胞生长密度达80%~90%时进行后续检测。
1.3 细胞中TGF-β1、GluT-1 mRNA检测采用RTPCR法。取各组细胞,抽提总RNA,逆转录为cDNA,分别扩增产物。TGF-β1基因上游引物序列为5'-AGACAGCCACTCAGGCGTAT-3',下游引物序列为5'-CTGTCCAAACTAAGGCTCGC-3';GluT-1基 因上游引物序列为5'-AGATGATGCGGGAGAAGAAG-3',下游引物序列为5'-CACACAGTTGCTCCACATATTG-3';内参β-actin上游引物序列为5'-ACCTCTATGCCAACACAGTG-3',下游引物序列为5'-GGACTCATCGTACTCCTGCT-3'。TGF-β1、GluT-1、β-actin降火温度分别为59.8、54.0、54.0℃,热循环30次,具体步骤参照文献[13]。PCR产物于2%琼脂糖凝脂电泳,紫外灯下用凝胶成像系统成像。用Quantity One软件分析各条带灰度值,以目的基因与内参灰度值的比值表示目的基因相对表达量。
1.4 细胞上清液中FN、Ⅳ型胶原检测收集各组上清液,采用ELISA法检测FN、Ⅳ型胶原,具体步骤参照文献[14]。根据标准品的浓度及对应的光密度值计算出标准曲线的直线回归方程,再根据样品光密度值在回归方程上计算出对应的样品浓度。
1.5 统计学方法采用SPSS20.0统计软件。符合正态分布的计量资料以±s表示,多组间比较采用单因素方差分析,两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
HG组细胞中G1uT-1、TGF-β1mRNA表达及上清液FN、Ⅳ型胶原水平高于NC组、OP组、M2+NC组(P均<0.05);M1+HG组、M2+HG组、M3+HG组细胞中G1uT-1、TGF-β1mRNA表达及上清液FN、Ⅳ型胶原水平低于HG组,且M1+HG组、M2+HG组、M3+HG组呈递减趋势(P均<0.05)。见表1。
表1 各组细胞TGF-β1、GluT-1 mRNA表达及上清液FN、Ⅳ型胶原水平比较(±s)
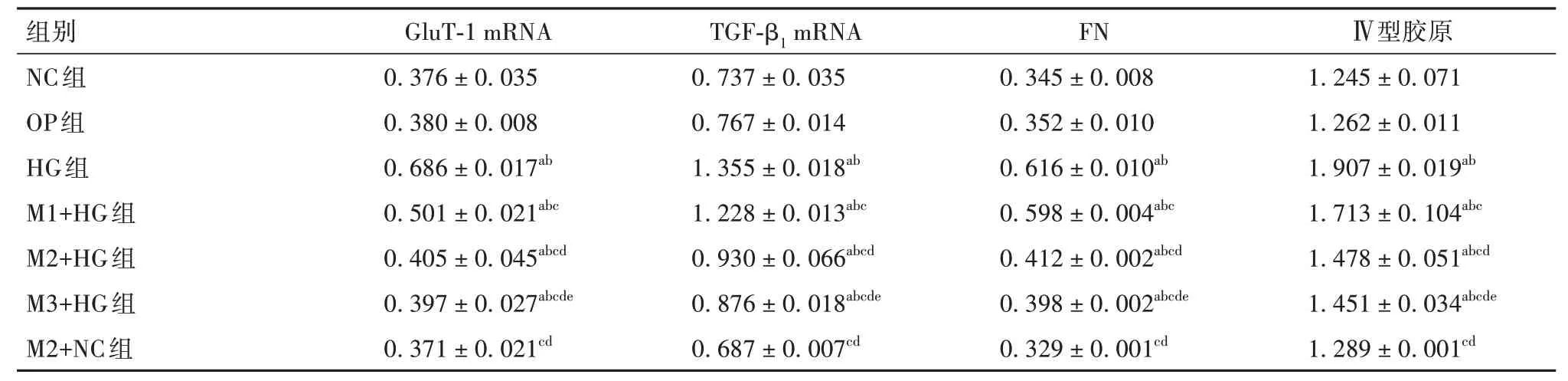
表1 各组细胞TGF-β1、GluT-1 mRNA表达及上清液FN、Ⅳ型胶原水平比较(±s)
注:与NC组相比,aP<0.05;与OP组相比,bP<0.05;与HG组相比,cP<0.05;与M1+HG组相比,dP<0.05;与M2+HG组相比,eP<0.05。
组别NC组OP组HG组M1+HG组M2+HG组M3+HG组M2+NC组GluT-1 mRNA 0.376±0.035 0.380±0.008 0.686±0.017ab 0.501±0.021abc 0.405±0.045abcd 0.397±0.027abcde 0.371±0.021cd TGF-β1 mRNA 0.737±0.035 0.767±0.014 1.355±0.018ab 1.228±0.013abc 0.930±0.066abcd 0.876±0.018abcde 0.687±0.007cd FN 0.345±0.008 0.352±0.010 0.616±0.010ab 0.598±0.004abc 0.412±0.002abcd 0.398±0.002abcde 0.329±0.001cdⅣ型胶原1.245±0.071 1.262±0.011 1.907±0.019ab 1.713±0.104abc 1.478±0.051abcd 1.451±0.034abcde 1.289±0.001cd
3 讨论
持续高血糖作用可引起肾小球系膜细胞外基质堆积、成纤维细胞和肾小球纤维蛋白合成增加、肾小球硬化及肾小管间质纤维化,最终导致DN的发生[15]。DN有效治疗措施较少,最终只能以肾移植和透析治疗维持患者生命[16],如何有效延缓或抑制DN的发生发展是当前研究的热点与难点。肾组织纤维化是DN重要的病理生理基础,若能拮抗肾早期纤维化则可明显延缓肾脏损伤的进程[17]。
GluT负责将葡萄糖由细胞外扩散至细胞内,对细胞新陈代谢起着重要作用。研究表明,肾脏组织内分布GluT-1~5,MC及其基质内的GluT主要以GluT-1为主,GluT-1可调节MC葡萄糖浓度,并进一步激活下游的细胞因子及信号转导通路,从而参与DN的进展[18]。研究发现,DN患者肾小球GluT-1表达明显增高,部分血糖控制良好的患者也有GluT-1过表达[19]。有学者将过表达GluT-1载体转染血糖正常的小鼠,小鼠最终进展为DN,提示在DN的发生发展中,GluT-1可能还存在独立于高血糖之外的致病作用[20]。TGF-β1在MC合成及分泌细胞外基质的过程中发挥重要作用。细胞外持续性高糖刺激可作为促纤维化因素作用于MC,促进TGF-β1的合成与分泌;TGF-β1过表达能通过激活蛋白激酶等细胞信号通路因子和多种细胞因子促使细胞外基质沉积,导致糖尿病肾纤维化的发生和发展[21-22]。研究发现,在DN的病程中,GluT-1和TGF-β1可相互作用,形成恶性循环:持续的高糖作用促使TGF-β1表达增加,而升高的TGF-β1可通过丝裂原活化蛋白激酶信号通路诱导GluT-1过表达[23],导致肾脏细胞葡萄糖摄取增加和利用方式改变,进而通过蛋白激酶C及多元醇通路促进TGF-β1的表达及活化[24],导致系膜基质大量代谢产物如FN、Ⅳ型胶原等沉积,最终导致DN恶化。本研究前期实验发现,高糖作用下小鼠MC中TGF-β1、GluT-1 mRNA表达呈时间依赖性增加,并于48 h达峰值,同时细胞上清液中FN、Ⅳ型胶原水平均升高。但TGF-β1与GluT-1相互作用具体机制及相关信号通路仍需进一步探索。
既往研究表明,阻断TGF-β1/Smad信号通路或应用内源性抗纤维化蛋白可减轻肾纤维化[25]。在动物实验研究中,使用TGF-β1中和抗体和TGF-β1信号抑制剂可有效降低FN水平,干预肾纤维化[26]。但介于多种细胞因子对GluT-1具有调节作用,单纯使用TGF-β1阻断剂不能最终影响GluT-1的表达。李英等[6]研究发现,氟伐他汀干预可减少高糖刺激下MC中TGF-β1的合成及GluT-1表达,从而抑制细胞外基质FN及Ⅳ型胶原积聚,延缓DN进展。LUO等[27]发现,芡实可能通过下调肾组织中GluT-1及TGF-β1表达,从而延缓DN进展。
Maresin1是促炎症消退介质之一,具有强大的抗炎活性[7-8]。大量研究显示,Maresin1在各种急慢性炎症中表现出抗炎作用[28-29]。有研究发现,Maresin1还可通过抑制TGF-β1诱导的上皮—间充质转化,恢复上皮细胞标志物E-钙黏蛋白表达,抑制FN和平滑肌肌动蛋白表达,从而延缓肺纤维化进展[11]。有学者以二乙基亚硝胺诱导大鼠肝纤维化,使用Maresin1干预后,大鼠AST、ALT水平趋于正常,肝脏结构得到恢复,炎症减轻,肝脏坏死区域减小;Maresin1治疗后,促纤维化因子TGF-β1及其受体表达降低,类胰岛素生长因子表达正常化。这说明Maresin1有作为抗肝纤维化药物的可能性[30]。在小鼠慢性胰腺炎模型中,Maresin1干预后胰腺损伤和纤维化明显减轻[31]。但对于Maresin1能否通过抑制肾纤维化而干预DN进展,目前尚不清楚。
本研究以不同浓度Maresin1干预高糖刺激的MC,结果显示,MC中GluT-1、TGF-β1mRNA表达和FN、Ⅳ型胶原分泌明显受抑制,且与Maresin1浓度呈正相关,中剂量组即10 nmol/L的Maresin1作用明显。而低糖培养的细胞使用Maresin1预处理后,纤维化指标无明显变化,提示Maresin1可能通过减少高糖状态下MC中TGF-β1及GluT-1表达,抑制FN、Ⅳ型胶原累积,从而减轻肾纤维化。但Maresin1通过何种信号通路作用于TGF-β1及GluT-1尚不清楚,需要进一步研究加以明确。
综上所述,Maresin1可能具有抑制肾纤维化、延缓DN发生发展的作用,其机制可能与抑制高糖刺激下MC中TGF-β1、GluT-1过表达及减少FN、Ⅳ型胶原生成有关。上述发现为Maresin1治疗DN的研究提供了实验依据。

