β-氨基酸聚合物用于协同增效逆转白色念珠菌对伊曲康唑的耐药性
马凯茜, 张东辉, 施 超, 顾佳蔚, 刘润辉
(华东理工大学生物反应器工程国家重点实验室, 超细材料制备与应用教育部重点实验室,教育部医用生物材料工程研究中心, 材料科学与工程学院, 上海 200237)
微生物感染严重威胁着人类的生命健康,同时抗生素的滥用导致微生物不断出现耐药性,造成了巨大的社会问题和经济损失[1-7],而其中的真菌感染问题已经日益严峻[8]。近些年,全球范围内的真菌感染发病率显著上升,并且系统性真菌感染常常伴随着高死亡率,其中感染白色念珠菌(C. albicans)的死亡率通常可超过50%[9-12]。白色念珠菌是一种机会性致病菌,在人体黏膜和环境中广泛存在。当人体健康时,即使携带白色念珠菌也往往不会出现任何症状,而一旦体内微生物群发生紊乱或免疫系统出现异常时,其便可能表现出毒力[13,14]。在各类抗真菌药物中,伊曲康唑(Itraconazole)由于具有广谱抗真菌活性、低毒性、能够进行系统性给药、便宜易得等优势,在临床中被广泛使用[15-17]。然而,由于唑类药物的滥用,白色念珠菌对伊曲康唑的耐药性已经非常严重[18-20]。
伊曲康唑主要通过与靶酶-甾醇14α-去甲基化酶(由ERG11基因编码)特异性结合从而抑制膜上麦角甾醇的合成来发挥抗真菌作用。真菌对伊曲康唑产生耐药性的主要原因包括ERG11基因的过表达提高了胞内靶酶的丰度,以及药物外排泵的过表达降低了胞内的有效药物浓度[21-23]。这启发我们用能够干扰菌膜的聚合物协助伊曲康唑,提高真菌对其摄取效率和胞内药物浓度,通过协同增效来逆转真菌对伊曲康唑的耐药性,而具有抗真菌活性的聚合物是实现协同增效的理想选择。许多天然宿主防御肽具有抗真菌活性,这些抗真菌肽通常具有正电荷和疏水性两亲性结构,其作用方式主要是针对带有负电性的真菌细胞膜[24-30]。然而宿主防御肽成本高昂、不耐蛋白酶水解等缺点限制了其应用[31-35]。β-氨基酸聚合物是宿主防御肽的模拟物,通过合理设计可实现抗真菌活性,同时具有稳定性高、生物相容性好、合成方法简单、价格低廉的突出优势[36-38]。
本文设计了β-氨基酸聚合物来研究其与伊曲康唑的协同抗真菌活性。前期研究证实聚N(α)-Z-DL-2,3-二氨基丙酸N-羧基硫代羰基环内酸酐(Poly-DAP)具有高效抗真菌性质[39]。本文采用DAP作为模拟宿主防御肽的正电荷部分、DL-β-正亮氨酸N-羧基硫代羰基环内酸酐(Bu)作为疏水性部分,通过本课题组近期建立的反应条件温和、对水分不敏感的β-氨基酸N-硫代羧基酸酐(β-NTA)开环聚合的方法获得了β-氨基酸聚合物((DAPxBuy)n)[40]。抗菌测试、溶血测试和细胞毒性测试表明,(DAPxBuy)n聚合物能实现高效协同增效,逆转了真菌对伊曲康唑的耐药性,且聚合物本身基本不引起明显的溶血和细胞毒性,展示出其在真菌感染治疗领域的应用潜力。
1 实验部分
1.1 原料和试剂
DAP、Bu按文献[40]合成;石油醚(PE)、四氢呋喃(THF)、N,N-二甲基甲酰胺(DMF)、三氟乙酸(TFA)、溴化氢的醋酸溶液(w= 33%, HBr-HOAc)、甲基叔丁基醚(MTBE)、甲醇(MeOH)、二甲基亚砜(DMSO)、聚乙二醇辛基苯基醚(TX-100):上海泰坦科技股份有限公司;3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT)、氯化钠、三羟甲基氨基甲烷(Tris)、对叔丁基苄胺(tBuBz-NH2)、伊曲康唑:上海阿拉丁生化科技有限公司;洛斯维帕克纪念研究所1640培养基(RPMI 1640):赛默飞世尔科技(中国)有限公司;3-吗啉丙磺酸(MOPS):Sigma Aldrich;酵母浸出粉胨葡萄糖培养基(YPD):青岛海博生物技术有限公司;达尔伯克改良伊格尔培养基(DMEM):GE医疗;氘代试剂重水(D2O):上海笛柏化学品技术有限公司;超纯水和去离子水由彤迪科学仪器(上海)有限公司生产的MING-CHE-24 UV系列纯水机制备。
1.2 测试与表征
核磁共振波谱(NMR):瑞士Bruker公司Ascend 600 MHz型仪器,D2O作为溶剂;酶标仪:美国Molecular Devices公司,型号为SpectraMax M2。
1.3 实验步骤
1.3.1 (DAPxBuy)n聚合物的合成 采用本课题组文献[40]的β-NTA开环聚合方法,合成了一系列正电荷两亲性聚合物(DAPxBuy)n(x、y分别为单体DAP、Bu的投料摩尔分数,x+y=1,n=20)。以(DAP0.5Bu0.5)20的合成为例,合成路线如图1所示。在氮气保护的手套箱内,称量单体DAP (14.02 mg,0.05 mmol)、Bu (9.36 mg,0.05 mmol)及引发剂tBuBz-NH2(0.82 mg,0.005 mmol),用总共0.5 mL的DMF溶解后在室温下反应,通过柱层析硅胶板监测反应。反应结束后使用1.5 mL THF润洗反应瓶并转移至50 mL离心管,加满-20 ℃ PE离心、沉淀,倒掉上清液并重复此操作两次。将固体置于真空皿中真空干燥后,加入4 mL HBr-HOAc和TFA的混合溶液(体积比为1∶1)脱保护12 h,吹干溶剂,用1 mL甲醇溶解,加入49 mL、-20 ℃ MTBE沉淀、离心,重复3次,真空干燥。将固体用超纯水溶解,0.45 μm过滤头过滤后冻干,即得聚合物(DAP0.5Bu0.5)20。(DAPxBuy)n聚合物的核磁共振氢谱表征结果如图2所示。

图 1 (DAPx Buy)n系列β-氨基酸聚合物的合成Fig. 1 Synthetic route of (DAPx Buy)n series of β-amino acid polymers
图 2 系列聚合物的1H-NMR图谱Fig. 2 1H-NMR spectra of series of polymers
1.3.2 (DAPxBuy)n聚合物的最低抑菌浓度测试 配制YPD肉汤。称量50 g YPD固体于1 L去离子水中,115 ℃灭菌15 min。
配制RPMI 1640培养基。称量30.34 g MOPS,加入一包RPMI 1640粉末,溶于1 L去离子水中,0.22 μm过滤头过滤。
从C. albicans(K1菌株)涂板的琼脂上取一个菌落于10.0 mL YPD中,倒入灭过菌的锥形瓶,置于30 ℃摇床中培养15 h,用RPMI 1640清洗一次后,稀释至2.5×103CFU/mL待用。将聚合物用超纯水配成1 mg/mL,在96孔板中用RPMI 1640以两倍梯度稀释的方法将聚合物稀释到最终质量浓度为0.1~25 μg/mL,将伊曲康唑用DMSO稀释至8 mg/mL,两倍梯度稀释至最终质量浓度为0.1~200 μg/mL,每个孔的液体体积为100 μL。再取100 μL待用菌液分别加入到稀释好的聚合物和伊曲康唑中。另外96孔板最后一列不加药物,前4个孔加纯RPMI 1640作为阴性对照,后4个孔加等体积的RPMI 1640和菌液作为阳性对照。将96孔板置于30 ℃培养箱孵育24 h,之后肉眼观察实验结果,恰好看不到有真菌生长的最低浓度即为样品的最低抑菌浓度(MIC)[37]。每个样品至少在不同的时间重复测试2次。
1.3.3 棋盘格协同抗真菌测试 待用菌液的配制同“1.3.2”节部分。将聚合物用超纯水配成1 mg/mL,在96孔板中用RPMI 1640横向以两倍梯度稀释的方法将聚合物稀释到最终质量浓度为0.1~25 μg/mL,每个孔的液体体积为50 μL。伊曲康唑用DMSO稀释至2 mg/mL,在96孔板中用RPMI 1640纵向两倍稀释至最终质量浓度为0.1~50 μg/mL。保持方向不变,转移50 μL稀释好的伊曲康唑到稀释聚合物的96孔板中。然后加入100 μL待用菌液,最终每个孔的体积为200 μL。每块96孔板的最后一列前4个孔和后4个孔分别作为阴性和阳性对照。将96孔板置于30 ℃培养箱孵育24 h,之后肉眼观察实验结果,记录样品的MIC。每个样品至少在不同时间重复测试2次。
协同活性用协同指数(FICI)进行判断。FICI按照式(1)进行计算:

式中,A和B分别代表两种药物,combined和alone分别代表联合使用两种药物和单独使用一种药物。当FICI ≤ 0.5时,表示两种药物存在协同作用;当0.5 < FICI ≤ 4时,表示两种药物不存在相互作用;当FICI > 4时,表示两种药物存在拮抗作用。
1.3.4 (DAPxBuy)n聚合物的溶血率测试 称取0.61 g Tris和4.39 g氯化钠,溶于500 mL去离子水中,121 ℃灭菌15 min,即制得TBS缓冲液。
向1 mL新鲜人血中加入19 mL TBS缓冲液,轻轻混匀后以4 000 r/min离心3 min,倒掉上清液,重复操作3次。最后用TBS将人血稀释至体积分数5%得到待用血红细胞悬液。在96孔板中,用TBS将聚合物以两倍梯度稀释的方法稀释至最终质量浓度为12.5~400 μg/mL,最后一列加入等体积的TBS和体积分数0.1%的TX-100分别作为阴性和阳性对照。然后向每个孔中加入等体积的血红细胞悬液,在37 ℃的培养箱中孵育1 h。取出96孔板,以3 700 r/min的转速离心5 min,然后吸出80 μL上清液用酶标仪读光密度(OD)值(405 nm)并计算溶血率。 每个样品重复3组实验。
1.3.5 (DAPxBuy)n聚合物的细胞毒性测试 称量0.5 g的MTT,溶于100 mL磷酸盐缓冲溶液(PBS),制得MTT溶液。
NIH3T3(小鼠胚胎成纤维细胞系)用DMEM培养基于37 ℃ CO2培养箱中培养,当培养皿中的细胞达到90%~95%的黏附率时,吸走DMEM培养基,用PBS润洗,再用胰蛋白酶和DMEM处理。以1 340 r/min离心、清洗,并用DMEM将细胞稀释至1.0×105cell/mL待用。在96孔板中加入100 μL细胞悬液,置于CO2培养箱,24 h后除去培养基。将聚合物两倍梯度稀释至最终质量浓度为6.25~400 μg/mL,转移100 μL到除去培养基的96孔板中,对照组加入100 μL DMEM,其中不含细胞的作为阴性对照,含有细胞的作为阳性对照,置于37 ℃CO2培养箱中。24 h后,向板中加入10 μL MTT溶液,在CO2培养箱孵育。4 h后,去除培养基,然后加入150 μL DMSO,置于摇床中摇晃。15 min后,用酶标仪读OD值(570 nm)并计算细胞存活率。每个样品重复3组实验。
2 结果与讨论
2.1 聚合物的协同抗菌活性
(DAPxBuy)n聚合物及伊曲康唑对C. albicans(K1菌株)的抑菌活性、联合使用聚合物与伊曲康唑的MIC值,以及通过计算得到的协同指数FICI,如表1所示。结果表明,单独使用聚合物时,其抑菌活性随着主链疏水基团Bu比例的增多而降低,单独使用伊曲康唑时,即使药物质量浓度达到200 μg/mL也无法完全抑制C.albicans的生长。当联合使用时,所有(DAPxBuy)n聚合物与伊曲康唑的FICI均小于0.5,表明这5种(DAPxBuy)n聚合物与伊曲康唑均存在协同效应,伊曲康唑的MIC可从单独使用时的大于200 μg/mL降低到协同后的3.1 μg/mL,说明(DAPxBuy)n聚合物可通过协同增效有效逆转C. albicans对伊曲康唑的耐药性,使伊曲康唑抗真菌活性从无效转变为高效。
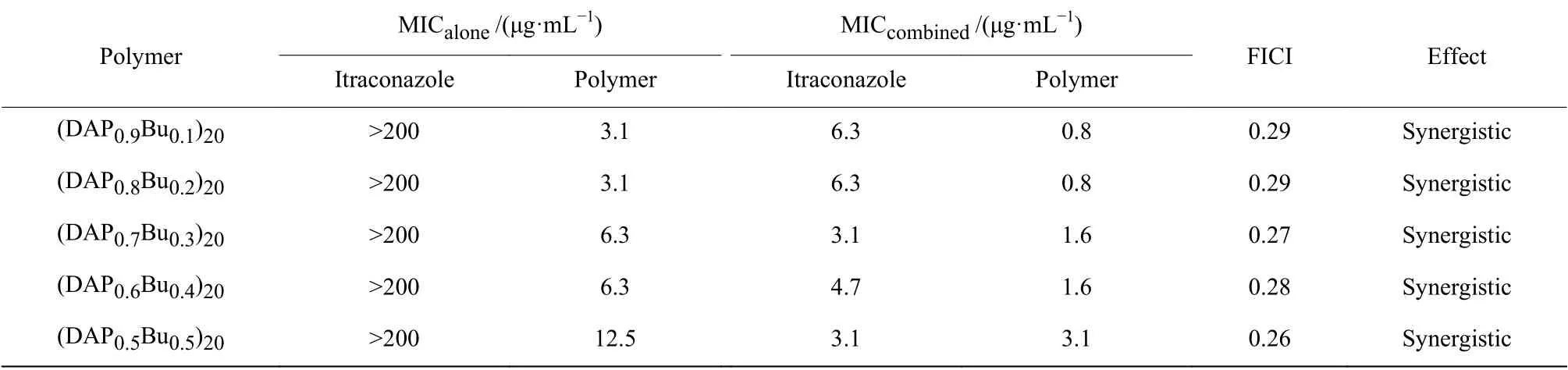
表 1 聚合物与伊曲康唑的MIC、FICI及相互作用模式Table 1 Interaction modes of polymers and itraconazole and their MIC and FICI values
C. albicans在不同质量浓度药物联合使用下的生长情况如图3所示。白色代表此质量浓度下两次实验均无肉眼可见的真菌生长,浅蓝色代表有一次实验有真菌生长,深蓝色代表两次实验均有真菌生长。从图中可以明显看出,联合使用(DAPxBuy)n聚合物和伊曲康唑后,两者可以在各自最多四分之一MICalone的条件下成功抑制真菌生长。
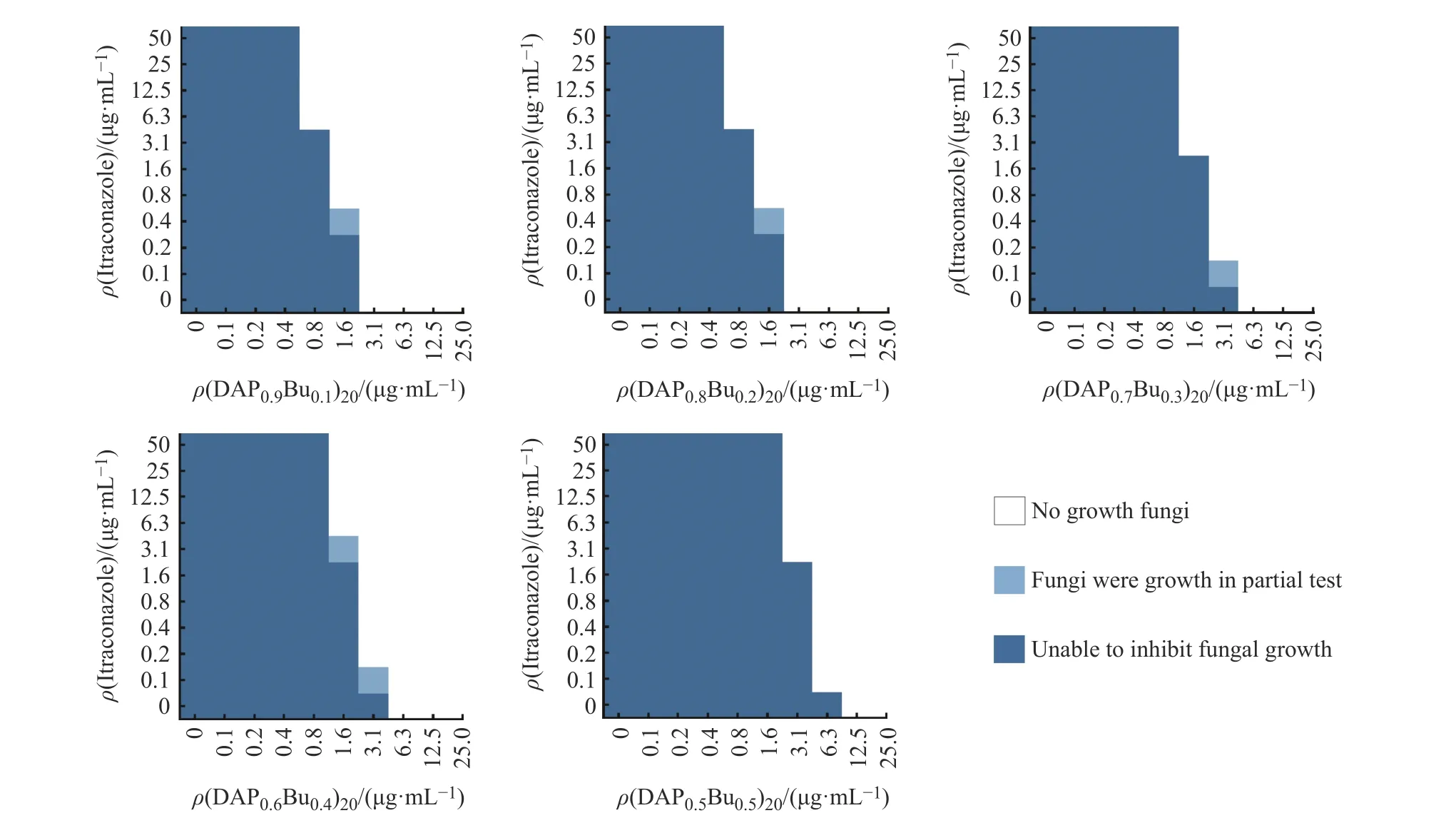
图 3 C. albicans (K1菌株)在不同质量浓度药物联合作用下的生长情况Fig. 3 Growth of C. albicans (strain K1) incubated with different mass concentrations of polymers and itraconazole
有报道提出,宿主防御肽的正电荷和疏水性两亲性特性使它能够改变微生物细胞膜的通透性,从而使更多抗菌药物进入胞内,宿主防御肽进而得以发挥协同增效作用[41,42]。结合由于真菌靶酶基因及药物外排泵基因过表达而导致其对伊曲康唑产生耐药性的机理,我们推测宿主防御肽模拟物(DAPxBuy)n聚合物可能表现出类似的协同机理,即通过改变真菌细胞膜通透性使更多伊曲康唑进入胞内,从而实现逆转真菌对伊曲康唑的耐药性。
2.2 聚合物的溶血率
(DAPxBuy)聚合物的溶血率如图4所示。4组样品的50%溶血时的药物浓度(HC50)均大于400 μg/mL,溶血率较低,血液安全性良好,(DAP0.6Bu0.4)20的HC50为200 μg/mL,溶血率较其他样品略微增强。同时,除(DAP0.5Bu0.5)20外,其余样品的溶血率随疏水基团Bu含量的提高而变大。(DAP0.5Bu0.5)20的反常现象仍在研究中。

图 4 系列聚合物的溶血率Fig. 4 Hemolysis rates of series of polymers
2.3 聚合物的细胞毒性
聚合物的细胞毒性实验结果如图5所示。从图5可以看出,(DAPxBuy)n聚合物的质量浓度在6.25~400 μg/mL,均没有产生明显的细胞毒性。所有聚合物的抑制50% NIH 3 T3成纤维细胞生长的质量浓度(IC50)都在400 μg/mL以上。综合考虑“2.1”节中各聚合物的MIC及“2.2”节中的溶血率,认为(DAPxBuy)n聚合物对真菌和哺乳动物细胞具有比较好的选择性。
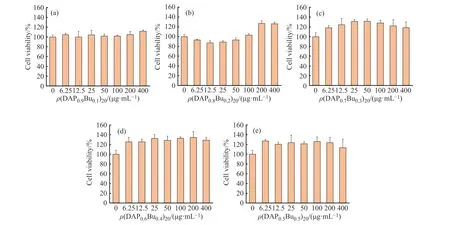
图 5 聚合物的细胞毒性Fig. 5 Cytotoxicity of polymers
3 结 论
(1)(DAPxBuy)n聚合物能实现高效协同增效,逆转了C. albicans对伊曲康唑的耐药性,使伊曲康唑的抗真菌最低抑制浓度从单药的高于200 μg/mL降低至协同后的3.1 μg/mL,即从原先的无效逆转为高效抗真菌活性。
(2)(DAPxBuy)n聚合物在400 μg/mL的质量浓度下基本不会造成明显人血红细胞溶血和细胞毒性。

