不同水体沉水植物叶面微生物群落特征
张松贺,王佳阳,2,牟小颖,王富巍
(1.河海大学环境学院,江苏 南京 210098; 2.中国电建集团华东勘测设计研究院有限公司,浙江 杭州 311122)
生物膜通常生长在各种气、固、液相接界面上,由各种微生物,包括细菌、真菌、原生动物和后生动物组成。在水生态系统中,生物膜上的微生物群落对污染物的分解、转化和吸收起着至关重要的作用[1],是连通生物地球化学、微生物动力学与生态系统功能的重要媒介[2]。与此同时,生物膜作为淡水生态系统中代谢活跃、结构复杂的一部分,也能够为微生物生存提供稳定的环境[3-4]。
沉水植物是微生物的天然基质,其特殊的生长环境十分有利于附生生物膜的形成,在水生态系统中具有重要的生态作用[4]。沉水植物可以为水生态系统中的消费者提供养分和氧气,也有利于附着生物膜中需氧细菌转化营养物质[5]。不同的沉水植物可以向附生生物膜上的微生物释放特定的化感物质,形成特定的附生微生物群落[6-7]。然而,过度生长的附生生物膜也会削弱沉水植物营养和光照的获取,从而对沉水植物的生长造成影响[8]。此外,附生生物膜在沉水植物腐败分解过程中也发挥了重要作用[9-10],植物残体可以为水生生物提供丰富的营养物质(如碳、氮和磷),促进了水生态系统的生物量和能量循环[11]。目前来说,关于沉水植物叶面附着生物膜中的微生物结构的研究尚不深入。
本文以太湖、花神湖、茶楼河和解桥河的4种典型沉水植物(黑藻、苦草、菹草和伊乐藻)叶面的附着生物膜为研究对象,利用荧光显微镜和电子显微镜观测水生植物叶面附着微生物的分布特征,并对藻类组成进行分析;利用16S rRNA基因高通量测序技术,比较分析不同区域典型沉水植物叶面附着生物膜群落结构组成的差异性,旨在为河湖水生态修复治理工程提供理论依据。
1 材料与方法
1.1 样品采集
水样和植物样品于2014和2015年的7月采集于太湖、花神湖、茶楼河、解桥河。太湖位于长江三角洲的南缘,是中国第三大淡水湖,样品采集于太湖贡湖湾人工湿地中;花神湖是南京市城市湖泊,由人工挖掘而成,最深处达7 m多,与自然形成的湖泊从边缘往中间逐渐变深不同,花神湖湖床具有特殊性,离岸不到1 m水深就可能达到数米;解桥河和茶楼河位于江苏省沭阳县新河镇(图1)。
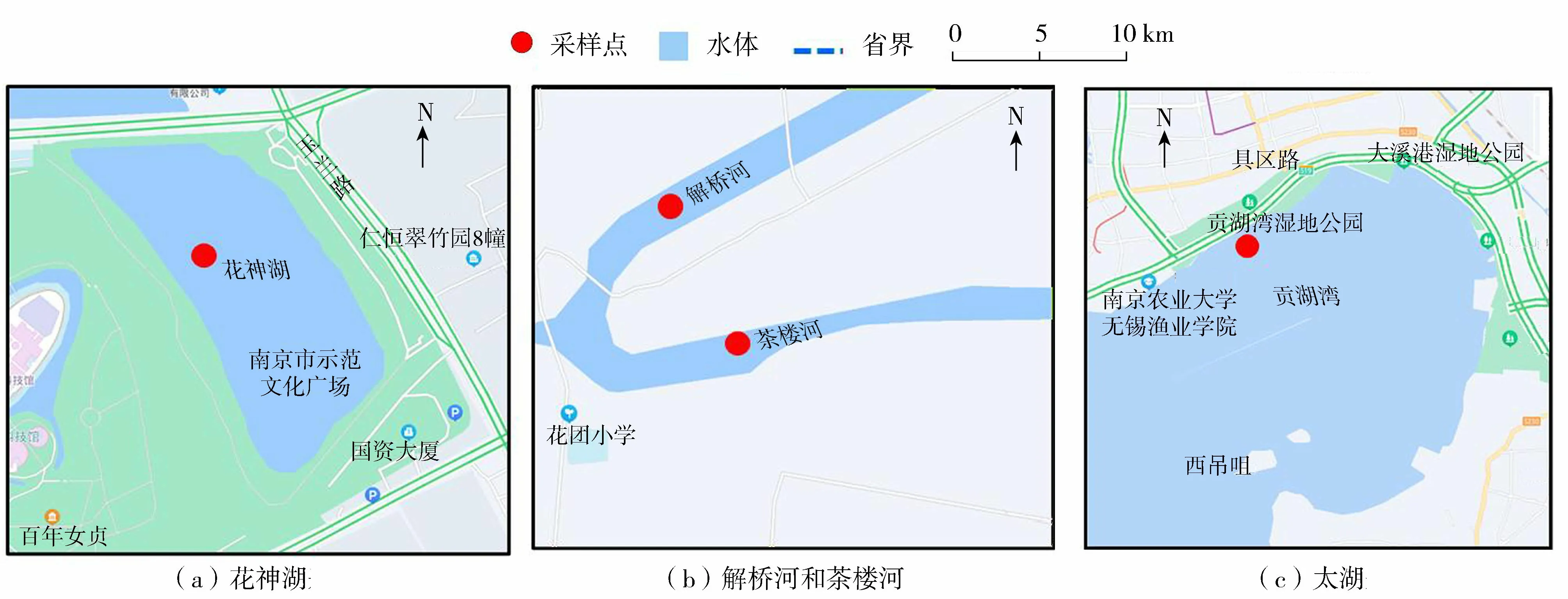
图1 采样点分布Fig.1 Sampling site distribution
使用采水器在水下50 cm处采集2 L水体样品带回实验室于4℃冷藏保存,并于24 h内完成分析。沉水植物样品用手套或不锈钢钩手动采集代表性植物样本,从每种植物的每个采样点附近200 m均匀选取3个样品。
1.2 样品测定
1.2.1 水质测定
水体总氮(TN)采用国家环境保护标准HJ636—2012中的碱性过硫酸钾消解紫外分光光度法进行测定。总磷(TP)采用GB11893—1989中的钼酸铵分光光度法测定。
1.2.2 植物叶面微生物数量和附着藻类密度的测定
将大约50 g新鲜植物样品转移到一个无菌的500 mL聚乙烯瓶中,该瓶含有400 mL的磷酸盐缓冲盐水(PBS,pH为7.4)溶液。超声处理3 min、振荡30 min (225 r/min),最后超声处理3 min,附生微生物被分离。叶片的表面积使用图像软件Adobe Photoshop CS3计算。将大约5 mL分离的样品固定在终浓度为2%的甲醛溶液中,用于附生细菌计数。将大约5滴鲁戈试剂添加到5 mL分离的样品溶液中,用于附生藻类分析。
将100 μL洗脱液或水样与700 μLDAPI(10 μg/mL)进一步混合,并在黑暗中染色30 min。样品通过0.22 μm滤膜过滤之后在荧光显微镜(ZEISS,德国)下对黑色膜上的细菌数量进行计数,对于每张载玻片,随机计数30个窗口。将100 μL洗脱液或水样滴在浮游生物计数室的中间,然后在荧光显微镜下观察。每个样品随机计数50个窗口。基于形态学参数在属水平上鉴定藻类(3次重复)。
1.2.3 扫描电镜分析
将植物叶片样品切成大约0.5 cm×0.5 cm的正方形,并在2.5%戊二醛溶液中培养12 h,在1% OsO4溶液中培养3 h。用0.1 M磷酸钠缓冲溶液冲洗3次(每次15 min)后,将叶片样品在一系列浓度的乙醇中脱水(依次为30%、50%、70%、80%和90%的乙醇,每个浓度15 min),然后是100%乙醇脱水3次,每次15 min。脱水后的样品在冷冻干燥机中干燥12 h。使用扫描电子显微镜(S-4800,Hitachi,Japan)观察喷金叶片样品。
1.2.4 附着生物膜细菌群落结构的测定
将生物膜样品与乙醇以1∶2的比例(体积比)混合,然后离心10 min(8 000 r/min)。收集所有浓缩样品,并将其储存在-80℃的超低温冰箱中。使用PowerBiofilm DNA分离试剂盒提取生物膜DNA(每个样本3次重复)。用引物342F(5′-CTACGGGGGCAGAG-3′)和806R(5′-GGACTACCGGGGTATCT-3′)扩增细菌的16S rRNA基因[12]。扩增程序包括95℃的初始变性步骤(25次循环,每次持续2 min),接着是95℃的变性步骤(30 s),30℃的退火步骤(55 s)和72℃的延长步骤(30 s)。最后进行72℃的延长步骤,持续5 min。焦磷酸测序在上海美吉生物有限公司的Roche 454 GS FLX+Titanium测序平台(Roche 454 Life Sciences, Branford, CT, U.S.)上进行。
1.3 数据分析
利用Oringin 2017处理数据并作图,利用美吉云平台进行弦图和热图绘制,并进行聚类分析。利用CANOCO(Version 4.5, Microcomputer Power, USA)进行冗余分析。
2 结果与分析
2.1 沉水植物叶面附着微生物密度
如表1所示,黑藻(茶楼河)的单位质量附着总菌数最大,其次为伊乐藻(解桥河)、苦草(解桥河)、菹草(花神湖)、苦草(太湖)和伊乐藻(花神湖)。黑藻(茶楼河)单位叶面积附着总菌数最大,其次为苦草(解桥河)、伊乐藻(解桥河)、菹草(花神湖)、苦草(太湖)和伊乐藻(花神湖)。
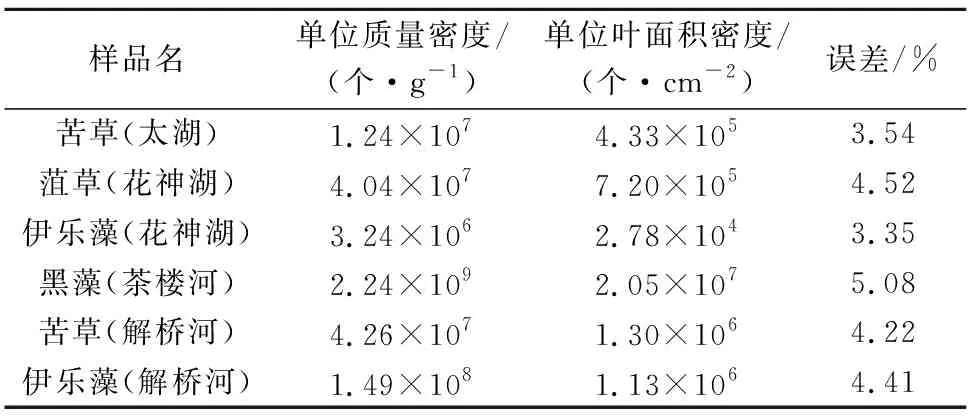
表1 沉水植物单位叶质量表面和单位叶面积总菌数
2.2 沉水植物叶面附着生物膜结构特征
由图2可知,夏季苦草(太湖)叶面颗粒物较多,生物膜结构明显,观察到大量藻类和少许杆菌;黑藻(茶楼河)叶面颗粒物较少,生物膜结构明显,观察到少许藻类和大量球菌;苦草(解桥河)叶面颗粒物较少,生物膜结构明显,观察到少许藻类和大量杆菌;伊乐藻(解桥河)叶面颗粒物较少,生物膜结构不明显,观察到少许藻类和杆菌。

图2 叶面扫描电镜照片Fig.2 Scanning electron microscope images of leaf surface
2.3 水体中浮游藻类和沉水植物叶面附着藻类密度及组成
由表2可知,沉水植物叶片单位质量附着藻类密度范围为2.91×106~6.87×103个/g,单位质量密度从大到小顺序为:伊乐藻(解桥河)、菹草(花神湖)、苦草(解桥河)、伊乐藻(花神湖)、苦草(太湖)和黑藻(茶楼河)。沉水植物叶片单位面积附着藻类密度范围为6.46×103~6.27×104个/cm2,单位叶面积密度从大到小顺序为:黑藻(茶楼河)、伊乐藻(解桥河)、苦草(解桥河)、菹草(花神湖)、苦草(太湖)和伊乐藻(花神湖)。
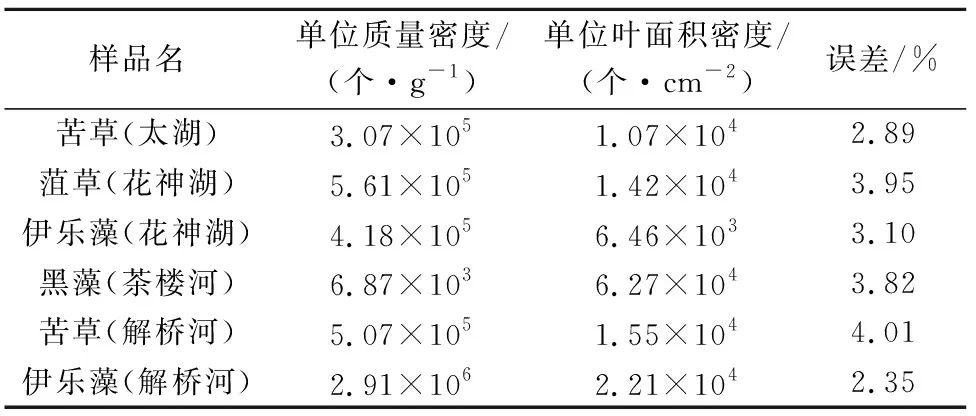
表2 沉水植物单位叶质量表面和单位叶面积附着藻类密度
从采样水体及沉水植物叶面上共检测出绿藻门、蓝藻门、硅藻门、黄藻门、隐藻门和裸藻门共6个门以及46个属(图3)。不同沉水植物叶面附着藻类优势门存在一定差异,菹草(花神湖)和伊乐藻(花神湖)的叶面最优势藻类为绿藻门,其次为蓝藻门和硅藻门。而苦草(太湖)、黑藻(茶楼河)、苦草(解桥河)和伊乐藻(解桥河)则以硅藻门相对丰度最高。水体中,太湖以蓝藻门为主,而茶楼河、解桥河、花神湖则以绿藻门为主。苦草(太湖)、菹草(花神湖)、伊乐藻(花神湖)、黑藻(茶楼河)、苦草(解桥河)、伊乐藻(解桥河)表面分别检测出25种、18种、17种、22种、22种和20种藻属,而湖泊水体中太湖、茶楼河、解桥河和花神湖分别检测出21种、15种、2种和19种藻属。其中,小球藻属、鼓藻属、新月藻属及微囊藻属4种藻属在每种沉水植物叶面和水体中均有出现。管链藻属、鞘丝藻属、螺旋藻属和菱形藻属等17种藻属只存在于沉水植物叶片上,而丝藻属、团藻属、韦丝藻属、月牙藻属和十字藻属等10个属只出现在水体中。太湖和茶楼河水体中相对丰度最高的藻属为微囊藻属,而解桥河和花神湖水体中丰度最高的藻属为小球藻属。其中微囊藻属在沉水植物叶片上和水体中均有较高比例,且水体中高于植物叶片。
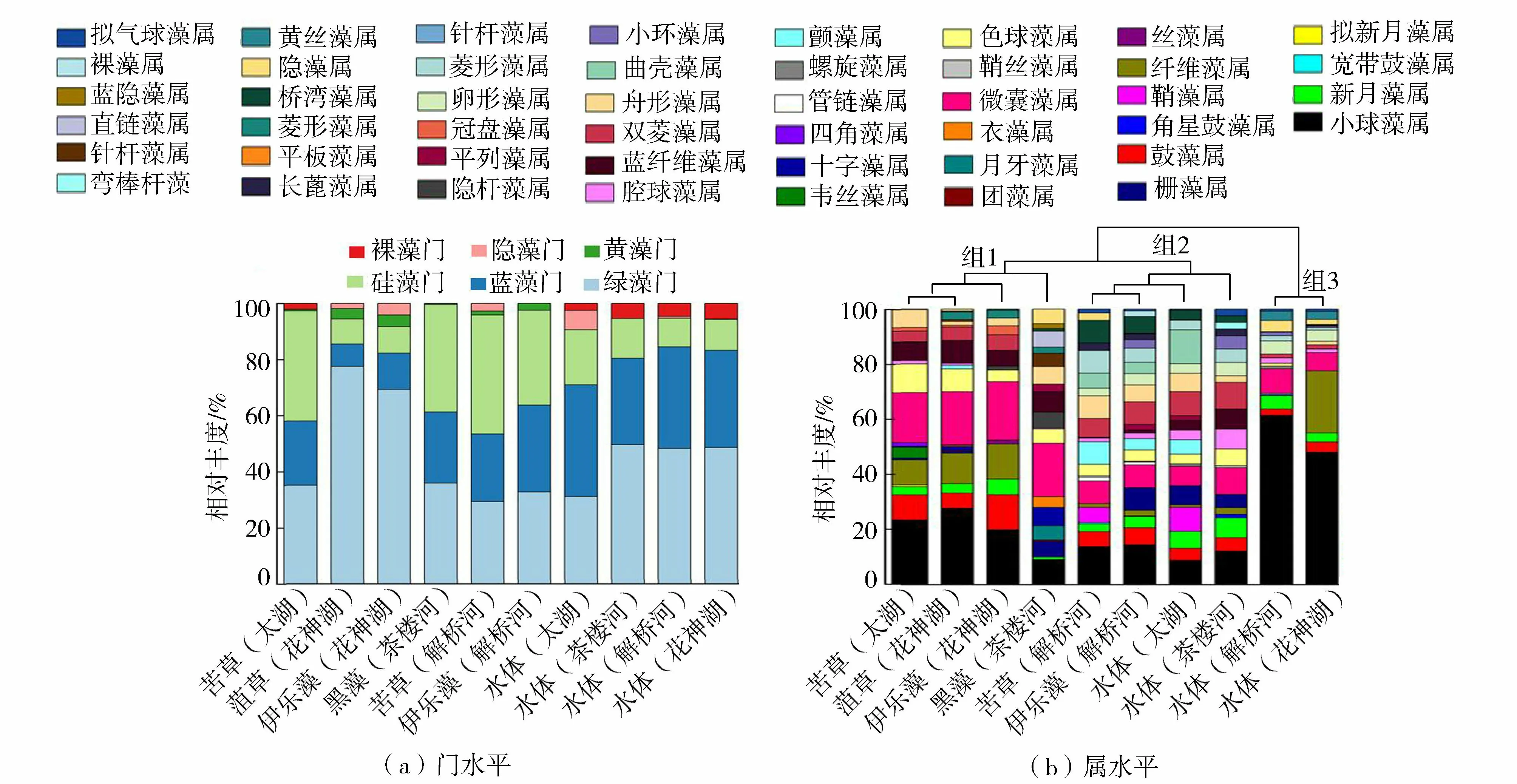
图3 沉水植物叶片表面附着藻类和水体里浮游藻类在各个样品中相对丰度Fig.3 Relative abundance of algae attached on leaves of submerged plants and in environmental water
2.4 沉水植物叶面附着细菌群落结构与功能
根据高通量测序结果,本文对样品的多样性指数进行了分析,结果见表3。Ace指数和Chao1指数表明,不同地区同一种植物附着细菌丰度显著不同,如太湖和解桥河的苦草的Ace指数分别为1747.46和2 680.54,Chao1指数分别为1 575.62和2 238.40,花神湖和解桥河的伊乐藻Ace指数分别为466.13和2 041.98,Chao1指数分别为370.92和1 713.30)。其中菹草(花神湖)的附着细菌丰度最低。Shannon指数用来反映附着生物膜上的细菌群落多样性,苦草(解桥河)最高(6.08),其次为黑藻(茶楼河)(5.84)和伊乐藻(解桥河)(5.76),伊乐藻(花神湖)最低(2.85)。OTU水平上的聚类分析结果(图4(a))显示,6个样品被分为2个不同组,有着较强地域性,而与物种特异性关系较弱。

表3 植物样品细菌测序数据和多样性指数

图4 植物表面附着细菌群落在OTU水平上的聚类图Fig.4 Cluster analyses of bacterial community attached to surface of plants at the OTU level

图5 优势属中的氮循环相关功能菌属Fig.5 Nitrogen cycle-related functional bacteria in the dominant genera
3种沉水植物叶面附着生物膜样品中共检测出39个细菌门(图4(b)),其中有17个门为优势门(至少在一个生物膜样品中排前10)。变形菌门(Proteobacteria, 28.56%~68.71%)是最主要的门,其次是厚壁菌门(Firmicutes, 8.32%~45.68%)、绿弯菌门(Chloroflexi, 0.20%~26.34%)和拟杆菌门(Bacteroidetes,0.12%~16.01%)等。在变形菌门中,6个叶片附着生物膜样品内均检测到了α-变形菌纲(α-proteobacteria, 3.34%~19.79%)、β-变形菌纲(β-proteobacteria, 0.11%~9.31%)、γ-变形菌纲(γ-proteobacteria,9.29%~58.10%)和δ-变形菌纲(δ-proteobacteria, 0.07%~2.55%)。在属水平上,6个样品中共发现366个细菌属,其中有38个优势属(至少在一个样品中排名前10),花神湖沉水植物样品中主要优势属为嗜冷杆菌属Psychrobacter、微小杆菌属Exiguobacterium、不动杆菌属Acinetobacter和肉食杆菌属Carnobacterium。值得注意的是,嗜冷杆菌属Psychrobacter和肉食杆菌属Carnobacterium只在花神湖样品中检测出。图5为优势属中的氮循环相关功能菌。反硝化菌有Sphingobacterium、Rhodobacter、Rhizobium、Pseudomonas、Hyphomicrobium、Hydrogenophaga、Flavobacterium、Comamonas、Bacillus和Acinetobacter共10种,硝化菌有Nitrospira共1种。
采用冗余分析(redundancy analysis)(图6)描述了水体营养盐指标TN、TP与生物膜内优势属之间的潜在关系,结果显示39个优势属总体被分为3个组,组Ⅲ中的细菌属均与TN、TP呈现正相关关系,而组Ⅰ和组Ⅱ中的细菌属均与TN、TP呈现负相关关系。
3 讨 论
3.1 沉水植物叶面附着微生物密度及影响因素分析
通过对沉水植物叶面附着藻类和微生物观测分析发现,沉水植物表面单位叶面积附着微生物总密度(细菌、真菌及放线菌)比附生藻类密度平均高1个或2个数量级,这可能与微生物个体大小有关。细菌、真菌及放线菌个体普遍小于藻类个体,而个体越小,其布朗运动越剧烈,与被黏附表面有更高的碰撞几率,因此细菌比藻类更容易附着于沉水植物表面[13]。此外,沉水植物分泌的代谢物质可能也是造成附着细菌密度大于附生藻类的重要原因[14]。Cattaneo等[15]研究发现,植物叶片结构形态差异也会引起附着藻类密度变化,这与本研究结果一致。黑藻和伊乐藻叶片先端锐尖,边缘锯齿明显,而苦草叶片先端钝圆而具小凸尖,基部钝圆或楔形,边缘浅波状,有细微的锯齿。特殊的形态结构使得黑藻和伊乐藻叶片具有较大的比表面积,可以为藻类提供更大的固着面积,因此叶片上附着藻类密度更高。
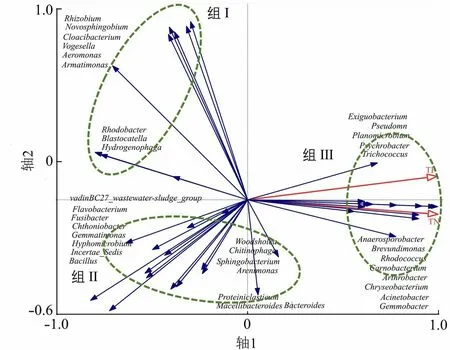
图6 优势属与营养盐浓度之间的冗余分析Fig.6 Redundancy analysis between dominant genera and nutrient concentration
湖泊水体中采集的样品(太湖、花神湖)叶面总菌数和附着藻类密度显著低于河流水体中采集的样品(解桥河、茶楼河)。在河流样品采集过程中,测定了水流流速为0.3 m/s,而湖泊水体流速较慢。Han等[16]研究发现,高速水流不仅会抑制沉水植物的生长,还会影响微生物的附着,减少生物膜厚度。此外,河流样品(高流速)附着生物膜上的细菌群落多样性(Shannon指数)高于湖泊水体(低流速)(P<0.05),这与之前的研究不同[17],这可能与生境中温度、人类活动强度和光照条件等因素有关,需要进一步研究。
通过藻类属层面的聚类分析发现,水体样品聚集在组1,而植物叶片样品聚集在另外两组(图3(b)),表明沉水植物叶面附着藻类组成与环境水体有明显差异。Zuo等[18]研究发现,沉水植物分泌的化学物质可以抑制同一环境中藻类的生长,植物叶片附着藻类直接接触植物,因此更易受到植物分泌物的抑制。在富营养化湖泊中,沉水植物与藻类竞争营养物质及光热等条件,影响藻类正常的生理代谢功能,使藻类死亡[19]。花神湖常年处于富营养化状态(TN:9.91 mg/L、TP:0.9 mg/L),营养物质含量远高于太湖(TN:2.81 mg/L、TP:0.29 mg/L),但却未曾发生藻类暴发事件,这可能与占据湖区40%面积的沉水植物有关。
高通量测序结果表明,各样品中变形菌门都是相对丰度最高的门,这与Zhang等[20]研究结果一致。在不同地区,沉水植物叶面附着细菌群落主要在变形菌门、拟杆菌门、厚壁菌门和绿弯菌门的比例上存在差异。且同一水体不同沉水植物类型附生生物膜上的细菌群落结构均不相同,这与新开河内沉水植物附着生物膜的结果一致[12]。在富营养化程度最高的花神湖中(TN:9.91 mg/L、TP:0.9 mg/L),沉水植物叶片附着生物膜中变形菌门占比均高于50%。Cai等[21]研究发现,随着水体受污染程度的增加,变形菌门中的α-变形菌纲、β-变形菌纲和γ-变形菌纲的相对丰度也会随之升高,变形菌门的相对丰度也因此升高。此外,已有研究[22]表明,化感活性物质和植物分泌物(如多酚)可能是微生物群落结构差异的一个重要原因[12],而化感作用又受周围环境影响。不同地区的沉水植物光照条件、营养物质获取方式等方面的不同,也会导致沉水植物叶面附着生物膜群落结构的不同。
总的来说,沉水植物叶片上有较多附着微生物,水体中沉水植物的修复可以增加生物膜的多样性和丰富度,这些微生物在水生态系统的能量传递和营养物质的吸收或保留中起着关键作用。而植物类型和水体流速等外界因素可能会影响微生物的附着,从而对修复效果产生影响。
3.2 氮循环中的细菌群落
硝化和反硝化细菌在氮循环过程中发挥了重要作用[23]。尽管之前的研究已经在沉水植物叶面发现了硝化和反硝化细菌,但是关于这些细菌详细信息仍不完备[24]。在本研究中,经过对细菌属分类筛选,共检测到1种硝化菌和10种反硝化菌(图5)。硝化细菌偏向在高溶解氧浓度的区域生存,如通气良好的土壤、堆肥和活性污泥[25]。硝化螺旋菌(Nitrospira,0.00%~0.72%)在苦草(解桥河)叶片上相对丰度最高,虽然丰度不到总菌数的1%,但是硝化细菌仍然是脱氮过程中及其重要的微生物。
反硝化作用是一个复杂的过程,反硝化细菌将硝酸盐还原为分子氮或气态氮。10个反硝化属之中,Rhodobacter、Rhizobium、Pseudomonas、Bacillus和Acinetobacter在每个样品中都有发现。红杆菌属(Rhodobacter,0.53%~2.32%)在花神湖样品中相对丰度较低。红杆菌属不仅是一种优秀的氮循环促进细菌,目前研究发现红杆菌属也可以用于生物修复被Cd和Zn污染的废水[26]。在菹草(花神湖)叶片上假单胞菌属Pseudomonas(10.19%)和不动杆菌属Acinetobacter(11.27%)都占相对较高的丰度,假单胞菌属和不动杆菌属都属于γ-proteobacteria纲。假单胞菌属在自然环境中普遍存在,但在原始环境中通常很少,频繁的人类活动会增高假单胞菌属的相对丰度[27],花神湖属于南京城市湖泊,人类活动比较频繁。沉水植物叶片可以通过为微生物提供附着面和营养物质直接提高反硝化速率,也通过形成有利于反硝化菌的生存环境间接提高反硝化速率[28]。
3.3 优势属与营养盐之间的关系
冗余分析结果表明,TN和TP与微生物群落结构密切相关,不同分组表明了与TN、TP不同的相关性关系。组Ⅰ和组Ⅱ中的反硝化菌Rhizobium、Bacillus和Flavobacterium与TN、TP呈现显著负相关关系,这与Yan等[29]的研究结果一致。Flavobacterium在解桥河沉水植物生物膜上相对丰度最高,Verma等[30]研究表明,水体的pH过低会抑制其相对丰度增长。反硝化菌Pseudomonas和Acinetobacter属于组Ⅲ,与营养盐浓度呈正相关关系,在沉水植物轮叶黑藻叶片附着生物膜上也发现了Pseudomonas。最近,Acinetobacter被发现就算在极端低温条件下也具有较高且稳定的氨氮代谢能力[31-32]。此外,研究者们也发现Pseudomonas和Acinetobacter参与到铁锰氧化过程中[33]。这些结果表明,微生物群落与营养盐浓度密切相关,可在污染物去除中发挥重要作用。
4 结 论
a.沉水植物表面单位叶面积附着微生物总密度比附生藻类密度高,植物叶片形态会影响微生物附着。沉水植物叶面附着藻类组成与环境水体有明显区别,且河流水体中附着微生物总密度和附生藻类密度高于湖泊水体。
b.从附着藻类和生物膜群落结构上来看,不同地区沉水植物附生藻类和生物膜主要优势门相同。同一水体中植物附生生物膜细菌群落组成相似性较高,但不同植物附着生物膜中的细菌群落结构明显不同,附生细菌群落具有多样性,不同的沉水植物可以为水体中的微生物提供特殊的生态位。
c.营养盐浓度对沉水植物附生生物膜的细菌群落结构具有显著影响。
——以武汉紫阳湖为例

