核桃仁预防动脉硬化性心血管疾病的网络药理学分析
徐子悟,惠佳如,吴细文,邓晓磊,孟 蕾
(湖南中医药大学 药学院,湖南 长沙 410208)
动脉硬化性心血管疾病(ASCVD)是多种心脏和血管相关疾病的统称,包括高血压、血脂异常、冠心病、脑卒中等,这些疾病是全世界导致发病和死亡的最大原因[1]。目前认为,血管中的活性氧(ROS)产生和低密度脂蛋白(LDL)的氧化是引发 ASCVD的两类首要因素[2],而氧化应激和炎症是疾病早期诊断和治疗的重点[3]。在ASCVD的临床治疗中,他汀类药物已成为治疗首选,尽管这类已获得美国药物监督管理局(FDA)批准的药物能降低够患者体内的低密度脂蛋白胆固醇含量,但他汀类药物的治疗耐药性、不耐受以及缺乏用药依从性等问题仍是成为临床治疗ASCVD的障碍[4]。
在现代医学的临床治疗上,传统的中草药以其低毒性和良好的临床疗效,已被纳入用于许多疾病的联合治疗或替代治疗方案之中[5]。核桃仁作为一种“药食同源”膳食,以其通润血脉、补气养血、延缓衰老等药理功效,自古被人们称为“长寿果”[6-7]。现代医学研究发现,核桃仁在降血压、抗氧化、防止血栓、减少炎症等方面具有较好的药效[8-11]。本文在现有理论基础上,利用网络药理学和分子对接的方法探讨核桃仁预防ASCVD作用机制,为后续探索与开发核桃仁的药用价值研究提供新思路。
1 方法
1.1 核桃仁相关成分与靶点筛选
通过 TCMSP[12](https://tcmsp-e.com/)数据库检索和文献补充得到核桃仁中的物质基础,并通过数据库中的“Pubchem Cid”超链接跳转至PubChem(https://pubchem.ncbi.nlm.nih.gov/)数据库中,以搜集得到的各化合物2D结构信息。在Swiss Target Prediction(http://www.swisstargetprediction.ch/)平台导入核桃仁的成分2D结构文件,转换成为供平台识别的化合物结构SMILE格式,平台中物种选择“Homo sapiens”,以置信度(Probability)≥0.5为筛选条件,获得核桃仁成分的作用靶点。最后,在Uniprot(https://www.uniprot.org)蛋白质数据库中将所有靶点的蛋白名称统一为基因名称。
1.2 ASCVD相关靶点筛选
ASCVD包括多种疾病的发生,以与ASCVD主要的相关疾病“atherosclerosis”、“myocardial ischemia”、“stenocardia”、“myocardial infarction”、“cerebral ischemia”、“ischemic stroke”为关键词,挖掘GeneCards数据库[13](https://www.genecards.org)、OMIM 数据库[14](http://www.omim.org)、DisGeNET数据库[15](https://www.disgenet.org/home/)中疾病的潜在靶点,并取交集作为ASCVD相关靶点。
1.3 核桃仁成分靶点-ASCVD靶点PPI网络构建
为详悉核桃仁成分相关靶点与ASCVD靶点间的相互联系,绘制二者取交集的韦恩图,并将交集靶点导入STRING 11.5数据库(https://stringpreview.org/),以“Homo sapiens”为生物种类设定,设定“mediumt confidence”(≥0.4)为置信值,构建蛋白质-蛋白质互作(PPI)网络模型文件。在CytoScape 3.7.1软件中进一步可视化网络,得到交集蛋白PPI网络图,同时以MCODE插件挖掘得到PPI网络中联系更紧密的基因互作模块。
1.4 核桃仁成分靶点-ASCVD靶点功能与通路富集分析
基于 Metascape平台[16](http://metascape.org/gp/index.html)分析交集靶点的功能及通路富集情况。将核桃仁预防ASCVD的靶点录入Metascape平台中,设置以P<0.01,分别对其主要的生物学过程、细胞组成、分子功能与代谢通路进行富集分析,并用联川生物云平台对数据可视化。
1.5 核桃仁成分-靶点-ASCVD靶点-通路网络图的构建
采用Cytoscape 3.7.1软件构建和分析核桃仁成分-ASCVD靶点的网络图。首先根据核桃仁与ASCVD交集靶点,剔除与交集靶点无关的核桃仁成分,再将核桃仁成分与交集靶点中对应的靶点依次对应导入 Cytoscape软件中得到。软件内置工具“NetworkAnalyzer”可用于计算节点的网络拓扑参数,涵盖连接度(Degree)、中介度(BetweennessCentrality)以及紧密度(Closeness-Centrality)等多种网络分析的度量指标,并根据化合物和靶点网络拓扑学参数判断发挥核桃仁预防ASCVD药效的主要活性成分。
1.6 分子对接验证
分子对接可预测核桃仁化合物成分与靶点蛋白受体之间的亲和力,模拟出小分子与受体的相互作用状态。通过分子对接进一步分析网络药理学中筛选得到的主要活性成分和核心靶点蛋白,将得到的核心靶点蛋白和主要活性成分进行分子对接。靶点和成分3D结构信息分别于PDB数据库(http://www.rcsb.org/)和 PubChem数据库中获得。在 AutoDock v1.5.6[17]中导入靶点蛋白的3D结构经过去水、加氢、分配电荷等处理,并定义选择出活性成分化合物的旋转键。运用Grid模块设置蛋白原配体为对接盒子中心,利用Autodock_vina1.1.2分子模拟软件进行分子对接,最终使用Pymol绘制最佳匹配结果图。
2 结果
2.1 核桃仁成分的获取与筛选
通过以“核桃仁”关键词在中药系统药理学数据库与分析平台(TCMSP)查询核桃仁药物组成,若以常使用的口服生物利用度(OB)≥30%及类药性(DL)≥0.18参数筛选,所得成分仅4种,于是通过核桃仁成分分离鉴定相关文献[18-20]进一步补充,删除重复值,共得到核桃仁活性成分34种(表1)

表1 核桃仁活性成分信息表Table 1 Information table of active ingredients of walnut kernel
2.2 核桃仁活性成分靶点与ASCVD靶点的获取
通过在 Pubchem数据库依次下载获得的 34种活性成分的化合物2D结构文件,上传至Swiss Target Prediction预测34种活性成分的靶点,删去重复靶点后留下核桃仁活性成分靶点有 891个。根据靶点的可信度,取Probability≥0.5的161个靶点进行下一步分析。
根据“atherosclerosis”、“myocardial ischemia”、“stenocardia”、“myocardial infarction”、“cerebral ischemia”、“ischemic stroke”为关键词在 Genecards数据库搜索得到7 255个ASCVD相关靶点。将靶点得分的2倍中位数作为ASCVD潜在目标靶点的筛选条件,例如在GeneCards中得到疾病靶点Score值最大是76.01,最小值是0.09,2倍中位数为1.34,故设定Score>1.34的共1 879个靶点为疾病潜在靶点。同时在OMIM、DisGeNET、DRUGBANK数据库中搜索补充,将各数据库所得靶点取交集得到1 941个ASCVD相关靶点。
2.3 核桃仁成分靶点-ASCVD靶点 PPI网络图构建
将筛选的核桃仁活性成分靶点与疾病靶点取交集,并绘制韦恩图,得到核桃仁成分-ASCVD共同靶点94个(图1)。

图1 核桃仁成分靶点-ASCVD相关靶点韦恩图Fig. 1 Venn diagram of walnut component targets-ASCVD-related targets
在STRING数据库中进行PPI网络分析,设置最小互相作用阈值≥0.4为置信条件,并将网络文件上载到Cytoscape 3.7.1软件中进行可视化分析(图2A)。根据度值进行排序,前10位蛋白基因为 AKT1、SRC、EGFR、CCND1、ESR1、MMP9、KDR、MMP2、ERBB2、PPARG(图2B),这些靶点按照 Degree值排序的对应成分分别为槲皮素、杨梅素、鞣花酸、山萘酚、咖啡酸。
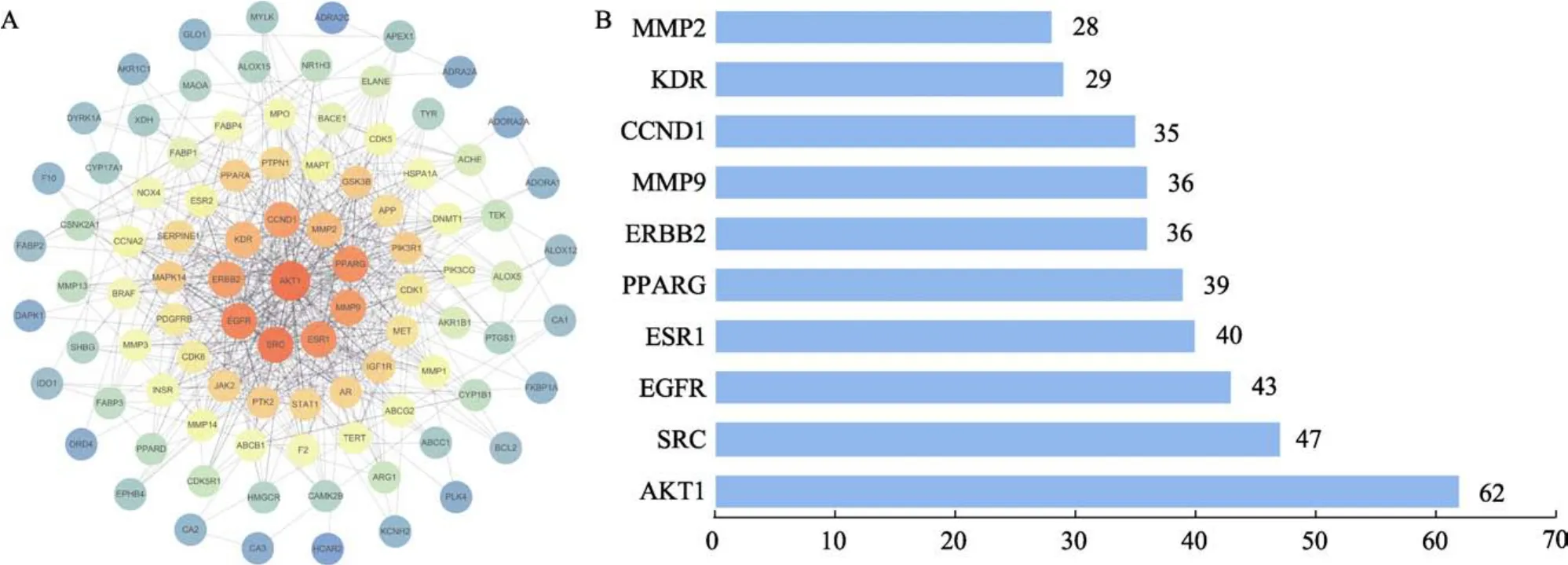
图2 核桃仁成分靶点-ASCVD靶点的PPI网络(A)及核心靶点蛋白(B)Fig. 2 PPI network of walnut component targets-ASCVD targets (a) and core target proteins (b)
在CytoScape3.7.1软件中使用CytoHubba插件,在 5种算法中选出得分最高 10个基因选为PPI分析中 ASCVD的关键基因,其中 EGFR、SRC、CCND1、MMP9、MMP2、ESR1、KDR、AKT1、ERBB2基因在五种分析中均出现,说明该9个基因可能在ASCVD涉及的相关疾病发生过程中起到重要的作用(表2)。
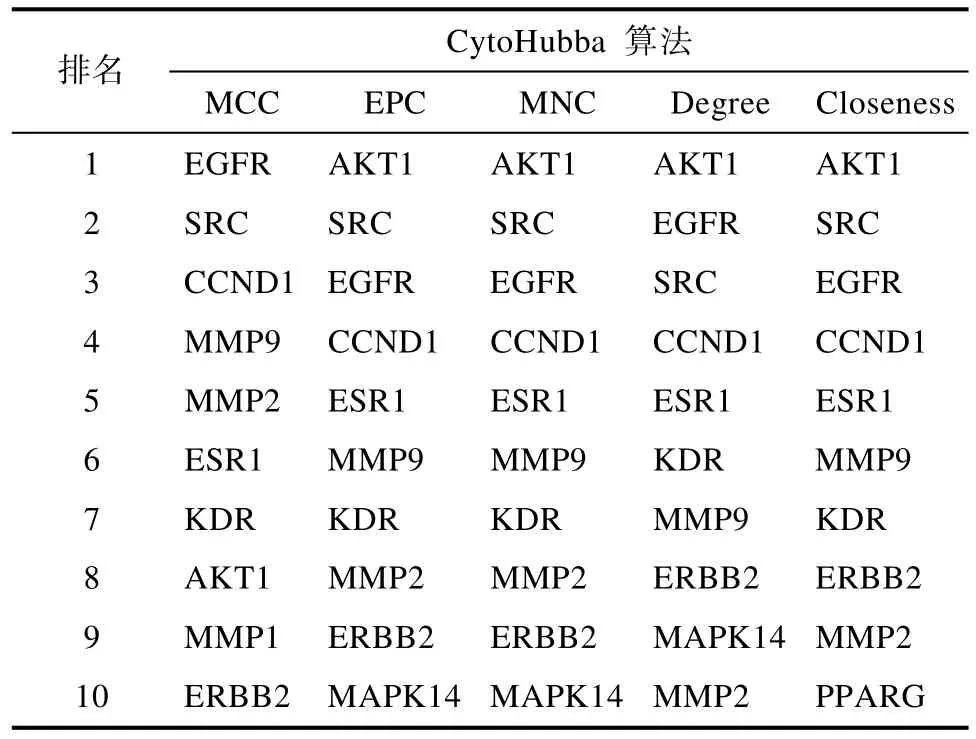
表2 CytoHubba核心靶点计算排名Table 2 Computational ranking of CytoHubba core targets
在PPI网络中,网络拓扑结构和功能信息可以帮助我们深入理解PPI网络的生物机制,有着高度连通区域的子网络更有可能在生物调节过程中起到关键作用。故为更精确分析核桃仁作用ASCVD相关疾病的作用机制,通过MCODE插件分子复合物检测算法对PPI网络中蛋白质相互作用关系进行分析,得到 5个子网络(图3),其中以显著性最强的MCODE 1模块生物学过程进行功能描述。(表3)。
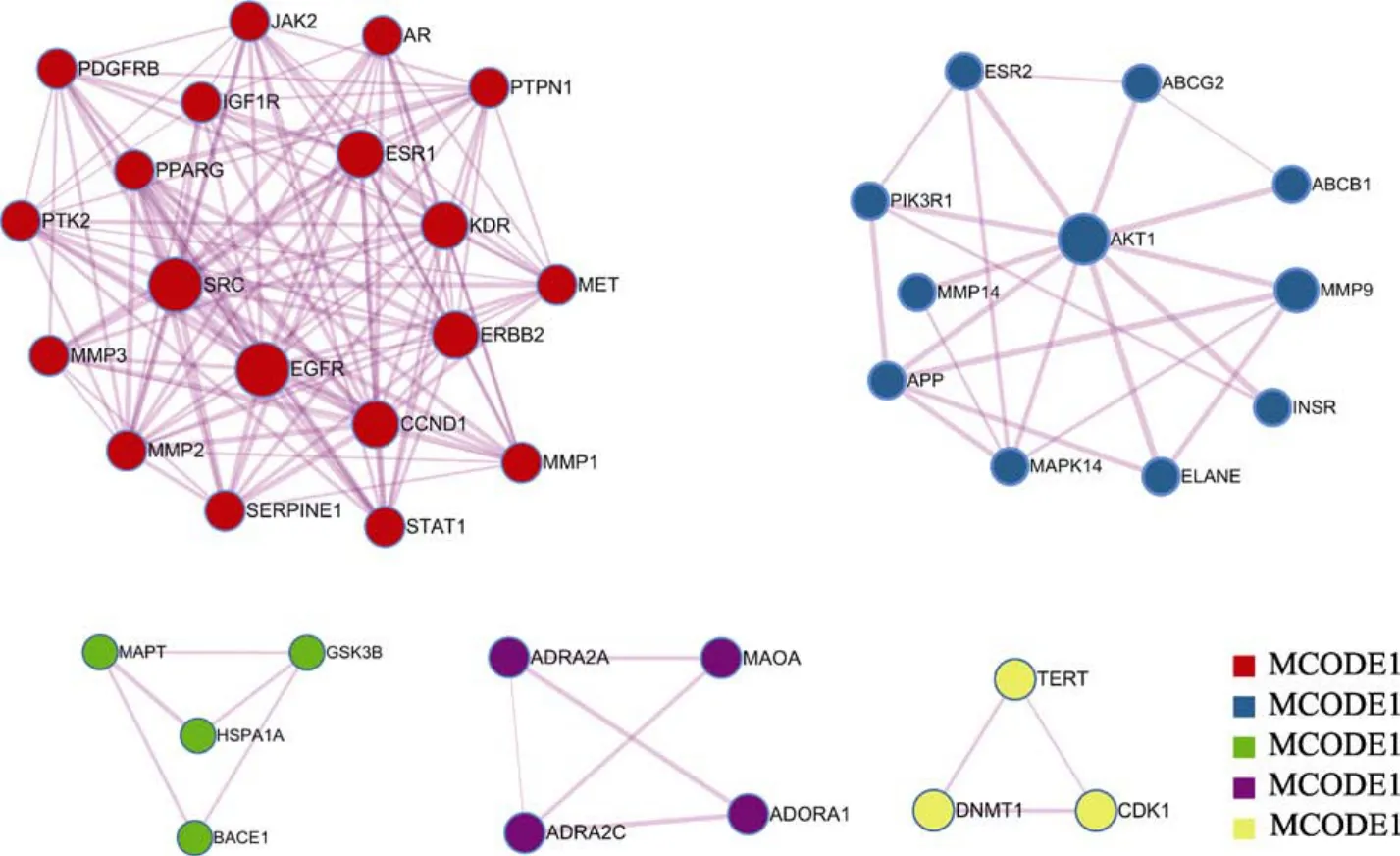
图3 核桃仁-ASCVD靶点的PPI网络中的关键子网络Fig. 3 Key sub-networks in the PPI network of walnut-ASCVD targets
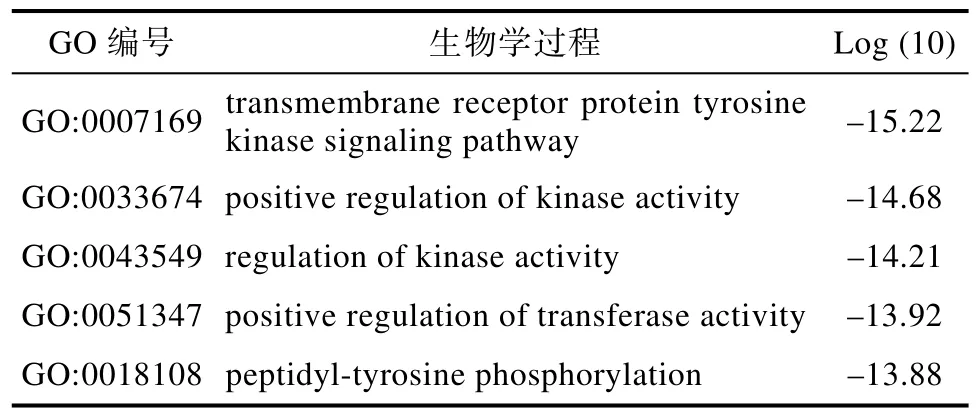
表3 核桃仁-ASCVD靶点的PPI网络功能描述Table 3 Functional description of PPI network of walnut-ASCVD targets
2.4 核桃仁成分靶点-ASCVD靶点功能与通路富集分析
应用Metascape数据平台对核桃仁作用ASCVD相关靶点进行富集分析,并分别对排名前10的结果作图可视化。核桃仁主要富集的与疾病相关的生物学过程包括对氧化应激的反应(response to oxidative stress)、炎症反应的调控(regulation of inflammatory response)、循环系统过程(circulatory system process)、活性氧代谢过程(response to inorganic substance);相关靶点主要参与与ASCVD密切相关的蛋白激酶活性(protein kinase activity)、醇基为受体的磷酸转移酶活性(phosphotransferase activity, alcohol group as acceptor)、激酶活性(kinase activity)等功能(图4B);细胞成分分析表明,基因在转移酶复合物,转移含磷基团(transferase complex,transferring phosphoruscontaining groups)、蛋白激酶复合物(protein kinase complex)等显著富集(图4C)。
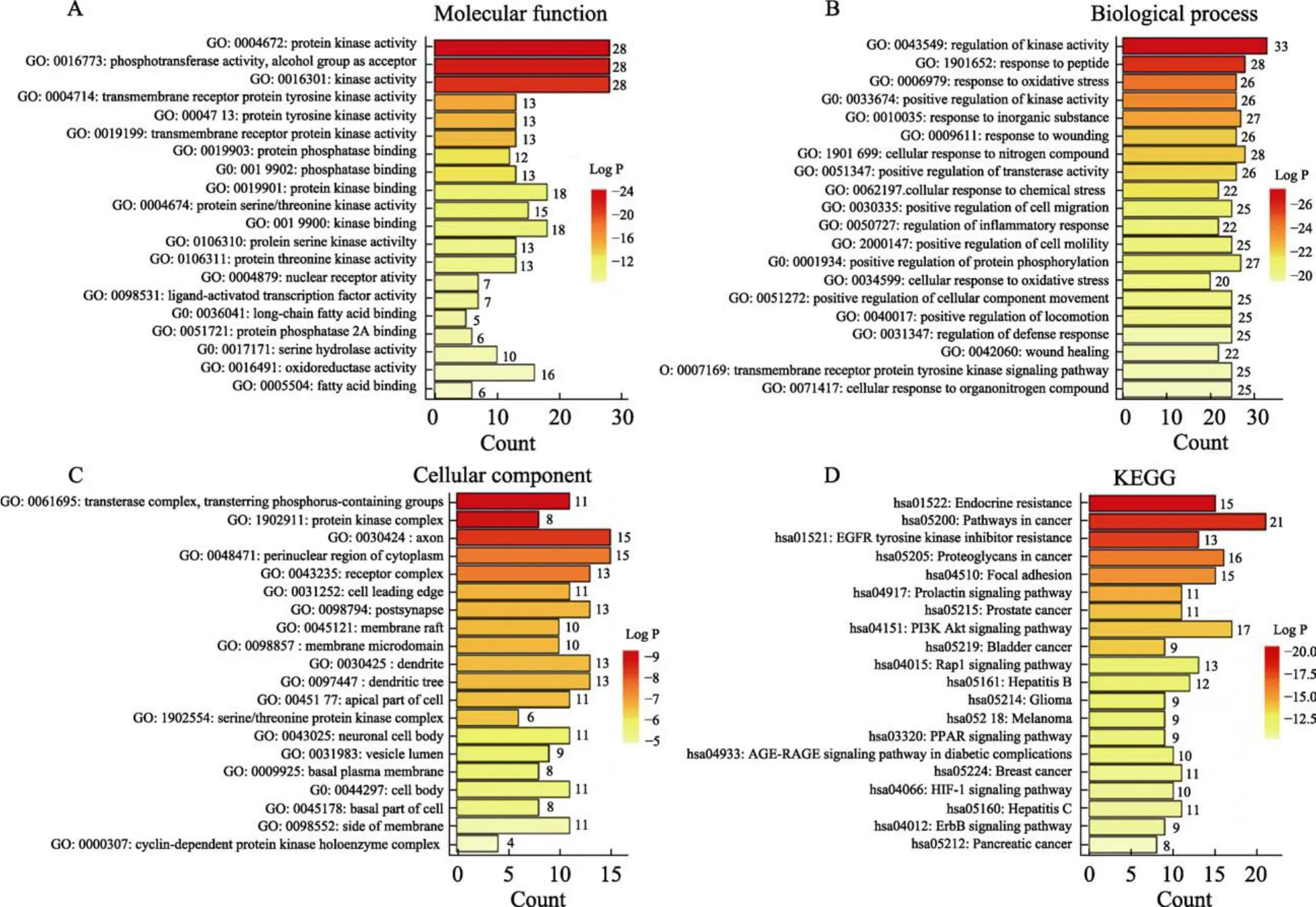
图4 核桃仁延缓ASCVD作用潜在靶点的GO富集和通路富集分析Fig. 4 GO enrichment and pathway analysis of potential targets of walnut kernel for delaying ASCVD effect
交集靶点富集得到参与的通路主要有 PPAR信号通路(PPAR signaling pathway)、PI3K-Akt信号通路(PI3K-Akt signaling pathway)、糖尿病并发症中 AGE-RAGE信号通路(AGE-RAGE signaling pathway in diabetics complication)、HIF-1信号通路(HIF-1 signaling pathway)、脂肪细胞中脂解的调节(Regulation of lipolysis in adipocytes)等,说明核桃仁作用 ASCVSD可能与氧化应激调节和炎症反应相关(图4D)。
2.5 核桃仁成分靶点-ASCVD 靶点-通路网络图构建
选择CytoScape3.7.1构建核桃仁成分-ASCVD靶点-通路网络(图5)。在软件内置的 Network Analyzer插件中展开网络图拓扑学参数自动分析,得到核桃仁缓解疾病核心成分与靶点,其中按照度值排序得到前五成分为槲皮素(quercetin)、杨梅素(myricetin)、山萘酚(kaempferol)、鞣花酸(ellagic acid)、儿茶素没食子酸酯(catechin gallate),其中槲皮素、杨梅素、山萘酚、鞣花酸与之前PPI网络靶点对应的成分一致,说明这四个成分可能为核桃仁预防ASCVD的关键成分。
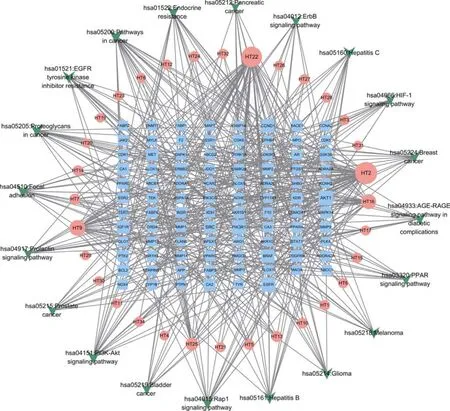
图5 核桃仁成分-ASCVD靶点-通路网络图Fig. 5 Walnut kernel composition-ASCVD target-pathway network diagram
2.6 分子对接结果
选取“成分-靶点-通路”网络、PPI网络以及CytoHubba中获得共同的五个靶点ATK1、EGFR、SRC、CCND1、ERBB2作为核桃仁预防ASCVD的潜在作用靶点,与核心活性成分槲皮素、杨梅素、鞣花酸、山萘酚以及蛋白配体、一线降血脂药物辛伐他汀进行分子对接(表4)。通常情况下,将对接所获得的结合能评分作为评判依据,数值越小说明配体和受体结合后二者越稳定,越可能会产生相互作用。接着通过Pymol软件可视化大分子靶点蛋白质与核桃仁小分子化合物空间上的对接结果。对接结果数据显示,当靶点蛋白和小分子化合物的最低结合能小于或等于–7.0,说明化合物分子与受体结合能力较高[21],其中SRC、ERBB2与活性成分结合能的绝对值均大于其他靶点蛋白与活性成分和一线降血脂药物辛伐他汀结合能的绝对值,而SRC与活性成分结合能的绝对值高于蛋白配体,表明其具有较强的结合能力。分子对接模式(图6)中,SRC(A)与槲皮素共形成7个氢键。说明活性成分与靶蛋白具有较强的亲和力,且结合体构象稳定。综合分析,说明槲皮素、杨梅素、山萘酚、鞣花酸可能是核桃仁通过作用于 AKT1、EGFR、SRC、CCND1、ERBB2等靶点缓解细胞氧化应激和炎症反应等病理环节预防ASCVD的关键成分。

表4 核桃仁活性成分与ASCVD潜在作用靶点的分子对接结果Table 4 Molecular docking results of active ingredients of walnut kernel with potential targets of ASCVD action
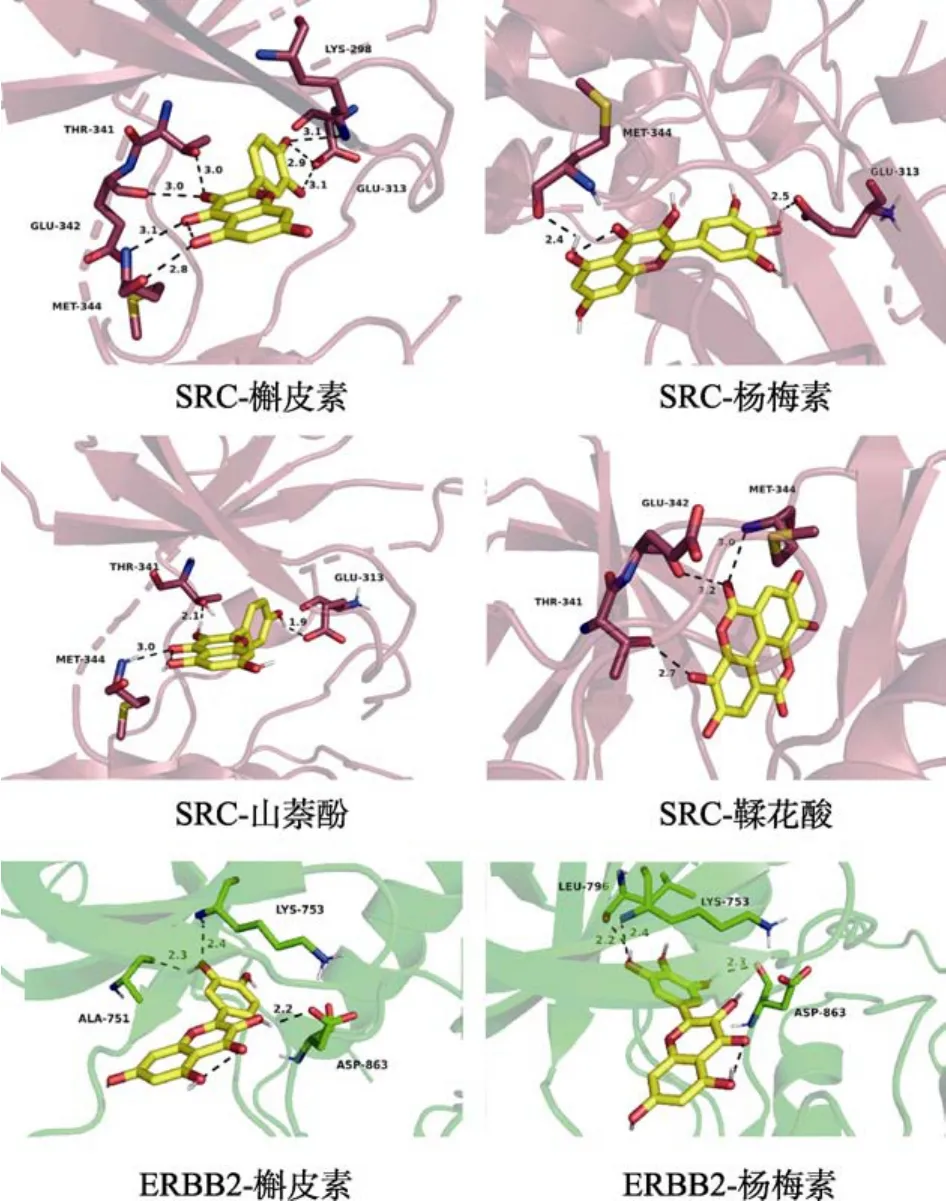
图6 分子对接模式图Fig. 6 Molecular docking pattern diagram
3 讨论
本研究通过网络药理学和分子对接技术的使用,对核桃仁预防ASCVD的作用机制进行网络分析。通过筛选得到核桃仁活性成分34个,靶点161个,疾病相关靶点1 941个,取交集后得到核桃仁作用于疾病相关的潜在靶点94个,体现了核桃仁预防ASCVD是多成分、多靶点、多通路共同作用的结果。
3.1 核桃仁分析
核桃仁入药有着悠久历史,最早可追溯至唐代,在《千金食治》《食疗本草》中均有记载。核桃仁是一味补虚补阳的药食同源中药,在《本草纲目》中以“补气养血,润燥化痰,益命门,利三焦”描述核桃仁。截至目前,我国已有40余种中成药、80余种中药处方以及100多种国产保健食品将核桃仁作为原料添加使用[22]。同时越来越多的证据表明,核桃仁纳入饮食策略中将有益于对人体生理的保护[23],通过摄入核桃可提高机体的抗氧化能力、减少血脂和LDL含量、防止胆固醇在血管中堆积、降低血管内皮细胞黏附分子表达等,最终起到有效预防动脉粥样硬化的作用[24]。
3.2 关键成分分析
核桃仁成分分析通过筛选得到核桃仁的有效成分有34个,其中有3种化合物的作用靶点数量≥20,分别为槲皮素(51个),杨梅素(45个),山萘酚(26个),鞣花酸(23个)。这些靶点很有可能是核桃仁预防ASCVD的关键靶点。槲皮素、杨梅素、山萘酚属于黄酮醇类物质,该类物质具有抗氧化、抗炎、舒张血管、和调节血脂等作用。槲皮素可通过抑制机体中的氧化酶,如还原型辅酶Ⅱ(NADPH)氧化酶和黄嘌呤氧化酶,从而清除活性氧(ROS)来减轻氧化应激损伤,有效降低炎症因子的分泌达到发挥抗炎和抗凋亡作用[25]。杨梅素能发挥抗炎和抗凝的活性,可防止脂多糖诱导的弥散性血管内凝血[26],借助SIRT1/NF-κB通路抑制的细胞炎症反应[27],以及阻断氧化应激,进而减少炎症[28]。山萘酚能显著抑制各类炎症介质,如一氧化氮(NO)、白三烯(LT)以及前列腺素 E2(PGE2)引发的心血管炎症反应,还能减少细胞间粘附分子-1(ICAM-1)、血管细胞粘附分子-1(VCAM-1)和单核细胞趋化蛋白-1(MCP-1)等黏性蛋白水平、减轻脂质过氧化、预防高胆固醇引发的动脉粥样硬化[29]。鞣花酸主要以鞣质这种复杂聚合物的形式存在。鞣花酸可以通过清除自由基,间接降低血液中的血胆固醇如甘油三酯(TG)、总胆固醇(TC)、低密度脂蛋白(LDL)和极低密度脂蛋白(VLDL)等物质的含量,以及显著降低促炎细胞因子并诱导抗炎细胞因子的产生,进而减少动脉硬化性心血管疾病的发生[30]。
3.3 关键靶点分析
通过对核桃仁成分-ASCVD靶点-通路网络、PPI网络以及CytoHubba分析,按照度值排名前10的交集靶点可得 AKT1、EGFR、SRC、CCND1、ERBB2五个靶点蛋白。Akt1是一种丝氨酸-苏氨酸蛋白激酶,是一种多功能激酶,处于一个复杂的信号网络的中心,调节多种细胞功能,涉及细胞生长,生存和代谢的调节,在血管生成、凋亡和调节心肌肥厚等过程中发挥重要作用[31]。研究发现,敲除Akt1基因会上调促炎基因的表达,引起炎症介质并减少eNOS磷酸化,增强内皮细胞和巨噬细胞凋亡,增加了主动脉病变扩展并促进了冠状动脉粥样硬化[32]。EGFR,也称为表皮生长因子受体,在巨噬细胞、血管平滑肌细胞、内皮细胞和心肌细胞中有广泛的表达。动脉粥样硬化病变的形成中 EGFR被磷酸化和激活,抑制EGFR可防止氧化应激、诱导炎症细胞因子和泡沫细胞的形成。并且巨噬细胞中EGFR的激活还涉及 toll样受体 4,与脑外性损伤以及脑缺血有关[33]。SRC是具有酪氨酸蛋白激酶活性的蛋白质,关联胞内和胞外重要信号的传递,参与控制多种生物活动的基因转录、免疫反应、细胞粘附、细胞周期进程等。实验证明,通过Akt/mTOR信号途径抑制Src(Tyr416)磷酸化将缺氧诱导因子1α(HIF-1α)的表达而抑制肺动脉平滑肌细胞的增殖和迁移,减轻肺动脉高压[34]。细胞周期蛋白D1(CCND1)在细胞周期G1期调控中发挥着关键性功能,CCND1的表达上调将可诱导人肺动脉平滑肌细胞增殖[35]。同时,CyclinD1还可以与一些转录因子结合,如FOXO1,从而推动Cyclin D1的表达,提高血管平滑肌的增殖和迁移[36]。ERBB2属于受体型酪氨酸激酶中的表皮生长因子受体家族,目前已有研究证明 ERBB2水平与冠状动脉疾病的发病风险相关[37],并且通过抑制 ERBB2蛋白可以减少ROS的产生,从而改善氧化应激引起的细胞内皮功能障碍[38]。
此外,本研究通过对核桃仁PPI网络进行聚类分析,得出了其中显著性较强的5个模块,其中显著性最强的模块 MCODE 1中包含 Akt1、JAK、CCND1、SRC等靶点基因。这显示核桃仁预防动脉硬化性心血管疾病有可能是经由控制细胞周期,影响细胞生长而进行的,这与目前临床上用于治疗心血管疾病的他汀类药物通过抑制平滑肌细胞增殖产生药效有相似之处[39-40]。综上所述,核桃仁可能通过调节上述基因靶点的表达,缓解由其引发的细胞增殖,从而达到预防ASCVD的目的。
3.4 通路结果分析
GO富集分析显示,核桃仁缓解ASCVD主要通过对氧化应激的反应、炎症反应的调控等生物过程发挥作用。KEGG通路富集结果显示,PPAR信号通路、粘附连接、血小板活化、脂肪细胞中脂解的调节是核桃仁缓解ASCVD的主要通路。ASCVD不单纯是由脂质在血管壁浸润堆积导致,而是机体内血脂异常与炎症反应相互发生恶性循环的后果[41]。长期处于高血浆血脂水平的情况下,脂蛋白侵入血管壁并堆积于血管中,内膜中LDL被氧化修饰,驱动炎症因子的产生,而免疫反应的发展将影响体内脂质的合成与降解,进一步提高血脂、加速ASCVD。已有研究结果显示,PPAR通路与慢性炎症、糖尿病、肥胖、高血压和高脂血症等情况的出现密切相关,并且,PPAR是参与脂质代谢和炎症的关键转录因子[42],这正好佐证了 GO富集分析结果中对氧化应激的反应、炎症反应的调控等生物过程。同时,核桃仁中槲皮素能通过PPAR信号通路,促进脂质分解,降低细胞中甘油三酯的含量[43]。杨梅素通过靶向PPAR信号传导途径有效改善了肝脂肪变性[44]。山萘酚可通过抑制Akt从而激活PPARα和PPARδ发挥减少肝甘油三酸酯的积累功能[45]。鞣花酸通过激活PPAR信号通路对蓖麻油诱导的肠道炎症产生保护作用[46]。
3.5 数据库分析
文中采用 TCMSP数据库获取核桃仁的有效成分。此数据库拥有丰富的种类品类(499种)和化合物成分(29 384种)[12],是一个经典的中药与有效成分数据库,并且在2021年数据库迎来了更新。该数据库特别的价值在于,为研究人员提供了一系列各类中药中化合物成分的药代动力学性质(ADME)信息。ADME以及毒性(T)是决定药物开发成败中的重要因素[47],因此初期将化合物的ADME信息纳入考虑范围之内,有助于提高中药单体药物的开发成功率。在疾病的靶点获取方面,本文选择GeneCards数据库、OMIM数据库、DisGeNET数据库作为获得 ASCVD靶点的来源。GeneCards数据库整合了包括NCBI、UCSC等125个数据库的数据信息,能够获得大量与疾病有关的靶点基因[13]。同时通过主要针对疾病中可遗传性疾病基因的 OMIM 数据库[14]和整合了与人类疾病相关基因和突变信息的DisGeNET数据库[15]的靶点数据进行补充,确保准确获得ASCVD相关靶点。靶点的功能以及通路分析则借助 Metascape数据库,该数据平台综合了 GO、KEGG、STRING、UniProt和 DrugBank等40多方权威数据库资源,并且该数据库每月都将数据更新,确保使用 Metascape得到的数据可靠性[16]。
综上所述,本文系统地分析了核桃仁缓解ASCVD的作用机制,揭示了核桃仁缓解ASCVD潜在的活性成分、作用网络和潜在作用机制。但由于数据库创建时间以及更新维护频率的局限性,仍会不可避免地存在数据库数据不完全、获取的作用靶标不精确等问题,尚不能完全反映整体情况,且预测出的很多新靶点也待进一步研究。因此,为进一步探讨核桃仁发挥作用的药效物质基础和作用机制,仍需后续进一步的体内外实验进行验证。
备注:本文的彩色图表可从本刊官网(http//lyspkj.ijournal.cn)、中国知网、万方、维普、超星等数据库下载获取。

