供者淋巴细胞输注治疗无效的移植后复发患者过继性回输NK细胞的免疫学变化和临床疗效①
曹勋红 王志东 韩 伟 陈育红 唐菲菲 孙于谦 王景枝 许兰平 张晓辉 王 昱 刘开彦 黄晓军 赵翔宇(北京大学人民医院,北京大学血液研究所,国家血液系统疾病临床医学研究中心,北京 100044)
异基因造血干细胞移植(allogeneic hematopoietic stem cell transplantation,allo-HSCT)是治疗恶性血液病有效甚至唯一的手段,但移植后复发仍是移植后主要并发症,影响移植疗效。目前移植后复发常规治疗方式包括化疗、联合供者淋巴细胞回输(donor lymphocyte infusion,DLI)等,但DLI虽能明显缓解移植后复发,却增加了回输后移植物抗宿主病(graft versus host disease,GVHD)发生风险。
NK细胞是机体重要的天然免疫细胞,在免疫监视和肿瘤清除过程中起重要作用。RUGGERI等[1]证实杀伤免疫球蛋白(KIR)配体不相合的异基因NK细胞在急性髓系白血病(acute myelogenous leukemia,AML)患者中可发挥促进植入、抗急性移植物抗宿主病(acute graft versus host disease,aGVHD)和抗肿瘤作用。MILLER等[2]研究报道,异基因NK细胞治疗在难治复发AML患者体内有较好的安全性和一定疗效。但受限于人体NK细胞数较少,NK细胞临床应用受到限制。MASUYAMA等[3]建立了CD3联合CD52单抗体外诱导供者来源NK细胞的扩增方法,临床前研究证实其具有抗肿瘤作用。本研究采用CD3联合CD52单抗体外诱导移植供者来源NK细胞扩增,并将其回输给DLI无效的移植后复发急性白血病患者,初步研究NK细胞回输至移植后复发患者体内的免疫学变化及临床疗效。
1 资料与方法
1.1 资料
1.1.1 入组病例及标准 入组患者8例,入组条件为2011年2月至2014年1月于北京大学血液病研究所进行allo-HSCT且移植后复发患者,患者主要临床特点见表1。
1.1.2 预处理方案 全部采用常规改良BU/CY(白消安/环磷酰胺)方案,HLA配型不合移植预处理中加用抗胸腺细胞球蛋白(ATG)[4]。
1.1.3 干细胞动员和采集 全部患者采用骨髓联合外周血干细胞移植,所有患者均以G-CSF动员5~6 d(-3 d开始),剂量为5µg/kg[5-6]。
1.1.4 aGVHD预防 采用环孢素(CsA)联合霉酚酸酯(MMF)及短程甲氨蝶呤(MTX)方案[7]。
1.1.5 植活标准 连续3 d中性粒细胞绝对值(ANC)≥0.5×109L-1为粒细胞植活,连续7 d PLT≥20×109L-1为血小板植活[8]。
1.1.6 主要试剂 6色抗体组合:CD3-Percpcy5.5、CD62L-FITC(美国Becton Dickinson公司);CD56-APCCY7、CD57-Pacific Blue(美国Biolegend公司);CCR7-PECY7、NKG2C-PE(美国RD$systems公司);8色抗体组合:CD3-Amcyan、CD56-APCCY7、CD57-Pacific Blue、KIR-FITC、NKG2A-PE、NKG2D-Percpcy5.5、NKp30-APC,NKp46-PECY7(美国BD Bioscience公司);CD107a-藻红蛋白(phycoerythrin,PE)及莫能霉素、Cytofix/Cytoperm试剂盒(美国Becton Dickinson公司)。
1.2 方法
1.2.1 NK细胞富集、扩增 采集健康供者来源外周血40 ml,提取单个核细胞,经抗CD3(0.1µg/ml)和抗CD52单克隆抗体(20µg/ml)于T-225瓶中共同刺激4 d,转至新开发的含自体血浆和IL-2的NKGM-1培养基培养14 d,每3 d更换1次含IL-2的新鲜培养基[3]。流式分选扩增后的CD3-CD56+平均活率为94.475%,扩增后NK细胞平均占比为44.35%,8例患者NK细胞及T细胞扩增占比及回输给患者的细胞数量见表2。

表2 入组患者NK细胞扩增活率、比例及回输数量Tab.2 Expansion rates,ratio and number of NK cellsinfused into enrolled patients
1.2.2 标本留取 ①留取供者培养前及扩增后的NK细胞,流式监测NK细胞扩增前后数目、比例、凋亡及表型变化;②留取回输后5周内外周血,1次/周,流式细胞术分别检测CD3-CD56+NK细胞亚群动力学变化,同时检测NK细胞IFN-γ分泌水平及杀伤活性。
1.2.3 流式细胞术检测
1.2.3.1 NK细胞表型检测 ①取全血100~200µl,加入6色抗体组合:CD3-Percpcy5.5、CD62L-FITC、CD56-APCCY7、CD57-Pacific Blue、CCR7-PECY7、NKG2C-PE,避光孵育30 min,溶血,PBS洗涤后上机检测;②取全血100~200µl,加入8色抗体组合:CD3-Amcyan、CD56-APCCY7、CD57-Pacific Blue、KIR-FITC、NKG2A-PE、NKG2D-Percpcy5.5、NKp30-APC,NKp46-PECY7,避光孵育30 min,溶血,PBS洗涤后上机检测;③NK细胞扩增前后表型抗体组合见文献[9]。
1.2.3.2 NK细胞抗白血病功能检测 采用淋巴细胞分离液提取外周血单个核细胞(mononuclear cells of peripheral blood,PBMC)计数,调整细胞浓度为1×106个/ml,设实验孔及对照孔各2个,200µl/孔接种于96孔板,给予IL-2 1 000 U/ml孵育过夜,实验孔加入K562细胞(与PBMC比例为5∶1),对照孔加入等体积RPMI1640培养基,同时每孔加入CD107a-PE及莫能霉素0.14µl孵育4 h后终止孵育,采用5色荧光标记技术标记膜表面标记及细胞内抗原表达。所用细胞膜表面免疫荧光包括CD56-APCCY7、CD57-Pacific Blue、KIR-FITC,按照Cytofix/Cytoperm试剂盒说明固定破膜后标记细胞内免疫因子IFN-γ。
1.2.4 患者移植后微小残留病(minimal residual disease,MRD)监测 伴有重现性染色体异常的急性白血病患者,以其特征性标志基因(如ETO)作为监测指标,>0.4%为阳性[9];无特征性标志基因的急性白血病患者,采用WT1基因作为监测指标,>0.6%为阳性[10]。同时采用流式细胞术检测白血病相关免疫表型(leukemia-associated aberrant immune phenotypes,LAIPs)。于移植后1个月、2个月、3个月、4.5个月、6个月、9个月、12个月监测MRD,出现1次基因或LAIPs阳性的患者需在2周后复查。间隔2周连续2次出现基因/LAIPs阳性或同时出现基因和LAIPs阳性为MRD阳性,即分子生物学复发;骨髓中原始细胞>5%为血液学复发。入组标准:复发患者(血液学复发和/或分子生物学复发)可给予DLI,DLI后疗效不满意患者给予NK细胞回输治疗。给予DLI和NK细胞回输治疗后继续监测MRD。所有患者知情同意。
1.3 统计学处理 采用GraphPad Prism 8.0及R软件分析数据,采用非配对T检验进行单因素分析,P<0.05为差异有统计学意义。
2 结果
2.1 入组患者临床特点 本研究中4例接受了同胞HLA全相合allo-HSCT,4例接受了同胞HLA单倍型相合allo-HSCT,男5例,女3例。7例移植时处于完全缓解状态;1例移植前为复发状态。患者接受第1次供者来源NK细胞回输的中位时间为移植后745.5 d。2020年5月随访终止时,共有5例患者死亡:患者1的直接死因为中枢神经系统感染,患者2死于移植后血栓性微血管病(thrombotic microangiopathy,TMA),患者7为重症肺炎导致的呼吸衰竭,患者6和8为血液学复发。
2.2 预后 4例治疗有反应。病例3:难治复发AML患者,同胞全合移植后18月余再次出现骨髓MRD阳性,伴髓外复发(皮肤),右大腿后侧结节持续20余天,因放化疗不耐受,接受NK细胞回输治疗,共计回输NK细胞5次,前2次NK细胞回输前联合HAA化疗,每次间隔时长为3~5个月,回输后序贯IL-2一百万单位注射2周,第1次NK细胞,回输后结节消退,MRD转阴,无其他不良反应,至今患者无白血病长期生存;病例4:单倍型移植后6个月AML患者骨穿MLL-MLL基因持续阳性,NK细胞回输治疗共计1次,回输前无化疗,回输后MLL-MLL基因转为阴性,无其他不良反应,至今患者无白血病长期生存;病例5:单倍型移植后26月骨髓增生异常综合征(MDS)患者,MRD由阴性转为阳性,为异常髓系幼稚细胞,经过化疗(AA方案)联合供者淋巴细胞回输治疗后2个月复查骨髓仍FCM阳性,因此接受NK细胞治疗,共计回输3次,每次间隔2个月,第1次回输后骨髓FCM即转阴,无其他不良反应,至今患者无白血病长期生存;病例7:同胞全合移植后13月余B-ALL患者,骨穿WT1由阴性转为阳性,FCM结果提示有异常髓系幼稚细胞,经过化疗联合供者淋巴细胞回输2个月复查骨穿WT1仍为1.1%,接受NK细胞治疗,共计回输5次,前3次回输前联合COPD方案化疗,每次间隔2个月左右,第2次回输后WT1为0.23%,但第3次回输后骨髓FCM表型异常且WT1为0.88%,因WT1和免疫残留持续阳性,DLI后随之行第4、5次NK细胞回输,第5次回输后WT1为0.17%,骨髓FCM转阴,回输过程中无其他不良反应,但在allo-HSCT后1年死于重症肺炎导致的呼吸衰竭;4例治疗无反应:病例1、2、6、8,其中1例为持续MRD阳性,3例为血液学复发,经过NK细胞联合化疗或DLI治疗后分子学及血液学复发指标均未得到缓解。患者1:难治复发AML患者,同胞全合移植后30个月,脑脊液(cerebrospinal fluid,CSF)-FCM阳性,骨髓FCM表型异常,第1次FLAG化疗序贯NK细胞回输治疗后CSF-FCM转阴,骨髓FCM转阴,回输后2个月骨髓FCM复阳,行HAA方案化疗联合2次NK细胞回输,此后骨髓及脑脊液FCM仍复阳,回输期间无不良反应,最终因中枢神经系统感染死亡;患者2:单倍型移植后24个月B-ALL患者,回输前骨髓原始细胞占7%,增生V级,DLI治疗后2个月共计回输NK细胞2次,回输后因持续粒缺未评估,最终因重度GVHD及TMA死亡;患者6:MRD持续阳性AML患者,单倍型移植后15月余AML1-ETO为98.7%,接受NK细胞回输治疗,回输前无化疗,共计回输1次,回输后降至3.5%,无其他不良反应,最终死于血液学复发;患者8:难治复发AML患者,同胞全合移植后4月余ETO为56%,外周原始细胞占50%,DLI后行NK细胞回输治疗,共计回输1次,回输前未接受化疗,回输后再次给予化疗,无其他不良反应,肝脏GVHD未加重,但最终死于血液学复发。
2.3 体外扩增NK细胞的生物学特性 采用CD3联合CD52单抗方法体外扩增健康供者外周血来源NK细胞,结果发现,供者来源NK细胞扩增后表型以早期不成熟亚群为主,主要表现为NKG2A+NK细胞培养后明显增加,而CD57+亚群明显下降,CD3-CD56dimCD57+KIR+扩增前后差异无统计学意义(图1A)。NK细胞功能发挥取决于活化型及抑制性受体平衡,采用流式细胞术监测扩增前后NK细胞活化型受体及抑制性受体变化(图1B、C),扩增后NK细胞表面NKG2D、DNAM-1及NKP30平均荧光强度明显上调,同时,抑制性受体CTLA-4、PD-1、Tim-3及Tigit平均荧光强度表达扩增后也明显增强。由于CD69及CD25在NK细胞高表达可分别指示NK细胞杀伤能力及增殖水平提升,本研究对此进行评估并发现扩增后NK细胞表面CD25及CD69平均荧光强度明显高于扩增前,提示扩增后NK细胞被活化(图1E、F)。NK细胞组织异质性高且在不同组织脏器中发挥重要作用,其体内循环与表面趋化型因子表达密切相关,本研究发现扩增后NK细胞表面CXCR3、CX3CR1及4-1BB平均荧光强度较扩增前明显增强,说明扩增的NK细胞组织趋化能力提升(图1D)。

图1 NK细胞扩增前后表型变化Fig.1 Phenotype changes before and after expansion of NK cells
2.4 NK细胞体内回输后淋巴细胞数量动力学变化 所有接受NK细胞回输后的病例白细胞总数及淋巴细胞总数恢复动态规律如图2A、B所示,其在有反应患者与无反应患者中恢复规律无明显差异。而有反应组患者(病例3、4、5、7)T细胞比例(占淋巴细胞百分比)在与无反应患者相比无明显规律,但回输后第2周除病例8外,无反应组T细胞比例均低于有反应组(图2C),尤其是回输后前3周无反应组T细胞比例低于有反应组(图2D),说明回输后T细胞也可能参与抗肿瘤作用。
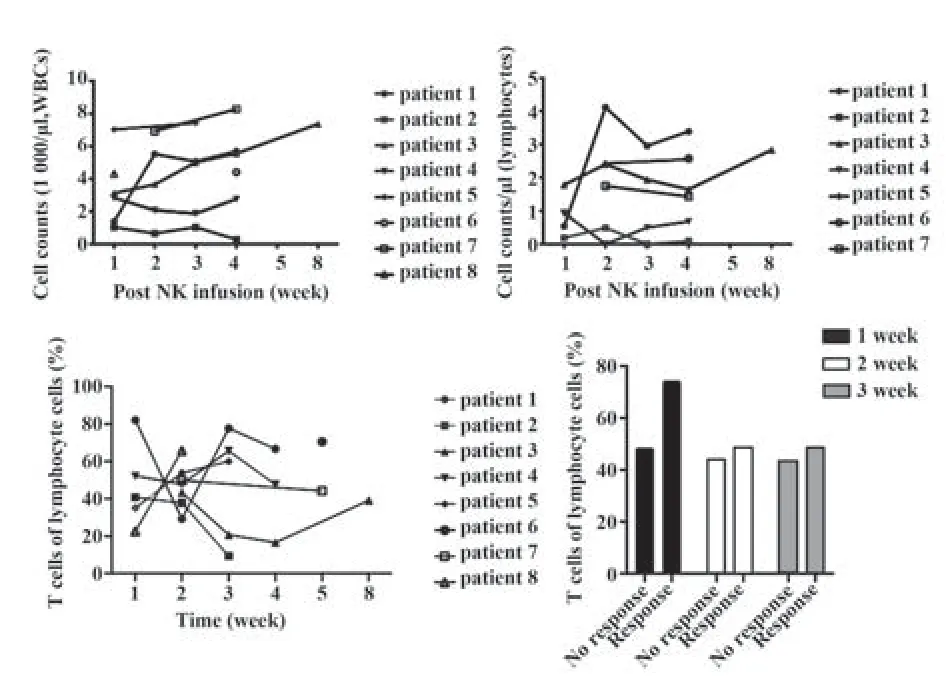
图2 NK细胞回输后体内各细胞数量动力学变化Fig.2 Dynamic changes of other cell number in vivo after NK cell infusion
2.5 NK细胞回输后体内亚群动力学变化 有反应组(病例3、4、7)CD56brightNK细胞亚群整体恢复水平明显高于无反应组(病例1、2、6),而无反应组患者8的CD56brightNK细胞亚群恢复效果中整体水平高于有反应组病例5(图3A),各病例CD56dimNK细胞亚群恢复趋势与CD56brightNK细胞相反(图3B)。NK细胞表面NKG2A表达与NK细胞治疗后反应无明显相关性,治疗无反应组病例6及病例1NKG2A亚群分布在NK细胞回输治疗后始终处于较低水平,虽然病例1治疗1周后NKG2A表达约达60%,但治疗后第2周迅速下降,而后在3、4周维持在30%左右,其他病例则在回输治疗后5周内维持相对较高水平,变化趋势也较为平稳(图3C)。CD57+NK细胞亚群的病例恢复趋势与KIR+NK细胞一致,即有反应组(病例4、5、7)亚群水平明显高于无反应组,提示NK回输治疗后对肿瘤细胞的杀伤可能依赖于成熟NK细胞亚群功能发挥;进一步亚群成熟度分析也提示无反应组(病例1、2、8)CD56dimNKG2A-CD57-KIR-比例明显高于有反应组(病例3、4、5、7),两组间其他亚群趋势变化无规律(图4A、B)。
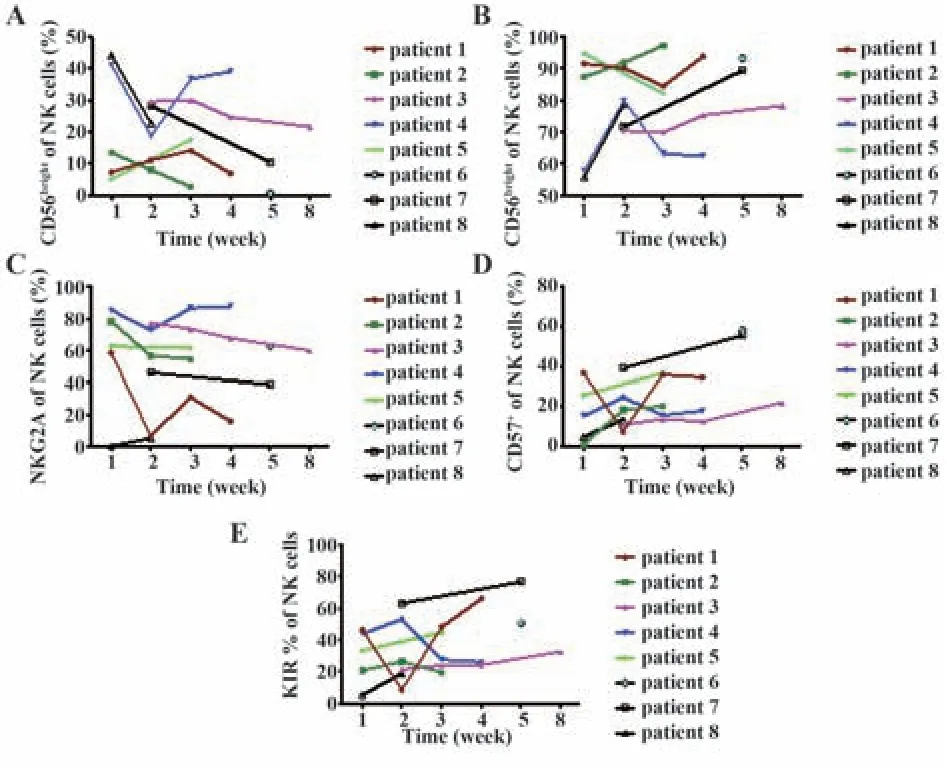
图3 NK细胞回输后体内亚群动力学变化Fig.3 Dynamic changes of NK subsets in vivo post NK cells refusion

图4 回输后无反应和有反应患者不同时间点不同成熟度NK细胞亚群(CD56bright、CD56dimNKG2A+、CD56dimNKG2AKIR-CD57+、CD56dimNKG2A-KIR-CD57-、CD56dimNKG2AKIR+CD57-、CD56dimNKG2A-KIR+CD57+)动态变化Fig.4 Different maturity levels of NK subsets(CD56bright,CD56dimNKG2A+,CD56dimNKG2A-KIR-CD57+,CD56dim NKG2A-KIR-CD57-,CD56dim NKG2A-KIR+CD57-,CD56dimNKG2A-KIR+CD57+)at different time points between patients with response to NK infusion and those without response
2.6 NK细胞回输后的活化型受体及功能动力学变化 NK细胞回输后治疗反应良好病例3、4、5、7的NKG2D、NKp30及NKp46占NK细胞比例均明显高于无反应治疗患者,均在60%以上,且随着移植时间推移,治疗反应良好病例上述水平呈上升趋势。而NKG2C占NK细胞的比例在治疗反应良好组与无反应治疗组未显示差异性趋势。NK细胞治疗有反应病例(病例3、4、5、7)CD107a在NK细胞中的表达趋势明显高于治疗无反应患者。而NK细胞IFN-γ分泌水平在NK细胞治疗后趋势并不明显,NK细胞分泌IFN-γ的水平除病例4在第3周达到峰值,且明显高于其他患者分泌水平,但其在第4周又骤降至基线水平,基本恢复至其他7例在NK细胞治疗过程中的基准(图5)。

图5 NK细胞回输后活化型受体NKG2D、NKp30、NKp46、NKG2C动力学变化及细胞脱颗粒、IFN-γ因子分泌能力变化Fig.5 Dynamic changes of activated receptors NKG2D,NKp30,NKp46,NKG2C and degranulation and secretion of IFN-γafter NK adoptivetransfer
2.7 安全性评价 病例2接受NK细胞治疗前有活动性GVHD和TMA,NK细胞治疗后GVHD和TMA无明显变化,病例3、6的GVHD症状在NK细胞回输治疗后明显缓解,其中1例回输前全身皮肤菲薄,双上肢散在红色皮疹,口腔内多发溃疡,回输后cGVHD活动性症状缓解;另一例移植后慢性GVHD肝脏表现,回输后症状缓解,提示NK细胞治疗可能发挥抗GVHD功能,需进一步研究。
3 讨论
NK细胞是机体重要的天然免疫细胞,无需预先致敏便可识别杀伤肿瘤细胞和病毒感染的细胞,在免疫监视和肿瘤清除过程中起重要作用。HLA半相合健康供者由于缺少部分NK细胞免疫球蛋白受体,部分减弱了抑制性受体对NK细胞功能的影响,可更好发挥肿瘤杀伤能力,因此增强NK细胞功能或过继性回输NK细胞疗法已逐渐成为造血干细胞移植中抗白血病治疗的重要观念[11]。目前研究认为,体内NK细胞与肿瘤细胞效靶比越高,清除肿瘤能力越强。健康人群获取的NK细胞数有限,越来越多体外扩增技术兴起弥补了NK细胞数不足的问题。MASUYAMA等[3]通过CD3联合CD52单抗体外刺激人外周血单核细胞后发现,NK细胞扩增效率高,抗肿瘤功能增强,该体系的建立摒弃了耗时的去T细胞步骤及体外饲养层细胞准备,但该技术扩增的NK细胞在保证安全性前提下是否对人类具有一定治疗效果尚无报道。基于此,课题组对移植后复发或持续MRD阳性患者过继性回输体外供者来源NK细胞,并监测了回输后5周内NK细胞亚群及功能动力学变化,初步探讨以CD3联合CD52单扩增的NK细胞在体内的动态变化及临床疗效。
本研究提示,以CD3联合CD52单抗对NK细胞的体外扩增效率高,杀伤功能强,从目前8例结果来看,有3例MRD阳性患者于NK细胞回输治疗后转阴,1例髓外(皮肤)缓解,但对血液学复发无效,对中枢神经系统白血病复发有待进一步研究。提示NK细胞主要优势是清除体内微小残留病,而对血液学复发患者疗效不佳。ZHAO等[12]在小鼠NCG血液瘤模型中过继性回输经mbIL-21/4-1BBL扩增的NK细胞证实,大剂量和连续多次回输NK细胞有利于肿瘤清除,临床研究也证实,对巩固治疗期间持续微小残留病阳性患者接受氟达拉滨联合环磷酰胺预处理或常规巩固治疗联合单倍型供者来源NK细胞回输可诱导50%~60%微小残留病转阴,且无明显不良反应。虽然MILLER等[2]研究表明过继性NK细胞回输治疗难治复发患者取得了一定疗效,但诱导难治复发白血病患者缓解率也仅有20%~30%,提示NK细胞抗白血病治疗仍有较大提升空间,通过改造NK细胞提高其体内存活时间,或通过多次、高剂量NK细胞回输有望提高NK细胞抗肿瘤能力。
NK细胞活化功能可分为两方面:一是基于NK细胞成熟度而定,随着NK细胞发育分化成熟,细胞杀伤能力逐渐增强;二是取决于其表面活化型受体与抑制型受体平衡。本研究中,NK细胞成熟指标CD57及KIR表达在有反应组均明显高于无反应组,提示肿瘤个体异质性对NK细胞影响不一,也从侧面反映肿瘤负荷减低可能与回输后NK细胞成熟度有关[13]。同时,NK细胞表面活化型受体NKp30、NKp46及NKG2D表达在有反应组均明显高于无反应组,说明NK杀伤能力指标CD107a分泌水平也在有反应组趋势较高,进一步说明回输后活化型受体占比更多的NK细胞在肿瘤细胞患者中预后更好[14-15]。提示肿瘤清除可能与NK细胞功能恢复相关,与KHAZNADAR等[16]报道一致,即NK细胞采用免疫调节剂恢复部分功能后,与AML细胞系接触增多,杀伤作用增强。
移植后复发患者采用过继性NK细胞回输治疗,无不良反应,且2例患者慢性GVHD症状缓解,提示安全性良好,但由于样本量较少,且CD3联合CD52体外扩增NK细胞的策略与目前其他饲养层细胞的扩NK细胞策略是否有明显优越性尚不可知。YANG等[17]通过RNA-seq技术探究两种不同扩增体系的NK细胞转录本差异,发现221-mIL-21饲养层细胞扩增的NK细胞相较K562-mIL-21扩增的NK细胞分化程度更低,记忆性更高,说明不同扩增体系除影响NK细胞扩增效率,也影响扩增NK细胞自身生物学功能。提示后续评估NK细胞治疗效率时,应考虑不同扩增体系对NK细胞的影响。本研究扩增体系提示NK细胞明显活化且组织趋化能力上调,NK细胞表面抑制性受体PD-1、Tim-3、CTLA4及Tigit荧光表达强度明显上调。PD-1、Tim-3、CTLA-4及Tigit是阻断T细胞及NK细胞免疫功能的重要耗竭性受体[18-20]。但也有研究认为Tim-3及Tigit在NK细胞的表达是NK细胞功能活化及成熟的重要指标,因此,需综合评估扩增后NK细胞表面耗竭性受体表达上调对NK细胞功能的影响[21-22]。另外,本研究未充分评估对NK细胞回输后其他免疫细胞如T细胞、B细胞、DC及巨噬细胞等表型及功能,已有研究发现T细胞、DC及巨噬细胞能直接或间接影响NK细胞发育成熟、细胞毒因子分泌功能[23-24]。NK细胞回输后其他免疫细胞是否参与增强有反应组NK细胞功能值得进一步研究。
总之,本研究对CD3联合CD52单抗体外扩增NK细胞后,过继性回输治疗移植复发患者后的免疫学变化进行了初步探讨,临床应用的安全性和有效性尚需扩大样本量及重新设计临床研究进一步探讨。