干燥综合征发病机制相关信号通路研究进展①
刘金坤 王 琴 高洪燕 喻晓雯 冯 婧 白殊同 吴 斌
(重庆市中医院中医药基础研究室,重庆 400021)
干燥综合征(Sjögren's syndrome,SS)是一种全身性自身免疫性疾病,根据发病原因可分为原发性干燥综合征(primary Sjögren's syndrome,pSS)和继发 性 干 燥 综 合 征(secondary Sjögren's syndrome,sSS)。SS在全球不同地区发病率存在较大差异,目前发病率约为0.01%~3.0%[1]。在过去的几十年里,SS相关研究发现的潜在致病通路包括促炎介质、Ⅰ型干扰素(interferon,IFN)系统的激活、抗原呈递、共刺激途径、B细胞和T细胞的激活以及异位生发中心的形成,目前暂未达成统一共识[2]。
为了研究SS可能涉及的机制,本研究以“Sjögren's syndrome&signal pathway”为关键词,系统地检索了截至2020年8月11日的PubMed数据库,共检索到文献281篇。将文献进行分类汇总后得到30条信号通路,使用cytoHubba插件筛选文献中出现频率较高的20条信号通路,得出了前100个hub基因(图1)[3]。然后使用R软件中的clusterProfiler包进行富集分析、通路间的互作分析(图2)[4]。结果发现Toll样受体、干扰素、肿瘤坏死因子及病毒参与的多条信号通路通过相互交叉形成了复杂的信号网络,均与SS的发病机制相关。因此,为更好地阐释SS的发病机制,课题组将对以上相关通路进行综述。
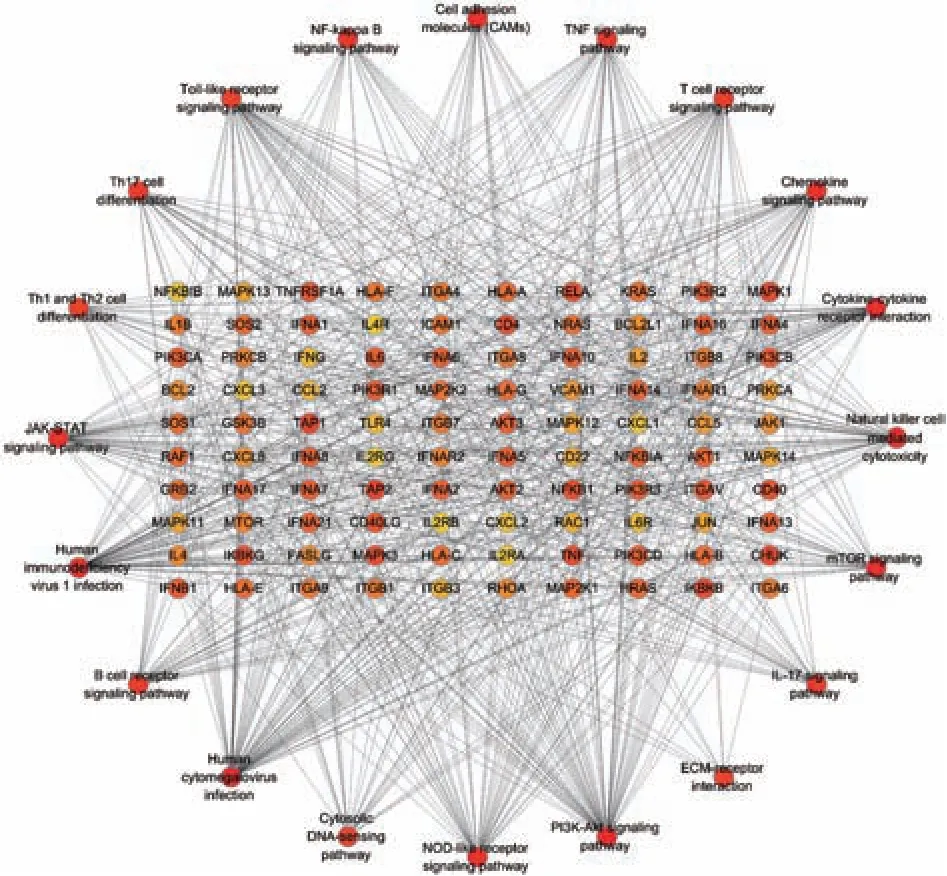
图1 SS疾病通路与基因的关系Fig.1 Relationship between SSpathways and genes
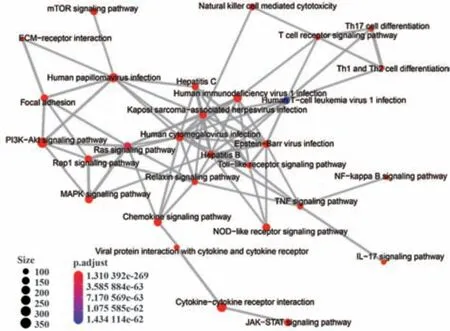
图2 SS信号通路互作网络图Fig.2 SSpathway interaction network diagram
1 Toll样受体信号通路
Toll样受体(Toll-like receptors,TLRs)可识别不同的病原体相关分子模式,并在先天免疫应答中发挥关键作用,是抵御病原入侵的第一道防线[5]。TLRs信号转导通路的激活来源于细胞浆TLR/IL-1受体的结构域,该结构域与接头蛋白髓样分化因子(myeloid differentiation factor 88,MyD88)发生相互作用,最终导致核转录因子-κB(nuclear factor-kappaB,NF-κB)、p38丝裂原活化蛋白激酶(p38 mitogen-activated protein kinases,p38 MAPK)和c-Jun氨基末端激酶激活[5]。另外一条途径被TLR4激活,并触发MyD88和TRIF依赖性促炎细胞因子和Ⅰ型IFN的产生[6]。
TLR3具有诱导SS患者唾液腺上皮细胞(salivary gland epithelial cell,SGEC)凋亡、诱发炎症的双重作用,这些作用被表皮生长因子(epidermal growth factor,EGF)抑制[7]。此外,TLR3的激活会导致B淋巴细胞激活因子(B cell acfivativing factor belonging TNF family,BAFF)mRNA高表达和BAFF蛋白分泌,促进SS病情进展[8]。pSS患者外周血单核细胞(peripheral blood mononuclear cell,PBMC)中TLR-7表达较高,且pSS患者的唾液腺和腮腺上皮细胞中TLR-7上调[9-10]。唾液腺中TLR9的上调可能促进炎症消退,而下调则可能导致免疫激活[11]。
pSS患者唾液腺中高表达TLR2、TLR4、TLR6、IL-17以及与Th17相关的细胞因子,在浸润的单核细胞和导管上皮细胞中可观察到TLR2、TLR4和TLR6的表达,IL-17主要在唾液腺中的CD4+T细胞、脂肪细胞中表达,pSS患者PBMC和小唾液腺中产生IL-17的CD4+T细胞数量显著增加[12]。SGEC可通过激活p38 MAPK、细胞外信号调节激酶(extracellular signal-regulated kinase,ERK)、磷脂酰肌醇3-激酶(phosphalyl inositol3-kinase,PI3K)/蛋白激酶B(protein kinase B,AKT)和NF-κB信号通路,促使IL-17与IL-17R结合诱导细胞分泌IL-6[13]。IL-6通过控制转运蛋白参与血清铁水平的调节,诱导铁调素生成,阻止铁转运蛋白的吸收,从而降低血清铁水平,造成SS症状中常见的低铁血症和贫血[14]。TLR2可通过IL-6、信号转导和转录激活因子3(signal transducer and activator of transcription 3,STAT3)和NF-κB诱导IL-23、IL-17的产生[15]。IL-17可通过刺激SGEC上调IL-6 mRNA和蛋白表达,IL-17或IL-17R中和抗体会阻止这种作用[13]。在类风湿中IL-17通过上调IL-1β和IL-6加剧炎症,并增加滑膜中TLR-2表达[16]。课题组推测pSS中可能存在TLR2/IL-17/IL-6相互作用,因此,通过抑制IL-6可减少全身和局部炎症、B细胞活化、浆细胞形成和自身抗体的分泌。
2 IFN信号通路
细胞膜和内体上的TLRs可识别病毒和其他微生物,DNA或RNA与内体TLRs结合会产生信号。TLRs通过MyD88激活下游转录因子,包括干扰素调节 因 子7(interferon regulatory factor 7,IRF7)和NF-κB亚基p50和p65,这些转录因子易位至细胞核并诱导IFN的转录表达[17-18]。IFN主要分为3类:Ⅰ型或非免疫IFN主要由白细胞产生的α干扰素(IFN-α)和成纤维细胞产生的β干扰素(IFN-β)组成,是参与病毒防御和免疫应答激活的关键免疫介质;Ⅱ型或γ干扰素主要由NK细胞和T细胞产生;Ⅲ型由λ干扰素组成[17]。
SS患者唾液腺上皮细胞中IFN-α和IFN-β(均属于Ⅰ型IFN)诱导上调主要组织相容性复合体(major histocompatibility complex,MHC)分子和共刺激分子(如B7和CD40)表达,吸引T细胞和趋化因子(如CXCL10、IL-8和CXCL13),促进炎症环境发展,导致更多先天免疫细胞的募集,并最终推动生发中心结构的形成[8,19]。这些唾液腺上皮细胞获得抗原呈递特征,介导浸润性炎症细胞的募集、激活和分化[19]。唇腺浸润的免疫细胞学结果说明较轻的病变以CD4+T细胞浸润为主,而较严重的病变以B细胞浸润为主[20]。IFNα也可诱导SS患者唾液腺组织促凋亡分子Fas和FasL、caspase-3表达增加,进一步加剧炎症反应[7]。
SS患者唾液腺或外周血中均存在IFN上调,外周血基因表达谱表明大多数IFN诱导基因的表达水平与抗Ro/SSA和抗La/SSB自身抗体的滴度呈正相关[21]。浆细胞样树突状细胞(plasmacytoid dendritic cell,pDC)被认为是IFN表达的主要来源,IFN信号的激活有助于淋巴细胞浸入外分泌腺、自身抗体产生和腺细胞凋亡[22]。IFN-α的持续生成是由含RNA的免疫复合物引起的,该复合物激活pDC以促进IFN-α产生[19]。pSS患者的PBMC和小唾液腺活检中IFN活性增强,与IRF5和STAT4的多态性有关[23]。检测IFN阳性的pSS患者体内pDC和单核细胞中TLR7上调,而TLR9没有上调,下游信号分子MyD88、RSAD2和IRF7及细胞质RNA感应受体DDX58/维甲酸诱导基因Ⅰ(retinoic acid inducible gene-Ⅰ,RIG-Ⅰ)和黑色素瘤分化相关基因5(melanoma differentiation-associated gene 5,MDA5)均被上调[24];检测IFN阴性的患者TLR7表达正常,TLR9、RIG-Ⅰ和MDA5下调[24],这些基因在SGEC中受IFN调节。
3 Janus激酶信号转导与转录激活子信号通路
TLR途径的激活导致IFN-α和IFN-β的产生增多,并通过上调MHCⅠ进一步诱导适应性免疫应答介导信号转导[25],IFN与其受体的结合激活Janus激酶-信号转导与转录激活子(Janus kinase-signal transducer and activator of transcriptions,JAK-STAT)通路,然后磷酸化二聚体STAT蛋白易位到细胞核中启动转录,加剧炎症反应[8]。另外,IL-6与IL-6R结合可诱导糖蛋白130(glycoprotein 130,gp130)同源二聚化激活,并触发下游JAK-STAT3和JAKMAPK信号通路激活[14]。JAK2与红细胞和血小板的生成直接相关,且JAT/STAT通路参与红细胞生成素、血小板生成素及粒细胞集落刺激因子调控,影响免疫系统和造血功能[26]。推测SS患者中出现的贫血、血小板和白细胞减少与JAK-STAT通路相关。
pSS患者IFN基因表达与T细胞中IFN-α2b诱导的STAT3 S727的磷酸化呈负相关,与B细胞的pSTAT1 Y701呈 正 相 关[27]。TLR7和TLR9刺 激STAT3 S727和NF-κB与IFN,导致pSS患者外周血B细胞的信号转导潜能增强。STAT3 S727和NF-κB信号转导增强的患者可受益于靶向这些通路的疗法[28]。在泪腺中缺失IκB-ζ或其转录调节因子STAT3的实验小鼠可发展为SS样自身免疫病,出现眼周淋巴细胞性皮炎、结膜炎和泪腺炎及SSA和SSB自身抗体[29]。STAT4可被多种细胞因子激活,包括IL-12、IFN-α、IL-23、IL-2、IL-27和IL-35等[30]。当暴露于病毒双链RNA时,STAT4促进视黄酸诱导基因1(retinoicacid-induciblegene1,RIG-1)产生Ⅰ型IFN。选择性JAK1/2抑制剂巴瑞替尼可通过抑制JAK-STAT信号通路进而降低小鼠唾液腺导管细胞中IFN-γ诱导的CXCL10的产生,可缓解小鼠唾液腺损伤。该研究提示巴瑞替尼可能成为pSS患者的潜在治疗药物[31]。
4 肿瘤坏死因子信号通路
肿瘤坏死因子(tumor necrosis factor,TNF)是一种多功能促炎细胞因子,对脂质代谢、凝血、胰岛素抵抗和内皮功能有影响,TNF受体主要是跨膜蛋白,参与炎症、细胞凋亡、自身免疫等[32]。TNF受体1(TNFreceptor 1,TNFR1)在所有人体组织中表达,是TNF-α的主要信号受体,TNFR2主要在免疫细胞中表达,可结合TNF-α和TNF-β[33]。TNFR1和TNFR2通过3种不同的信号途径引起对TNF-α的细胞应答,导致caspases的活化及AP-1和NF-κB转录因子的活化[34]。
TNF-α通过下调紧密连接蛋白claudin-1表达促进唾液腺组织屏障功能的破坏,抑制水通道蛋白5(aquaporin 5,AQP5)表达(AQP5是唾液分泌所需的水通道蛋白),进而导致唾液分泌减少[35]。唾液上皮细胞中RvD1(resolvin D1)受体的激活可减弱或消除TNF-α引起的紧密连接和细胞骨架破坏,促进唾液上皮的炎症消退和组织修复,这可能与唾液腺功能障碍的恢复有关[36]。
TNF超家族成员BAFF和CD40L在B细胞的存活、激活及体液免疫调节中发挥关键作用。促炎性细胞因子BAFF促进腺体炎症、诱导B细胞的存活和成熟,并在多种类型的细胞(如T细胞、树突状细胞、巨噬细胞)中表达[37]。T细胞上的CD40L与B细胞的CD40结合,从而引起B细胞活化[38]。IL-1β、TNF-α或TLRs在炎症信号转导途径中激活转化生长因子β激活激酶1(TGF-βactivated kinase-1,TAK1),进而激活NF-κB和MAPK信号通路,因此,抑制TAK1可能也有助于SS的治疗[39-40]。
5 NF-κB信号通路
NF-κB是一种二聚体蛋白,由Rel家族5个成员的同型和异二聚体组成,NF-κB转录因子家族主要参与应激诱导的免疫和炎症反应[41]。促炎细胞因子IL-1和TNF是NF-κB的激活剂,NF-κB激活后易位到细胞核启动转录,促进炎症介质IL-6、IL-8、TGF-β等生成,从而调节炎症[17]。NF-κB不仅可以通过增加炎症细胞因子、趋化因子和黏附分子的产生调控炎症,还可通过调节细胞增殖、凋亡、分化促进炎症发展[41]。
在SS患者中观察到炎症基因表达谱与TNF-α转换酶(TNF-αconverting enzyme,TACE)、TNF-α信号转导的途径在NF-κB上汇聚,从而加剧了疾病[42]。用抗Ro/SSA抗体处理SGEC会导致NF-κB亚基p65蛋白-DNA结合显著增强,表明SS抗Ro/SSA抗体通过触发TACE/TNF-α/NF-κB轴发挥其致病作用。在SS患者的单核细胞中,IRAK1的转录被抑制,而另一个NF-κB通路调控基因TRAF6被过表达,TRAF6可作为SS的特定生物标志物[42]。
6 PI3K-AKT信号通路
磷脂是影响下游免疫代谢途径的关键第二信使,PI3K可将PIP2转化为PIP3,其作为第二信使激活AKT[43]。PI3K活性诱导多种信号通路参与调节细胞功能,包括AKT、PDK1、雷帕霉素敏感的mTORC1和不敏感的mTORC2,mTORC1的关键底物是核糖体蛋白S6激酶(ribosomal protein S6 kinase,pS6),可作为活化PI3K-mTOR信号通路的标志[43]。
SS患者主要代谢途径的改变与磷脂、脂肪酸和氨基酸代谢有关,特别是色氨酸、脯氨酸和苯丙氨酸的代谢[44]。SS患者唾液上皮细胞中EGFR和AKT的磷酸化以及NF-κBp65的核表达增加,EGF通过刺激PI3K-AKT途径和NF-κB,从而促进SS唾液上皮细胞病变[45]。pS6在pSS患者唾液腺中上调,pS6与T细胞、B细胞标志物和浸润腺体的CD138+浆细胞共定位[46]。mTOR为PI3K-AKT信号通路下游分子,其激活可导致Th1和Th17增殖、Treg耗竭、浆细胞分化、巨噬细胞功能障碍及抗体和免疫复合物产生增加,最终导致唾液腺组织炎症[46]。雷帕霉素和N-乙酰半胱氨酸对mTOR的抑制作用在小鼠模型和临床试验中均有疗效,基于mTOR阻滞的疗法在SS中起到一定作用[47]。
7 病毒相关的信号通路
病毒感染是pSS的重要诱因之一,感染识别与IFN信号通路有关,后者通常在pSS患者中上调,进而调控MAPK和PI3K信号通路[48]。病毒相关的主要信号通路包括病毒蛋白与细胞因子和细胞因子受体的相互作用(hsa04061)、病毒致癌(hsa05203)、EB病毒(epstein-barr virus,EBV)感染(hsa05169)、人巨细胞病毒感染(hsa05163)、甲型流感(hsa05164)、丙型肝炎(hsa05160),目前已经证明了EBV在SS中发挥作用[49-50]。病毒感染或IFN-α刺激后,唾液腺上皮细胞被异常激活并分泌趋化因子CCL9、CXCL10、CXCL13等,从而促进淋巴细胞聚集[51]。pSS患者PBMC中IFI27、IFI44、IFI44L、IFIT1、IFIT3、IRF7表达水平上调,与甲型流感、丙型肝炎病毒、乙型肝炎病毒、EBV和单纯疱疹病毒等密切相关[52-56]。
人嗜T-淋巴病毒1型(human T-lymphotropic virus 1,HTLV-1)可通过上调SGEC分泌的炎症细胞因子和趋化因子水平感染SGEC[57]。在50%的被评估的pSS患者中,D型肝炎病毒(hepatitis delta virus,HDV)含量增加,HDV抗原的表达导致唾液流量减少、局灶性淋巴细胞浸润增加及自身抗体形成[58]。丙型肝炎病毒(hepatitis Cvirus,HCV)感染占混合型冷球蛋白血症(mixed cryoglobulinaemi,MC)的大部分,系统性红斑狼疮(28.9%)和SS(10.7%)是MC的主要原因[59],SS患者(尤其是肝炎和冷球蛋白血症患者)应筛查HCV感染,因为是否存在HCV时的治疗方法不同。
8 展望
SS涉及免疫、炎症、氧化应激、生物功能和神经生理异常。近十年来,研究者通过基因芯片、高通量测序技术,对数千名SS患者及对照者进行全基因组研究,并获得了大量数据[60]。将这些信息整合起来能更好地认识SS关键信号通路及异常的免疫调控机制。本研究通过以上SS相关通路的分析,发现TLR、IFN、JAL-STAT、TNF、NF-κB、PI3K-AKT等通路相互作用、相互影响。希望未来对通路部分靶点深入研究,开发出新的药物和个性化医疗手段,达到精准治疗的目的。