太空飞行神经眼综合征的生物力学因素研究进展
王晓飞 刘亭亭 樊瑜波*
1(生物力学与力生物学教育部重点实验室,北京 100083)
2(北京市生物医学工程高精尖创新中心,北京 100083)
3(北京航空航天大学生物与医学工程学院,北京 100083)
引言
目前全球已有超过550 名宇航员参与过太空飞行[1]。太空飞行对人体的生理功能有着显著的影响,持续的微重力环境可导致宇航员出现骨骼损失、肌肉退化、心血管系统功能降低和前庭功能障碍等症状。除了上述问题,近些年,人们发现宇航员长期太空飞行后普遍出现包括视盘水肿、视神经蛛网膜下腔增宽、眼球变平、脉络膜褶皱、视神经屈曲等眼和视神经的结构以及相应的功能变化,且部分宇航员的视力受损是永久性的[2]。
美国航空航天局(National Aeronautics and Space Administration,NASA)针对国际空间站中连续飞行6 个月的7 名男性航天员的详细眼科检查发现,这7 名航天员均出现了各种类型的眼部结构改变;且这些症状均由太空飞行导致,而非起飞、重返大气层和降落所致[2]。这些症状最初被定义为视觉损害颅压综合征( vision impairment and intracranial pressure syndrome),之后于2017年重新定义为太空飞行相关神经眼综合征(space flightassociated neuro-ocular syndrome;SANS)[3-4]。NASA针对1989年后执行过太空飞行任务的另外300 名航天员的调查问卷显示,短期太空飞行(航天飞机任务,约2 周)导致视力下降的几率较低(约23%),而长期太空飞行(空间站任务,约6 个月)的几率则显著增大(约48%)[2,5]。SANS 已在国际空间站的宇航员中显现,在未来太空探索任务(包括火星任务)中会更加突出。近地轨道(空间站)长期驻留、深空探索、月球登陆和星际旅行等活动被NASA 分类为SANS 的中高风险危险因素[6]。因此,SANS 被认为是未来太空探索计划中最为关键的健康科学问题之一[7]。SANS 的具体发病机理尚待阐明,目前学者们认为此与失重状态下视神经蛛网膜下腔脑脊液 压 ( optic nerve subarachnoid space cerebrospinal fluid pressure; ON-CSFP)升高导致的视乳头生物力学环境变化有关。此外,针对SANS的相关研究技术和成果也可以服务于青光眼等其他眼病的诊疗创新[8],因此SANS 成为目前眼生物力学中一个非常活跃的研究方向[9-11]。
文中针对SANS 中眼部解剖结构的改变以及力学因素在其中的可能作用进行综述,以期为SANS的发病机理研究、其防护措施的开发以及相应航天员遴选标准的建立提供参考。
1 SANS 中眼部的形态学改变
关于长期太空飞行航天员眼部组织的结构改变,公开发表的数据主要为NASA 资助的研究成果,其采用磁共振成像(magnetic resonance imaging;MRI)、光学断层扫描(optical coherence tomography;OCT)和眼底检查等手段来评估国际空间站中航天员飞行前后的眼部结构的变化。NASA 资助的研究结果表明,SANS 常见的症状包括视盘水肿、眼球后部扁平[12]、视神经蛛网膜下腔增宽[13]、脉络膜褶皱[2](见图1)和视神经纽结等。在眼睛形态学改变的同时,微重力也可导致眼睛的功能学改变[14],包括视觉电生理改变[15]和视觉追踪能力下降[16]等,相关内容张晨晨等[14]已有详细介绍,在此不再赘述。
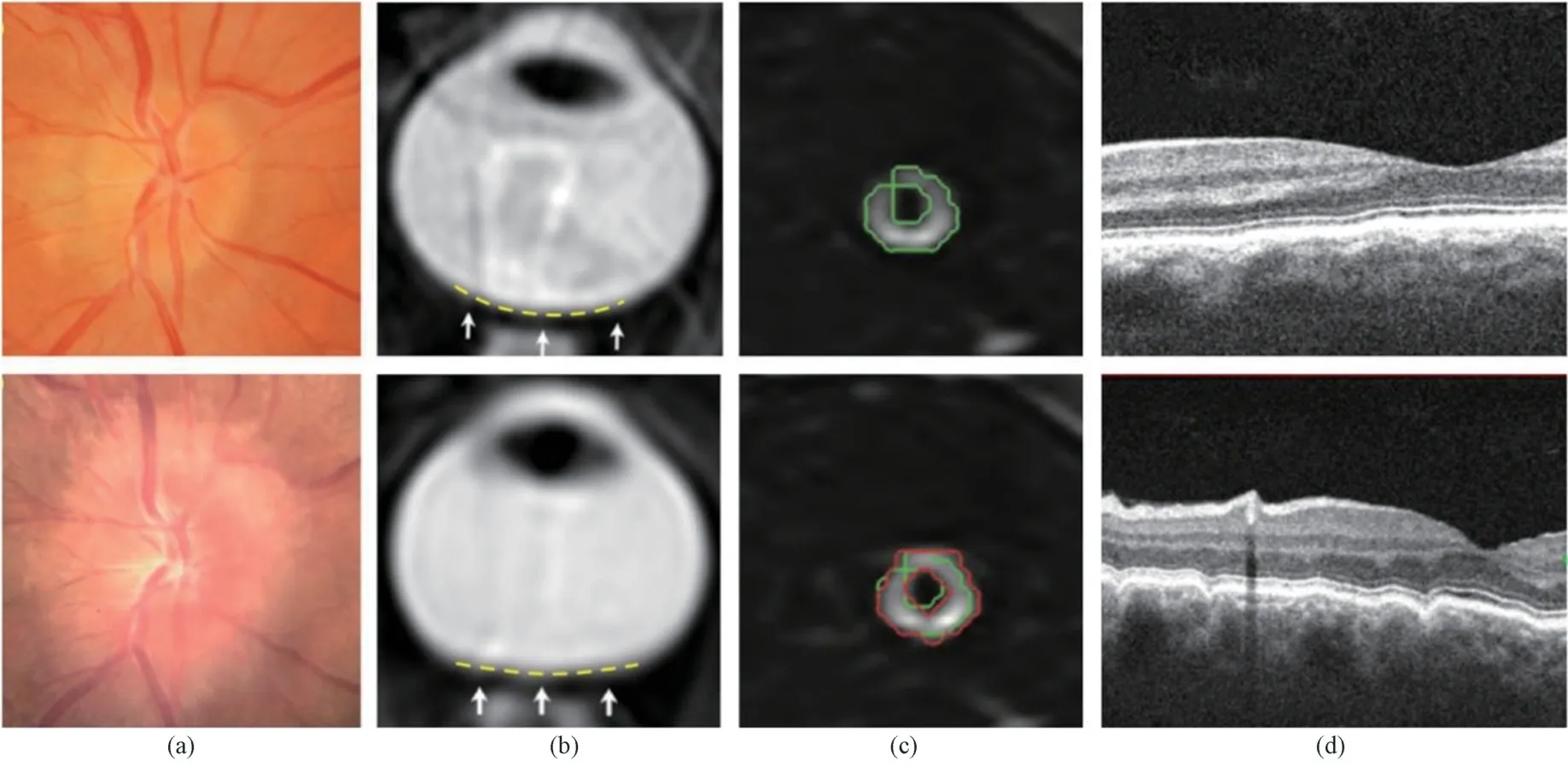
图1 航天员太空飞行前后眼部结构的改变(第一行为飞行前图像,第二行为飞行后的图像)。(a)航天员太空飞行前后拍摄的眼底照片,飞行后产生了视盘水肿现象[2];(b)航天员太空飞行前后进行核磁共振成像,飞行后眼球后部变扁平[2];(c)航天员太空飞行前后进行磁共振成像,飞行后蛛网膜下腔增宽[12];(d)航天员太空飞行前后进行采用光学相干断层扫描成像,飞行后产生了脉络膜褶皱现象[2]Fig.1 The changes of eye structure of astronauts before and after space flight (Top panel are pre-flight images and the bottom panel are post-flight images). (a) Fundus images show that optic disc edema after flight[2];(b) Magnetic resonance imaging showed the posterior eyeball was flattened after space flight[2]; (c) Magnetic resonance images show that the subarachnoid space was widened after space flight[12]; (d) Optical coherence tomography images show that choroidal folds occurred after the flight[2]
研究表明,在长期太空飞行任务后,约40%的宇航员发生了眼球后部变平[17],且部分航天员返回地面7年后仍不能恢复[18],表明眼部结缔组织已发生永久性的重塑。在长期任务中,60%的宇航员都发生了视神经鞘的扩张,20%的宇航员发生了视神经的扭折[17];在短期任务中,两者的几率分别为42%和8%,但也有研究指出视神经的扭折不明显[19]。Wahlin 等[20]对22 名宇航员进行了太空飞行前后的MRI 扫描成像,在图像上绘制了代表视神经的中心线,通过中心线记录视乳头和视交叉末端的位移。研究显示,太空飞行后出现视神经增长(0.80±0.74)mm、视乳头上移(0.63±0.53)mm 和视交叉上移动(0.39±0.50)mm,视乳头上移与SANS 的症状呈正相关,但视交叉上移与SANS 严重程度无关。太空飞行后宇航员的脑部也出现脑位置上移和中央勾变窄[21]、脑室体积增大[22,24]等现象,提示长期太空飞行的宇航员存在颅压升高的情况。磁共振扫描结果[13,17]表明,大多数航天员眼睛的结构变化是对称的,但也有双眼的非对称改变情况,可能为ON-CSFP 的非对称升高所致[25]。
Patel 等[26]记录了15 名执行过国际空间站长期飞行任务(约6 个月)航天员飞行前后的眼部OCT 图像,使用Matlab 进行数据分析,手动标记Bruch 膜开口(Bruch's membrane opening;BMO)拟合椭圆作为测量的参考,按照一定的距离构建环形区域,测量视网膜总厚度和神经纤维层厚度。研究表明,长时间飞行任务后,视网膜总厚度和神经纤维层厚度都增加,但脉络膜厚度没有变化,同时此研究也发现Bruch 膜开口的位置与飞行前无显著性差异。在上述采用MRI 和OCT 的研究中,飞行后的临床影像采集是在航天员回到地面一定时间(6 ~57 d)后进行的[2,12],此时太空飞行导致的眼部症状可能已经部分或者全部恢复,因此这些结果不能完全如实的反映航天员太空飞行期间眼睛真实结构改变的严重程度。NASA 于2013年在国际空间站安装了OCT 设备(Spectralis, 海德堡,德国)并于2018年末进行了更新,以便于在太空中对宇航员进行评估。2020年公开发表的论文已经使用了OCT 在太空飞行之前、期间和之后对所有机组人员进行了OCT 径向扫描(B 扫描)和环形扫描。对于径向扫描,使用Matlab 手动标记BMO 拟合椭圆,从距离BMO 一定距离的环形区域计算视网膜厚度;对于环形扫描,手动定义脉络膜和巩膜之间的交界处并用于计算脉络膜厚度;结果表明太空飞行中视网膜增加了27.6 μm,脉络膜厚度增加了43 μm[27-28],同时视乳头部位的Bruch 膜开口最小盘沿宽度(minimum rim width)也显著增加37.5 μm[28]。
2 SANS 的可能发病机理
SANS 的具体发病机理至今尚待阐明,这阻碍了有效防护措施的研发,也无法建立个体易感性评估指标以及相应航天员的遴选标准。目前猜测SANS 可能是由于人在失重环境下大量的液体向头部及上半身集中,引起颅压升高,继而引发ONCSFP 升高,导致作用在视乳头上的压力梯度改变,从而引起视乳头的解剖结构变化及相应的眼部症状发生,进一步影响视觉功能。在地面上,人每天有三分之二的时间处于直立状态,从而适应了较低的24 h 平均颅压和较大的颅压日波动[29]。在太空中,当重力作用失去后,体液向头部和上半身转移,产生头部和颈部静脉淤血;而淤血则会引发脑脊液进入静脉系统受阻和静脉充血,导致颅压升高[25]。同时体液的上移也可能会导致淋巴系统循环受到影响,从而造成SANS[30]。
先前的研究发现回到地面后宇航员的脑脊液压较正常人高,对于4 名视盘水肿的宇航员分别在术后60、19、12、57 d 进行腰椎穿刺,发现脑脊液开放压力分别为22、21、28、28.5 mmH2O[2]。同时针对航天员太空飞行前后的脑部和眼睛的临床影像资料分析发现,眼睛和脑部结构变化特征与地面颅压升高患者具有一定的相似度。目前尚未有太空飞行中航天员颅压测量的数据。Lawley 等[31]利用抛物线飞行实现了真正失重状态下的颅压测量(通过受试者植入的Ommaya 囊进行测量),发现失重状态下颅压[(13±2)mmHg],低于仰卧位颅压[(15±2)mmHg],但高于直立状态颅压[(4±1)mmHg];提示如果长期处于微重力环境,24 h 平均颅压高于地面情况。但此研究采用抛物线飞行,每次失重状态仅能维持20 s,且飞机爬升过程的加速度可导致体液重新分配,与航天员长期太空飞行的状态差别较大。除微重力外,其他的可能导致颅压升高的因素包括:1)叶酸和维他命B12 相关的一碳单元转移缺陷[32];2)空间站中较高的二氧化碳浓度[33-34];3)空间站饮食中较高的钠含量[35]。但这些因素目前都缺乏充足的证据。需要指出的是,由于视神经蛛网膜下腔与颅内的联通存在一定的阻力[36,38],颅压并不等于ON-CSFP,但两者存在正相关性[39]。
3 SANS 中视乳头的受力及变形规律
在SANS 中,视乳头(图2)是一个非常关键的部位,其在力作用下的变形是影响视觉功能的关键因素,如视乳头部位筛板的变形会直接地(压迫神经纤维)或间接地(影响血液微循环或类淋巴系统循环)导致视网膜神经节细胞的凋亡,从而造成视野缺损。因此,理解视乳头部位的结构改变规律对于SANS 至关重要。目前针对SANS 中ON-CSFP 升高导致的视乳头结构改变已有一些初步的仿真研究[9,40]和临床影像评估[12,26]。

图2 视乳头结构示意图及其在受力状态下的变形方式(为了显示效果,图(e)和(f)中的变形为实际变形的5倍)。(a)人眼结构示意;(b)采用光学相干断层扫描获取的视乳头截面图;(c)筛板结构,视神经纤维从筛孔穿过;(d)视乳头基线形态示意,眼压和ON-CSFP 分别作用于视乳头上;(e)有限元模拟眼压升高导致的视乳头变形;(f)有限元模拟ON-CSFP 升高导致的视乳头变形Fig.2 Schematic diagram of the optic nerve head and its deformation patterns under various loadings (The deformations in figure (e) and figure (f) are 5 times of the actual deformations for the purpose of display). (a)Schematic diagram of human eye structure; (b) Section of the optic nerve head obtained by optical coherence tomography (OCT); (c) The structure of lamina cribrosa, optic nerve fibers pass through the pores of lamina cribrosa; (d)~(f) Schematic diagram of the optic nerve head at baseline, under intraocular pressure (IOP)elevation and under ON-CSFP elevation, respectively
视乳头部位作用着两个主要的压力(见图2),分别为眼内压和ON-CSFP,两个压力相互作用,即为跨筛板压力差或眼颅压梯度。眼颅压梯度的异常引起的眼部结构改变会导致视网膜神经节细胞受损和视力损伤,这在正常眼压性青光眼中已被证实,Yang 等[41]对猴子进行腰椎脑脊液分流术降低其颅内脑脊液压力,利用OCT 对视神经头和视网膜神经纤维层进行成像,研究结果表明视网膜神经纤维层厚度逐渐减少12%~30%,神经视网膜边缘面积和体积减少,杯盘面积比增加,表现出典型的青光眼结构改变。由于在整个研究期间,眼压处于正常范围内,表明仅低ON-CSFP 就可能导致视网膜神经节细胞损伤和丢失,因此低ON-CSFP 可能是包括青光眼在内的视神经病变的危险因素。
采用动物的在体实验可以直接对颅压进行调控,来研究眼部组织在急性颅压升高下的变形。Morgan 等[42]针对活体狗眼使用共聚焦激光断层扫描研究眼压和ON-CSFP 对视乳头运动和筛板位移的影响,结果表明颅压从0 升高到15 mmHg 导致的筛板位移方向与眼压升高相反,在仅ON-CSFP 增加2 mmHg 或者仅眼压降低5 mmHg 时,筛板部分区域就有高达128 μm 的位移,表明单位颅压的影响大小要高于眼压。而采用恒河猴的在体实验表明,颅压和眼压两个因素交互作用非常明显,特别是颅压较高时,眼压的微小升高即可导致筛板的较大变形[43]。Fazio 等[44]采用新鲜尸体使用OCT 设备对患有开角型青光眼脑死亡患者的眼睛进行成像,并通过数字体积相关技术进行应变计算,研究发现眼压恒定颅压升高时视乳头的总体应变减少了0.001 4,但此研究只有一个受试者,其结果不具代表性。采用离体眼球的体外实验则可以直接调控ON-CSFP 和眼压,Feola 等[9]对离体猪眼在眼压恒定的情况下对ON-CSFP 进行调控,使用同步辐射相衬计算机断层扫描(PCμCT)对猪眼的后节以及筛板后端的视神经组织进行成像,使用三维数字体积相关技术计算随着ON-CSFP 升高而导致组织变形的大小,结果表明相较于4 mmHg 的基线,ON-CSFP升高至30 mmHg 导致筛板变形的第一主应变为4.4%、筛板后端视神经组织变形的第一主应变为9.5%,ON-CSFP 升高与相关区域变形增加成正相关。然而,ON-CSFP 从4 mmHg 升高至30 mmHg 导致筛板变形的第三主应变为-3.5%,而眼压从6 mmHg 升高至30 mmHg 导致筛板变形的第三主应变为-15%,结果表明在视乳头组织压缩变形方面,眼压的影响较ON-CSFP 更为显著。
目前针对SANS 的地面在体研究主要采用头低位卧床实验来模拟微重力状态下体液的重新分布。受试者需要严格头向下倾斜6°, 卧床休息14、30、70 d,所有日常活动都严格在该位置进行,允许受试者将头部抬高到肘部,以防止在进餐期间发生窒息危险。利用OCT 图像量化视乳头周围视网膜厚度,长期卧床实验可导致视盘旁视网膜总厚度的增加[27,45-46]甚至产生视盘水肿[27,47],这与航天员太空飞行后的症状部分相符。这些研究中的定量分析主要是评价视乳头部位组织的平均厚度改变,不能全面反映组织的局部变形方式和量级,并且无法区别量级较小的视乳头变形特征。采用在体的视乳头三维应变追踪方法[48-49]提取在不同载荷情况下拍摄的两个OCT 体积之间的局部3 D 组织位移,可有效评估视乳头在各个部位的变形规律,有希望应用于个体对颅压变化敏感性的测量。
4 影响SANS 易感性的可能因素
眼球和视神经作为一个复杂的力承载结构,其在力作用下的变形取决于本身的几何形态和材料属性。其中,视神经鞘(硬膜)、巩膜和筛板作为结缔组织,是眼睛的主要受力结构,是决定视乳头变形的关键因素。巩膜和筛板对视乳头变形的影响已有大量研究[50,52],筛板内的纤维成径向分布,视乳头周围巩膜中的胶原纤维形成围绕筛板的同心环,并在距巩膜一定距离(400 ~500 μm)处表现出极高的各向异性,其纤维分布方向对眼压作用下的筛板变形有重要影响[53],环形分布能降低筛板的应变,为视乳头组织提供了机械保护。
然而,目前对于视神经鞘的研究较少,仿真结果表明,视神经鞘是影响视乳头变形的一个非常重要因素[54,57],有研究表明视神经鞘刚度对筛板变形的影响甚至比ON-CSFP 影响更大,但尚未有实验研究验证这些仿真预测的结果。研究表明,视神经鞘直径在加压过程中的变化速率与阈值压力和饱和压力直接相关,当ON-CSFP 低于阈值压力时其直径无明显变化;随着压力的增大,视神经鞘变形能力下降,压力升高不能进一步导致其直径明显增大,此时即为饱和压力[58]。由于视神经鞘的材料非线性[55],当ON-CSFP 升高到一定程度后,视神经鞘切线弹性模量增大,少量的脑脊液增多便会引起ONCSFP 的大幅升高并压迫视乳头。因此,视神经鞘在压力作用下的变形可能是人体对抗视神经蛛网膜下腔脑脊液增多的一个缓冲机制[59-61],由于个体的视神经鞘厚度及材料属性不同,导致部分人更容易受到SANS 中视神经蛛网膜下腔脑脊液增多的影响。前期针对猪视神经鞘的材料属性研究表明[55,62],视神经鞘中含有大量胶原纤维,纤维的分布方式在很大程度上决定了其材料非线性特性,但人视神经鞘的材料刚度、其胶原纤维的分布排列方式及其在ON-CSFP 作用下的变形规律、视神经鞘与巩膜和筛板的交互作用对视乳头变形的影响规律等问题都尚待研究。
5 SANS 的应对措施
针对SANS 目前尚缺乏具体有效的应对措施。下体负压可减少体液的重新分布,其应用于研究微重力的影响已有较长时间,是目前研究的热点[63-64]。前苏联从礼炮一号空间站开始便应用下体负压装置用于航天员的日常训练和健康监测,目前俄罗斯航天员仍在国际空间站使用下体负压对抗装置,称为Chibis[65]。这种对抗装置没有移动性,需要用户始终连接到固定的真空和壁挂式电源。然而,每天在运动设备上保持静止1 ~2 h 会牺牲机组人员在操作和科学相关任务上的关键时间。Ashari 等[66]研发了一套轻便下体负压装置,受试者在-20 mmHg 时产生了舒适的90°膝关节屈曲,同时仍产生了大约41%的总体重的对抗力,从受试者舒适度和对抗微重力效果来看,20 mmHg 的负压是一个较好的选择。
也有研究从降低眼颅压梯度方面来考虑SANS的应对措施,研究表明采用有氧运动可有效降低眼颅压梯度[67],佩戴泳镜可使眼压升高,从而可能有效地对抗颅压的升高[67],但由于眼压和ON-CSFP同时升高,可能导致筛板孔变形和相应的视神经纤维受损[68];采用动物实验的研究指出,在高颅压的情况下升高眼压会造成对比敏感度的异常[69],因此升高眼压的有效性和安全性值得进一步探讨。
6 结论与展望
尽管在过去的十几年中针对SANS 已有较多研究,但仍有大量问题尚待阐明。随着我国空间站的发射建设和未来更长远的太空计划的实施,SANS的相关研究也亟待开展,以为开发有效防护措施和航天员遴选标准制定提供依据。在太空中进行无创颅压测量[70]或者远程指导的有创颅压测量[71],将有助于确认长期太空飞行对颅压的影响规律和量级。地面模拟的动物实验如经典尾部悬吊大鼠模型已被证明可重现部分SANS 的症状[72,74],可以作为探索SANS 机制的工具。地面模拟的人急性或慢性ON-CSFP 升高已广泛用于SANS 的研究[75];需指出的是,地面模拟的压力升高与太空飞行中长期压力变化作用有所不同,但它是理解ON-CSFP 升高状态下眼部组织对机械力反应的第一步,可识别导致SANS 的危险因素及易感性评价指标,为更复杂的临床实验和天基实验奠定基础。探索ON-CSFP升高导致的视乳头在宏观和微观层面的变形特征,研究其影响因素和因素间的交互作用,对于理解压力的作用规律至关重要。视神经鞘的宏观和微观结构、顺应性,及其与巩膜和筛板的交互作用对视乳头变形的影响是揭示SANS 易感性的一个有希望的方向。

