高原青稞酒的功能性酿造微生物及代谢产物研究
陈占秀,李善文,黄和强,祁万军,车富红,孔令武,冯声宝
(1.中国青稞酒研究院,青海互助 810500;2.青海互助天佑德青稞酒股份有限公司,青海互助 810500)
白酒的酿造方式是多微共酵,科学认识各种微生物在白酒中的作用,对于阐明白酒中复杂物质的来源,科学提高白酒品质与内涵,提升白酒安全性有着非常重要的意义[1]。由于白酒酿造中微生物种类和数量关系的不同,在白酒生产发酵过程中的代谢产物也不同,加上地域、气候、环境等条件的差异,各白酒生产企业酿造中微生物种类及数量存在较大差异,形成了风格风味迥异的白酒产品[2]。以青稞为原料,中低温大曲为糖化发酵剂的青稞酒产地位于青海省互助县,青藏高原上独特的地理环境造就了独特的微生物环境,赋予了青稞酒独特的风格特点。青稞酒酿造采用“清蒸清烧四次清工艺”,具有区别于绝大多数以高粱为原料酿造酒的独特工艺特点,也就是“种酿合一”“曲粮合一”和“岩木合一”,即酿酒原料种植基地和酿造基地高度合一,酿酒原料和制曲原料高度合一,发酵窖池采用天然的昆仑山花岗岩为壁,祁连山松木板为底,这些独特的优势,赋予了青稞酒区别于其他白酒的典型风格。
白酒中的风味物质主要是由发酵过程中微生物群落代谢生成,研究青稞酒酿造微生物和代谢,有助于解析青稞酒的风味信息。关于传统清香型白酒发酵微生物菌群的研究已有报道,多数研究采用微生物纯种培养技术,研究发酵机理并分离获得功能性微生物,发现了包括扣囊腹膜孢酵母、红曲霉、芽孢杆菌、乳酸菌、白地霉等菌株[3-6]。纯培养技术局限性较大,现代酿造微生物研究逐步采用高通量测序等现代生物学技术,揭示酿造及制曲过程中的微生物结构,并结合HS-SPME-GC-MS 等关联分析可初步解析出酿造风味功能菌,如Lactobacillus为乳酸乙酯提供前体物质,提升白酒的醇厚感[7];Pichia可以合成多种酚类物质及其前体物质[8],还可以合成3-甲基丁醛、2-苯乙醇、苯乙酸乙酯和2,3-丁二酮[9];Saccharomyces是乙醇的主要产生微生物,还可以产生大量高级醇和大量酯类物质[10];Aspergillus主要产生糖化酶,用以分解淀粉[11-12]。通过对功能菌的代谢研究,可分析出白酒中风味物质主要来源,信春晖等[14]通过分析得出高级醇主要是由酵母菌利用糖及氨基酸代谢而形成的,酯高的原因在于生香酵母丰富等。本试验在青稞酒酿造微生物高通量测序和风味功能菌研究的基础上,进一步分离青稞酒酿造功能菌,在青稞原料中进行培养及代谢研究,一方面为青稞酒菌种库的建立奠定基础,另一方面也为青稞酒中风味来源分析提供新视角,对青稞酒酿造中优良菌的应用提供理论依据。
1 材料与方法
1.1 材料、试剂及仪器
1.1.1 样品
分别采集青稞酒发酵过程中一米查0 d、5 d、10 d、15 d、20 d、25 d 的酒醅样本,二米查、三米查、四米查酒醅同样每隔5 d采集样品直至发酵结束。
1.1.2 试剂及耗材
无水葡萄糖、蛋白胨、琼脂粉、孟加拉红琼脂培养基、MRS、冰乙酸、氯化钠,国药(集团)上海化学试剂有限公司;营养琼脂培养基,北京奥博星生物技术有限责任公司;真菌基因组快速提取试剂盒、细菌基因组快速提取试剂盒,酵母提取物,引物27f、1492r、NL1、NL4、Tris、Taq DNA 聚合酶,DNA分子量标准Marker、dNTP Mixture,10mM、4S Green核酸染色剂,EDTA 溶液、pH8.0,琼脂糖,生工生物工程股份有限公司;色谱醇,德国默克;薄荷醇,德国Dr.E。
青稞糖液制备:称取适量青稞(500 g对应加2 L水),进行破碎浸泡,加入适量高温淀粉酶蒸煮2 h,当糖度达到15°Bx 时停止蒸煮,冷却后加入50 U/g糖化酶,于60 ℃烘箱保温过夜处理,两层纱布过滤,滤液8000 r/min 离心10 min,取上清液,加水稀释到适当糖度10°Bx,121 ℃灭菌15 min。
1.1.3 仪器设备
洁净工作台,苏净集团安泰公司;HYG-B 全温摇瓶柜,苏州培英实验设备有限公司;恒温恒湿培养箱,泰斯特仪器有限公司;高压灭菌锅,上海申安医疗器械厂;厌氧工作站、高速冷冻离心机、梯度PCR 仪、蛋白核酸测定分光光度计,美国赛默飞科技公司;凝胶成像系统、电泳仪,北京六一生物科技有限公司;超声波处理仪,天津Autoscience 公司;Milli-O 超纯水系统,美国Millipore 公司;制冰机,斯科茨曼制冰系统有限公司;气相色谱质谱联用(GC6890N-MSD5975),美国安捷伦科技有限公司。
1.2 实验方法
1.2.1 操作流程
取样→混合→菌悬液→倾倒平皿→稀释涂布平板→培养→平板计数、计算菌落总数→菌种分离纯化→核酸的提取和PCR 扩增测序→青稞糖液培养→酸度、乙醇含量、代谢等检测。
1.2.2 微生物分离纯化[15]
样品预处理:称取5 g 酒醅样品,放入100 mL灭菌后的0.9%生理盐水中,30 ℃摇床200 r/min 振荡10 min。
微生物检测分离:吸取振荡后的菌悬液100 μL,用0.9%的生理盐水稀释到10-1~10-5等不同梯度,分别吸取100 μL 稀释后的各菌悬液在不同培养基上进行涂布培养,培养条件:湿度60 %,温度方面真菌30 ℃,细菌37 ℃,培养48~72 h,厌氧培养操作在厌氧工作站进行。观察记录菌落信息,挑取平板上形态特征不同的单菌落,通过划线纯化,接种于斜面(4 ℃)保藏和甘油冷冻(-80 ℃)保藏。
1.2.3 核酸提取方法[16]
分离纯的菌株分别进行液态培养,酵母菌用YPD 液态培养基、细菌LB 培养基、厌氧菌用PYG液态培养基,取2 mL 菌液,加入灭菌后的离心管中,在4 ℃下以12000 r/min 离心2 min 后弃上清液收集菌体,用基因组快速提取试剂盒进行核酸提取;向离心管中加入50 μL 超纯水,溶解核酸,用核酸浓度仪测定核酸浓度和A260/A280 值(1.8~2.0)。
1.2.4 PCR扩增及琼脂糖电泳检测
对所提取的细菌基因组DNA 进行16S rRNA基因片段扩增,采用细菌16S rRNA 基因的通用引物:正向引物F27(AGAGTTTGATCCTGGCTCA),反向引物R1492(GGTTACCTTGTTACGACTT);真菌基因片段扩增选择通用引物:NL1(GCATATCAATAAGCGGAGGAAAAG),NL4(GGTCCGTGTTTCAAGACGG);PCR 采用50 µL 体系,扩增反应条件如表1,反应完成后,取5 µL PCR 产物进行1%琼脂糖凝胶电泳检测,确认PCR 扩增片段并测序,测序结果进行BLAST 比对,对菌株进行鉴定。
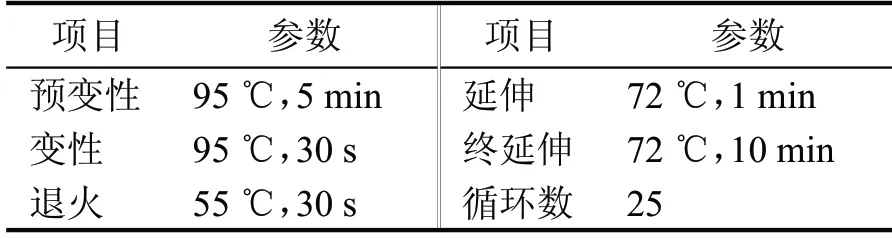
表1 PCR扩增反应程序
1.2.5 纯菌培养方法
于250 mL 三角瓶中分别封装100 mL 青稞糖液(10°Bx)进行真菌培养,乳杆菌等用YPG液态培养基培养,每株菌做2 个平行,按5%的接菌量接入纯菌种,用无菌水密封发酵栓,恒温摇床振荡培养,培养条件30 ℃、200 r/min,每隔12 h 称重检测CO2失重量,12 h 之内CO2失重小于0.2 g 时停止培养,离心取上清液检测风味物质及其他理化指标。
1.2.6 代谢分析
运用顶空固相微萃取技术(HS-SPME)和气相色谱-质谱(GC-MS)方法对挥发性产物进行分析,色谱柱为DB-Wax(30 m×0.25 mm×0.25 μm,J&W Scientific),内标为分析级薄荷醇(34.5 μg/L),仪器条件:50 ℃保持2 min,以6 ℃/min 升到230 ℃保持15 min,分流比10∶1,取8 mL样品放入装有3 g Na-Cl 的顶空进样瓶中,加入4µL 的薄荷醇为内标,顶空瓶于50 ℃恒温萃取45 min,萃取结束后进行GC-MS分析。
2 结果与分析
2.1 青稞酒酿造功能菌确认
通过Illumina Miseq 测序技术,黄和强等[17]分析了青海互助地区的夏季和冬季青稞酒酒醅中微生物种群结构及多样性,Weissella、Lactobacillus、Pichia、Saccharomyces及Hyphopichia是青稞酒发酵过程中的优势微生物;刘冲冲等[18]统计分析青稞酒发酵过程中微生物群落,共获得9 个优势真菌属和8 个优势细菌属,与其他清香型白酒相比有新的优势真菌属[19],Pichia、Hyphopichia、Komagataella、Aspergillus、Saccharomyces和Candida在整个青稞酒发酵过程具有一定的优势。对于细菌属,在发酵0 d 占优势的是Weissella、Pantoea、Acinetobacter和Staphylococcus,从 发 酵5 d 开 始Lactobacillus从25.80 %增加到99.11 % (30 d),取代其他微生物成为细菌群落的优势微生物。通过相关性分析确定在青稞酒发酵过程中主要的风味功能菌包含Aspergillus、Komagataella、Lactobacillus、Pichia、Saccharomyces和Weissella。
2.2 青稞酒酿造微生物分离
通过纯培养方法分离青稞酒酒醅微生物,分离得到61 株细菌,90 株酵母菌,27 株霉菌。通过分子生物学鉴定,细菌主要为葡萄球菌属(Staphylococcus)10 株,芽孢杆菌属(Bacillus)41 株,海洋杆菌属(Oceanobacillus)2 株,梭状芽孢菌属(Clostridium)1株,乳杆菌属(Lactobacillus)3 株,赖氨酸芽孢杆菌属(Lysinibacillus)3 株,苍白杆菌属(Ochrobactrum)2 株;霉菌主要有链格孢(Alternaria)1 株,曲酶属(Aspergillus)9 株,卷霉属(Circinella)1 株,螺旋聚孢霉(Clonostachys)1 株,镰刀菌属(Fusarium)1 株,横梗霉属(Lichtheimia)1 株,毛霉菌(Mucor)1 株,拟青霉属(Paecilomyces)1 株,青霉属(Penicillium)3 株,根毛霉属(Rhizomucor)1 株,篮状菌属(Talaromyces)1 株,外瓶霉(Exophiala)1 株,地霉属(Geot-richum)1 株;酵母菌有酿酒酵母(Saccharomyces)37株,毕赤酵母属(Pichia)17 株,异常威克汉姆酵母(Wickerhamomyces)11 株,德巴利酵母属(Debaryomyces)2 株,有孢汉逊酵母属(Hanseniaspora)1 株,生丝毕赤酵母属(Hyphopichia)4 株,伊萨酵母属(Issatchenkia)4株,单胞菌属(Kazachstania)1株,葡萄汁酵母(Saccharomyces uvarum)2 株,覆膜孢酵母(Saccharomycopsis) 4 株,有孢圆酵母属(Torulaspora)5株。
2.3 Saccharomyces cerevisiae代谢检测
青稞酒酒醅微生物中分离鉴定出Saccharomyces cerevisiae37 株,部分菌株在基础培养基(WL)上菌落特征见图1。将其接种于青稞汁中培养,并利用顶空固相微萃取-气质连用方法,分析28 株酿酒酵母液态发酵产物。

图1 青稞酒中部分酿酒酵母菌落形态
经过分析可知,Saccharomyces cerevisiae定性到的化合物数量和种类都较多,有共有的也有特有的,总风味种类定性到290 种,主要集中在醇类、酸类和酯类中,也有少量的芳香族化合物、醛酮类其他杂环化合物等,部分菌株在青稞原料中的代谢情况见图2。

图2 Saccharomyces cerevisiae风味物质热图
通过风味物质检测,Saccharomyces cerevisiae在青稞糖液发酵中相对含量较高的代谢产物醇类有苯乙醇、异戊醇,以及少量的正丁醇、正庚醇、正己醇、正辛醇等,正丁醇、异戊醇都呈苦味,其中正丁醇的苦味较重,异戊醇则是微带甜苦[20],适量的高级醇是青稞酒香味的主要组成成分,但当含量过高时,会给酒体带来苦涩味;酸类物质有正癸酸、辛酸、乙酸、己酸等;酯类有乙酸苯乙酯、辛酸乙酯、乙酸乙酯、正己酸乙酯等;萜烯类检测出21 种,有橙花叔醇、α-松油醇、芳樟醇、香茅醇、α-紫罗酮、橙化基丙酮、大马酮、伞花烃、α-法呢烯、α-柏木烯、姜黄烯、β-红没药烯、花侧柏烯、罗汉柏烯、菖蒲烯、α-红没药烯、β-法呢烯、萜品油烯等,所有Saccharomyces cerevisiae代谢中均检测出相对含量较高的的大马酮,占萜烯类的49%。
2.4 Wickerhamomyces anomalus代谢检测
青稞酒酒醅和大曲中分离鉴定出Wickerhamomyces anomalus21株,部分菌株在基础培养基(WL)上菌落特征见图3,利用顶空固相微萃取-气质连用方法,分析17 株Wickerhamomyces anomalus在青稞汁中的发酵产物,如图4所示。

图3 青稞酒中部分Wickerhamomyces anomalus菌落形态
Wickerhamomyces anomalus定性到的化合物种类有141 种,主要以醇类、酯类、酸类为主,也有一定量的烯烃类和呋喃类以及少量醛酮类和酚类,部分菌株在青稞原料中的代谢情况见图4。

图4 Wickerhamomyces anomalus风味物质热图
通过风味物质分析,Wickerhamomyces anomalus在青稞糖液发酵中相对含量较高的醇类代谢产物有异丁醇、苯乙醇、橙花醇,其中异丁醇极苦;酸类有辛酸、乙酸、正癸酸;酯类主要为乙酸乙酯,占酯类总含量的74.3%,该菌是青稞酒酿造中主产乙酸乙酯的微生物,在青稞酒酿造中添加适量Wickerhamomyces anomalus菌种,能提高原酒乙酸乙酯含量;在发酵液中还定性出2,3-丁二醇,该物质和其他多元醇在酒中起助香作用,能增加酒体的绵、甜、柔软及细腻感[21]。
白酒中的萜烯类化合物具有呈香或呈味作用,除了单萜和少量的倍半萜具有气味外,大部分萜烯类物质呈现一定的苦味[22],萜烯类物质一般都有一定的功能活性作用,因此,萜烯类物质一直是白酒中的热门研究对象。青稞酒功能菌Wickerhamomyces anomalus发酵液中共定性出18 种萜烯类物质,分别为橙花醇、里那醇、α-松油醇、香茅醇、橙花叔醇、金合欢醇、α-萜品醇、反式-橙花叔醇、椰子醛、β-大马酮、月桂烯、α-蒎烯、α-柏木烯、β-红没药烯、α-金合欢烯、长叶蒎烯、d-柠檬烯、柏木脑等,其中橙花醇为Wickerhamomyces anomalus代谢主要萜烯醇,占萜烯类总含量的70%。
2.5 青稞酒酿造功能菌代谢研究
据《青海通史》记载,互助青稞酒酿造始于明代中后期,悠久的酿造历史,适宜的气候条件,开放式的固态发酵体系,使青稞酒发酵环境中存在大量驯化了的功能菌参与酿造,为了解其他功能菌在青稞酒中的代谢贡献,对Torulaspora delbrueckii、Hyphopichia burtonii、Kazachstania unispora、Hanseniaspora uvarum、Pichia kudriavzevii、Pichia scaptomyzae、Pichia membranifaciens、Pichia manshurica等8株菌进行挥发性代谢物质检测,如图5所示。
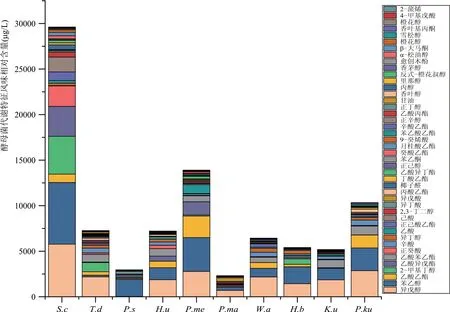
图5 青稞酒功能酵母菌代谢特征风味相对含量
Saccharomyces cerevisiae整体风味物质相对总含量远高于其他菌株,是青稞酒酿造中的优势菌和功能菌,且发酵速率最快,发酵能力最强,在酿造中主导着乙醇发酵。Pichia membranifaciens风味物质含量也高于其他菌株,该菌产乙酸乙酯能力最高,产乙酸能力仅次于酿酒酵母,在青稞酒酿造应用实验中添加适量此菌种,表现出了高出酒率和原酒高酸、高酯的能力。大部分酵母菌在青稞原料中代谢较多的是苯乙醇、异戊醇、异丁醇等,这些物质都有一定的苦味,通过蒸馏带入到青稞酒中,适量的高级醇是青稞酒香味的主要组成成分,含量过高时,会给酒体带来苦涩味。
在萜烯类物质方面,Saccharomyces cerevisiae和Torulaspora delbrueckii代谢较高含量的萜烯类,包括芳樟醇、橙花叔醇、里那醇、香茅醇、香叶醇等,代谢γ-壬内酯能力也远高于其他菌株,Hanseniaspora uvarum、Pichia membranifaciens也能代谢较高含量的香叶醇,还能代谢α-松油醇、橙花醇、雪松醇、β-大马酮、香叶基丙酮、2-茨醇、2-莰酮、月桂烯、2-蒎烯等萜烯类物质。在前期研究中将代谢萜烯的酵母与典型清香型酒进行对比分析,Wickerhamomyces anomalus、Pichia membranifaciens等 代谢萜烯菌含量高于典型清香型白酒,Saccharomyces cerevisiae夏季略低,秋季含量高于典型清香型白酒,含量更高的萜烯转化酵母有助于提高青稞酒中萜烯种类与含量。
白酒中的醇类物质能为白酒增甜增香,在酒中可起到调和作用,醇类的味觉作用在白酒中也相当重要,它是白酒绵甜和香气的基本来源。醇是酯、酸的前驱,能增加白酒的甜味,并让香气浓郁持久,如果过量,则会使白酒发苦、发臭,香气不协调。
2.6 青稞酒中功能细菌代谢分析
细菌在酿酒微生物群落中扮演着重要角色,主要参与形成白酒复杂的风味和香气[21],通过特异性分离,筛选到青稞酒中5 株细菌并进行代谢分析,分别为Clostridium sp、Bacillus subtilis、Lactobacillus buchneri、Lactobacillus acetotolerans、Lactobacillus paracasei,将5 株细菌纯种液态培养后,气相色谱分析液态发酵产物,主要有醇类、酸类、酮类及少量酯类、醛类等,与真菌代谢比较,细菌代谢物质中吡嗪类含量明显高于真菌,主要有2-乙基-5-甲基吡嗪、2-乙基-6-甲基吡嗪、2-甲基-5-异丙基吡嗪、3,5-二乙基-2-甲基-吡嗪、2-丁基-3,5-二甲基吡嗪、3-乙基-2,5-甲基吡嗪、2-乙基-3,5-二甲基吡嗪、2,5-二甲基吡嗪、2-甲基吡嗪、2,3-二甲基吡嗪、2,3,5-三甲基吡嗪等,吡嗪类化合物蒸汽压低、易挥发,香势强、香味阈值低,在食品中为重要的风味物质[21]。嗜热芽孢杆菌可以代谢2,3-丁二醇、3-羟基-2-丁酮(醋酉翁)等物质形成吡嗪类化合物,为酒体带来焙烤香气和焦香味,通过本文前期分析,吡嗪类前体物质2,3-丁二醇,部分酵母菌及Saccharomyces cerevisiae等都会代谢产生,Bacillus subtilis代谢中也定性出2,3-丁二醇,为吡嗪类形成提供条件。
细菌不仅代谢丰富的吡嗪类,还有5 株细菌共有的苯乙醇、1-壬醇,如图6,Bacillus subtilis和Lactobacillus paracasei代谢风味相对含量较高;与其他4 株细菌相比,Bacillus subtilis能代谢2,3-丁二醇、橙花醇、异戊酸、己酸、香叶基丙酮、2-戊酮、4-乙基愈创木酚、月桂烯等物质,且乙酸、苯乙醇、2.3-丁二醇、异戊酸、3-羟基-2-丁酮等相对含量较高;Lactobacillus paracasei能代谢较高含量的2,3-丁二酮、乙酸和丁酸;Clostridium sp、Lactobacillus buchneri、Lactobacillus acetotolerans中也定性出一定量的异戊醇、苯乙醇、丁酸等,这些功能菌在青稞酒酿造中代谢丰富的风味物质,形成了青稞酒独特的风格。

图6 细菌代谢风味物质Venn图
3 结论
前期通过高通量测序对青稞酒酿造各环节和不同季节酿造微生物结构有了一定的研究基础,结合顶空固相微萃取气相色谱-质谱技术,揭示了青稞酒酿造中的风味功能菌,本文在前期研究基础上进行微生物分离获取活体菌株,经测序,酵母菌有26 个种属,霉菌19 个种属,细菌27 个种属,为青稞酒菌种库建立和酿酒微生物研究奠定基础。
代谢方面,通过青稞酒酿造优势菌和风味功能菌在青稞原料中的代谢分析,发现Saccharomyces cerevisiae可代谢苯乙醇、异戊醇及少量正丁醇、正庚醇、正己醇、正辛醇等,酸类物质正癸酸、辛酸、乙酸、己酸等,酯类物质乙酸苯乙酯、辛酸乙酯、乙酸乙酯、正己酸乙酯等,另外定性出21 种萜烯类物质,如芳樟醇、香茅醇、α-紫罗酮、大马酮、伞花烃等。Wickerhamomyces anomalus在青稞糖液发酵中相对含量较高的醇类代谢产物有异丁醇、苯乙醇、橙花醇、辛酸、乙酸、正癸酸、乙酸乙酯等,萜烯类18 种,如橙花醇、里那醇、α-蒎烯等,细菌除了吡嗪类物质丰富外,也能代谢较多的异戊醇、苯乙醇、丁酸。张芬军等[23]通过HS-SPME-GC×GC-TOFMS分析方法对青稞酒风味成分进行了定性定量分析,共鉴定出天佑德青稞酒中含有32 种萜烯类物质,有香茅醇、香叶醇、橙花醇、里那醇、β-大马酮、芳樟醇、2-蒎烯等,通过代谢研究,上述萜烯类物质都是青稞酒功能菌、优势菌代谢产生,如Saccharomyces cerevisiae代谢的β-大马酮占萜烯类的49 %、Wickerhamomyces anomalus代谢的橙花醇占萜烯类的70 %,β-大马酮具有花香、蜜香特征,是清香型白酒中的重要化合物。乙酸乙酯、乙酸等是青稞酒的大骨架成分,青稞酒中还有仲丁醇、正丙醇、异丁醇、正戊醇、异戊醇、苯乙醇等微量成分,丰富的微生物代谢风味物质形成了天佑德青稞酒独特的风格,研究青稞酒微生物代谢物质,能快速找到青稞酒中化合物对应的主要代谢微生物,有利于酿造功能菌的选择和应用,为青稞酒菌种库的建立奠定基础,也能为青稞酒风味物质来源解析提供新视角。

