原发性闭角型青光眼合并年龄相关性白内障超声乳化术后屈光状态研究
刘雪薇 雷雨馨 郭明义 王林洪
华北理工大学附属医院眼科 河北唐山 063000
青光眼是排名第二位的非可逆性致盲眼病,国人原发性闭角型青光眼(primary angle-closure glaucoma,PACG)较原发性开角性青光眼更为常见,一项青光眼流行病学研究表明原发性青光眼致盲率可达17.24%~68.75%[1]。现阶段不建议对透明晶状体进行白内障摘除术,但对于PACG合并年龄相关性白内障患者而言,超声乳化白内障吸除联合人工晶状体植入(Phacoemulsification and intraocular lens implantation,Phaco+IOL)术是一种较为经济的治疗方案,且术后患者解剖结构得到改善,能很好地稳定术后眼压情况[2]。PACG患者多具有浅前房、短眼轴、高眼压及晶体悬韧带松弛等特点,其拥挤的眼前段结构极大增加了手术操作难度及白内障术后屈光状态的预测难度。本文将探讨PACG合并年龄相关性白内障患者Phaco+IOL术屈光状态及其影响因素,为今后减少术后屈光误差及提高视觉质量提供更多的思路。
1 资料与方法
1.1一般资料 选取2020年11月~2021年5月在华北理工大学附属医院行Phaco+IOL术后的PACG合并年龄相关性白内障患者及年龄相关性白内障患者作为研究对象,分为PACG组(n=45)和单纯白内障组(n=47)。单纯白内障组入选标准:(1)确诊为年龄相关性白内障,年龄≥50岁,晶状体混浊导致视功能不能满足患者需要。(2)双眼眼压正常,既往无眼压升高病史及青光眼家族史。PACG组入选标准:(1)确诊为年龄相关性白内障,年龄≥50岁,晶状体混浊导致视功能不能满足患者需要。(2)依据国际地域和流行病学眼科学会提出的原发性房角关闭分类标准,符合原发性房角关闭或PACG的诊断标准。原发性房角关闭定义为患眼静态房角镜180°及以上范围后部小梁网不可见,并伴有眼压高于21 mmHg或动态房角镜下可见虹膜房角关闭。PACG定义为原发性房角关闭伴有青光眼性视神经损害。(3)Phaco+IOL术前予以降眼压治疗,术后眼压及随访期眼压均在正常范围。两组排除标准:(1)无眼外伤、眼表、眼底及影响屈光介质清晰度的病变;(2)既往无内眼手术及眼部手术史;(3)无人工晶状体(intraocular lens,IOL)脱位、后发性白内障、黄斑水肿等术后并发症。(4)术后眼压及随访期眼压异常者。(5)资料收集不完整者。本研究经医院伦理委员会批准,且所有研究对象均知情并签署知情同意书。
1.2术前检查方法 两组患者术前行裸眼视力及最佳矫正视力(best corrected visual acuity,BCVA)检查,利用视功能指数(visual function index-14,VF-14)量表评估患者视功能状态和生活质量,得分范围为0(最差功能水平)~100(最佳功能水平)。使用非接触眼压计测量术前平均眼压,裂隙灯显微镜查看眼前节,数字眼底照相检查仪评估视盘情况,相干光层析成像术检查评估视网膜神经纤维层,标准自动视野检测视野情况。应用前房角镜检查联合超声生物显微镜观察房角关闭情况,利用超声生物显微镜测量出晶体拱高(lens vault,LV),LV为晶状体与巩膜突连线中垂线交点到巩膜突连线中点的距离。术前应用电脑验光仪测量角膜曲率(corneal curvature,K),利用眼科专用A型超声诊断仪测量眼轴长度(axial length,AL)及前房深度(anterior chamber depth,ACD),采用SRK/T、Hoffer Q及Holladay 1公式计算出IOL屈光度,由术者依据患者的用眼习惯选择合适的IOL的屈光度并记录对应的预测等效球镜度。所有测量操作均由同一经验丰富的医生完成。
1.3术前准备及手术方法 PACG组术前将眼压降至正常范围,两组患者术前均给予左氧氟沙星滴眼液点眼3d以预防术后感染。术前30min充分散瞳,标记眼别。患者取仰卧位,常规消毒术眼后铺巾,开眼睑。手术操作均由同一术者在麻醉满意后完成,制式刀于角膜缘10点位做长约3mm角膜透明主切口,2点位制作辅助切口,注入黏弹剂,连续环形撕开直径约6mm的前囊,注水使晶体表面的皮质、晶体和核的皮质分离,超声乳化碎核并吸除,密闭条件下自动灌注/抽吸系统吸除残留皮质后可见囊膜完整,再次注入黏弹剂,推注器将IOL植入于囊袋内。吸除残余黏弹剂,恢复前房及眼压,水密切口。去除开睑器,结膜囊内涂妥布霉素地塞米松眼膏,闭睑包扎,术毕。
1.4术后检查及随访评估 术后随访3个月,检查内容包括:裸眼视力、BCVA、VF-14评分、眼压及实际等效球镜度检查。屈光预测误差(refractive prediction error,PE)为实际等效球镜度与预测等效球镜度的差值,若PE<-0.5 D为近视误差,PE>+0.5D为远视误差,若-0.5D≤PE≤+0.5D则认为不存在屈光误差。PE的绝对值为绝对屈光误差值(absolute refractive error,AE),平均绝对屈光误差值用MAE(mean absolute error)表示。

2 结论
2.1两组患者一般资料比较 共收集PACG合并年龄相关性白内障患者45例(45只眼)及年龄相关性白内障患者47例(47只眼)。两组之间年龄、性别及眼别比较差异无统计学意义(P>0.05),具有可比性,见表1。

表1 两组患者一般资料比较
2.2两组患者手术前后BCVA及VF-14评分比较 单纯白内障组术后BCVA及VF-14评分较术前均明显提高,差异有统计学意义(Z=-6.014, -5.976, 均P<0.001);PACG组术后BCVA及VF-14评分较术前均明显提高,差异有统计学意义(Z=-5.873, -5.846, 均P<0.001),见表2。
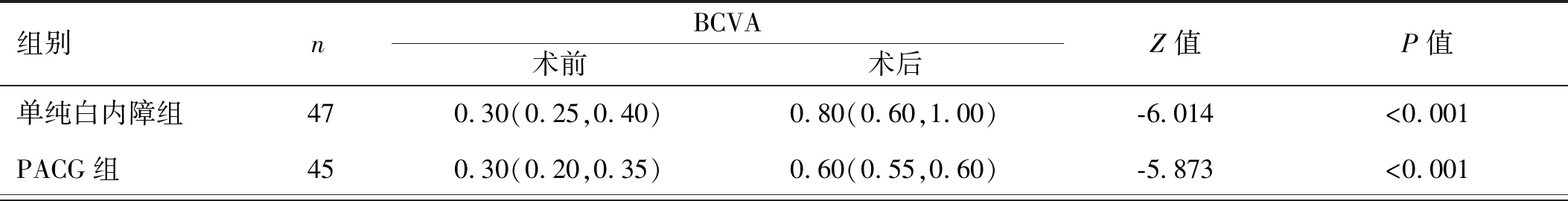
表2 两组患者手术前后BCVA及VF-14评分比较[M(Q1,Q3),分]

组别nVF-14评分术前术后Z值P值 单纯白内障组4752.00(40.00,54.00) 85.00(74.00,89.00)-5.976<0.001PACG组4528.00(23.00,33.50) 58.00(54.50,65.00)-5.846<0.001
2.3两组患者术前眼球生物学参数的比较 单纯白内障组与PACG组术前AL、ACD、LV比较,差异均有统计学意义(t=12.419, 19.896, -12.567, 均P<0.001),两组患者K比较,差异无统计学意义(t=1.926,P=0.057)。PACG组较单纯白内障组具有短眼轴、浅前房及较大晶体拱高的生物学参数特点。见表3。
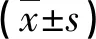
表3 两组患者术前眼球生物学参数比较
2.4屈光误差的分析
2.4.1两组组间和组内各IOL屈光度计算公式MAE的比较 在分别应用SRK/T公式、Hoffer Q公式及Holladay1公式预测术后屈光状态时,PACG组的MAE大于单纯白内障组的MAE,差异有统计学意义(t=-4.719、-2.303、-3.656,P<0.001、=0.024、<0.001),即PACG组较单纯白内障组更易发生屈光误差。在单纯白内障组中,各公式之间MAE比较差异无统计学意义(F=0.660,P=0.519);在PACG组中,各公式之间MAE比较差异有统计学意义(F=9.155,P<0.001),其中SRK/T公式准确性最差,见表4。
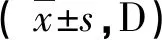
表4 两组各IOL屈光度计算公式MAE的比较
2.4.2两组各IOL计算公式MAE分布的比较 在单纯白内障组中,各公式在0.50D误差范围内的百分比之间的差异无统计学意义(χ2=0.059,P=0.971),见表5。PACG组中Hoffer Q在0.50D误差范围内占42.22%,高于Holladay 1的20.00%与SRK/T的20.00%,差异有统计学意义(χ2=7.446,P=0.024),见表6。

表5 单纯白内障组各IOL计算公式MAE的分布比较[例(%)]

表6 PACG组各IOL计算公式MAE的分布比较[例(%)]
2.5PACG组各公式AE与术前眼球生物学参数的相关性分析 在SRK/T、Hoffer Q及Holladay 1中,PACG组患者的AE与AL呈负相关(r=-0.786、-0.458、-0.877,P<0.001、=-0.002、<0.001);与ACD呈负相关(r=-0.698、-0.480、-0.827,P<0.001、=0.001、<0.001);与LV呈正相关(r=0.670、0.555、0.852,均P<0.001),差异均有统计学意义(P<0.05)。在SRK/T、Hoffer Q及Holladay 1中,PACG组患者的AE与K无明显相关性(r=-0.060、0.021、-0.038,P=0.696、0.892、0.802),差异无统计学意义(P>0.05),见表7。
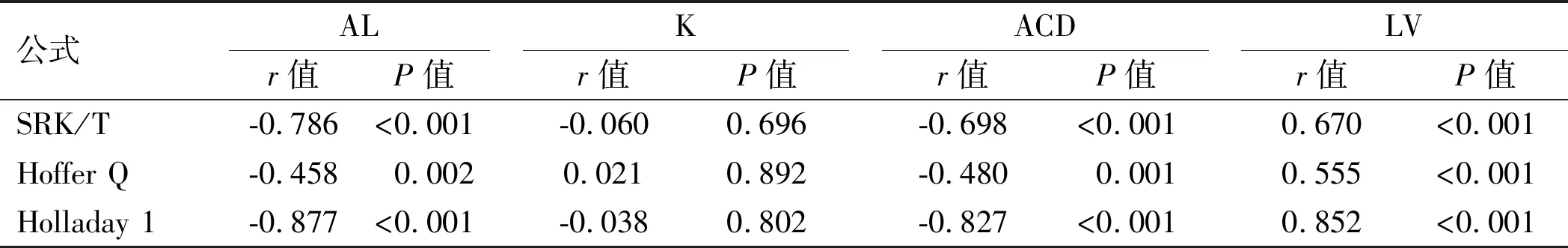
表7 PACG组各公式AE与AL、K、ACD、LV的相关性分析
3 讨论
Phaco+IOL术作为PACG合并年龄相关性白内障患者的一种重要的干预及控制治疗方案,其通过加深前房起到降低眼内压的作用,同时可附加房角分离再次开放房角,最终使患者获得更好的视力康复效果。本研究结果显示单纯白内障组及PACG组术后BCVA及VF-14量表评分均较术前明显提高,差异均有统计学意义(P<0.05),说明Phaco+IOL术能有效地提高白内障患者的视功能、改善生活质量。Helmy等[3]对102例行Phaco+IOL术的PACG合并白内障患者进行长达10年的随访,发现患者的视力从术前(0.17±0.10)显著提高到术后(0.9±0.08),证实Phaco+IOL术能有效提高PACG合并白内障患者的视力,这与本次研究结果相符。对于青光眼患者的白内障手术,术后屈光状态是一个备受关注的问题,而精确的IOL屈光度数计算是减少术后屈光误差及提高视觉质量的关键。
本研究结果提示SRK/T、Hoffer Q及Holladay 1公式在预测年龄相关性白内障患者的IOL屈光度数上具有相似的准确性。刘珣等[4]认为在拥有正常AL的患者中SRK Ⅱ、SRK/T、Holladay l及Haigis公式之间屈光误差的差异无统计学意义(P>0.05),这与本研究结果基本一致。目前Hoffer Q公式被广泛应用于短眼轴的白内障患者中[5],Carifi等[6]发现Hoffer Q公式在短眼轴患者中具有明显优势。在预测PACG合并白内障患者IOL屈光度时,Hoffer Q公式的屈光误差小于Haigis公式和SRK/T公式[7]。在计算PACG组患者IOL屈光度时,本研究结果提示Hoffer Q公式的准确度高于SRK/T公式及Holladay 1公式,这与既往研究结果基本一致[5-7]。术后的屈光状态能直接影响患者的视觉功能及生活质量,本研究证实PACG组较单纯白内障组Phaco+IOL术后更易产生屈光误差。既往研究认为屈光误差与有效晶体位置(effective lens position,ELP)具有高度的一致性[8]。Phaco+IOL术使PACG组患者拥挤的眼前段结构发生相当大的变化,导致ELP改变较大,这可能是导致患者屈光误差更大的原因。
本研究中PACG组与单纯白内障组的AL、ACD、LV比较差异均有统计学意义(P<0.05),其中PACG组具有浅前房、短眼轴、高拱高的特点。术前需要AL、ACD、K等眼球生物学参数来计算IOL屈光度数,本研究中PACG组与单纯白内障组在眼球生物学参数上的差异,可能是导致PACG组的屈光误差较大的原因。通过分析PACG组患者术后AE与眼球生物学参数的相关性,本研究发现AE与AL、ACD呈负相关,与LV呈正相关,与K无明显相关性。Rhiu等[9]也认为PACG患者的实际等效球镜度与预测等效球镜度差异明显,并表明可能与PACG患者具有短眼轴和浅前房等特点有关。一些研究通过分析白内障手术前后生物学参数变化情况,证实术前ACD越浅则术后变化越大,同时术后屈光误差越大;术前ACD越深则术后变化越小,同时术后屈光误差越小[10-11]。近年来国外学者发现LV是青光眼患者白内障手术后屈光结果不满意的重要预测因素,术前LV越高,MAE就越大[12]。较高LV的患者,Phaco+IOL术后ELP会发生较大的位移,从而导致屈光误差。LV是房角关闭的危险因素,合适的LV对保持房角开放有积极意义。目前LV还尚未应用于IOL屈光度计算公式中,LV能否作为一种变量开发针对于PACG合并白内障患者的新型公式,今后还需扩大样本量进一步分析。PACG合并白内障患者的屈光误差与其术前眼球生物学参数相关,因此术前精准的眼球生物学测量对减少屈光误差起着重要作用。对于非正常AL及眼前节与AL比例异常的患者而言,超声波生物测量法和光学生物测量法的结合使用,对减少极端眼球的屈光误差也十分有意义。此外,相关研究表明PACG患者眼压较高时角膜水肿,不仅造成中央角膜厚度发生变化,而且影响AL、ACD及K测量的准确性,这些最终都会影响公式预测ELP的准确性,PACG合并年龄相关性白内障患者应该在眼压正常化后再进行眼球生物学参数的测量[13]。
综述所述,SRK/T、Hoffer Q及Holladay 1公式在预测年龄相关性白内障患者的IOL屈光度数上具有相似的准确性,而在PACG合并年龄相关性患者中,Hoffer Q公式最优。PACG合并年龄相关性白内障患者较单纯白内障患者Phaco+IOL术后更易发生屈光误差,与其术前较大晶体拱高、浅前房、短眼轴相关,因此精准的眼球生物学测量有利于减少其屈光误差的发生。

