响应面法优化发酵乳中SPME-GC-MS检测丁酸及应用
宋保阔,张栋,杨玲,贾晓蒙,王世杰,
(1.河北科技大学食品与生物学院,石家庄 050018;2.河北君乐宝乳业有限公司,石家庄 050221;3.河北一然生物科技股份有限公司,石家庄 050800)
0 引言
发酵乳是乳酸菌在乳制品中发酵代谢而成的酸性乳制品[1],不仅含有活性乳酸菌,而且乳酸菌代谢产物具有良好的功能特性。并且发酵乳代谢产生有机酸和香气成分导致牛奶中重要的物理化学、感官和微生物变化[2]。液体乳制品中的游离脂肪酸作为挥发性香气成分,及香气成分前体,增强了乳制品的风味和口感[3]。近年来,研究发现丁酸是部分乳酸菌的代谢产物,被认为是肠道微生物对机体代谢调节的重要媒介[4],具有调节细胞能量稳态[5]、抑制结直肠癌和慢性炎症[6]、增强肠道稳态、预防肥胖和糖尿病等作用[7]。因此,发酵乳中的丁酸含量,可作为评价发酵乳营养价值的重要参考标准。
随着色谱技术的发展,气相色谱法(GC)、高效液相色谱法以及毛细管电泳法被广泛用于短链脂肪酸的检测[8]。固相微萃取(SPME)与气相色谱联用是当今常用的方法,具有灵敏度高、成本较低、操作简便且对环境影响极小等优势[9]。SPME是一种基于吸附机理,将分析物的取样、分离和富集结合到一个步骤中的样品制备技术,常用于气相色谱分析的样品前处理,能够有效地萃取食品中的挥发性物质[10]。
采用响应面法分析优化发酵乳制品中丁酸的萃取条件。采用四因素三水平实验设计,以丁酸浓度为响应值,探究SPME-GC-MS定量检测丁酸的较优条件。
1 材料与方法
1.1 材料
1.1.1 菌株
冻存菌种:两株植物乳杆菌LP1030、LP1071(编号Lp1、Lp2)、两株瑞士乳杆菌LH1056、LH3(编号La1、La2)、一株德氏乳杆菌保加利亚亚种L8(编号Ld1)菌株来源河北一然生物科技股份有限公司。
1.1.2 试剂
正丁酸、戊酸 色谱纯(纯度>99%),阿拉丁集团有限公司;脱脂乳粉,新西兰恒天然集团;氯化钠(分析纯),天津市鼎盛鑫化工有限公司;MRS Medium,北京陆桥技术股份有限公司。
1.1.3 仪器与设备
5975C-7890A型气相色谱-质谱联用仪,美国Agilent公司;手动SPEM进样器,50/30 umDVB/CAR/PDMS萃取头,美国Agilent公司;HJ-3数显恒温磁力搅拌,博纳科技有限公司;BCD-270WTDGVBP/A电冰箱,海信冰箱有限公司;LRH-150F恒温培养箱,上海一恒科学仪器有限公司;XFH-50CA压力灭菌器,浙江新丰医疗器械有限公司;SW-CJ-2D超净工作台,苏州天创净化设备有限公司。
1.2 方法
1.2.1 发酵乳制备
将脱脂乳粉按10%的比例溶于55℃的蒸馏水中,搅拌15 min,静置水合30 min。分装后以95℃、30 min条件灭菌,结束后快速冷却至37℃。5株乳酸菌活化三代后以5%接种量接种到灭菌脱脂乳中,37℃培养;发酵乳培养时间在48、72、96 h时取样品测量其pH和滴定酸度,若72 h与96 h的滴定酸度仍有较大差异,则继续培养、测定pH和酸度,直至与上次测量结果近乎无差异为止。
1.2.2 内标法定量检测
准确称取4.8 g发酵乳和0.2 g合适浓度戊酸标品与2.0 g氯化钠混合后加入顶空瓶中,迅速盖紧顶空瓶瓶盖。样品置于50℃恒温状态下进行磁力搅拌,将萃取头(250℃老化30 min)插入15 mL顶空瓶中萃取30 min,萃取完成后迅速将萃取头插入气相色谱进样口,解析15 min后拔出萃取头。准确称取4.6 g乙醇水溶液(5%)、0.2 g丁酸标品(0.2 mg/g)、0.2 g戊酸标品和2.0 g氯化钠,相同操作进行检测。采用公式进行定量待测乳制品中的丁酸含量。

C1为样品的丁酸含量(mg/g);Si1为样品丁酸的峰面积;Si2为样品内标戊酸的峰面积;Sk1为标样内标物戊酸的峰面积;Sk2为标样内标物丁酸的峰面积;C2为标样内标物戊酸的浓度。
气相色谱条件:萃取头型号:50/30 umDVB/CAR/PDMS;色谱柱:DB-WAX聚乙二醇色谱柱;升温程序:载气为He,恒定流速为1.0 mL/min,不分流模式进样;进样口温度为250℃,检测器温度为250℃,柱箱升温程序见表1。

表1 柱箱升温程序
质谱条件:色谱-质谱接口温度250℃,谱库NIST8.0.L。质谱质量扫描范围20~200 m/z,离子源温度230℃,电离电压70 eV。
1.2.3 单因素实验
加盐量对丁酸浓度的影响。以加盐量为自变量做单因素实验,萃取条件为萃取时间30 min、萃取温度50℃、样品质量为4.8 g,考察加盐量0、1.0、2.0、2.5、3.0 g对丁酸浓度和总峰面积的影响。
萃取时间对丁酸浓度的影响。以萃取时间为自变量做单因素实验,萃取条件为加盐量2 g、萃取温度50℃、样品质量为4.8 g,考察萃取时间25、30、35、40 min对丁酸浓度和总峰面积的影响。
萃取温度对丁酸浓度的影响。以萃取温度为自变量做单因素实验,萃取条件为萃取时间30 min、加盐量2 g、样品质量为4.8 g,考察萃取温度30、35、40、45、50、55、60℃对丁酸浓度和总峰面积的影响。
样品质量对丁酸浓度的影响。以样品质量为自变量做单因素实验,萃取条件为萃取时间30 min、加盐量2 g、萃取温度50℃,考察样品质量2.8、3.8、4.8、5.8 g对丁酸浓度和总峰面积的影响。
Box-Behnken设计试验方案。在单因素的基础上,以萃取温度、萃取时间、加盐量、样品质量为自变量,以丁酸浓度为响应值,应用Design Expert8.0.6软件进行试验设计,研究各参数对考察指标的影响规律,并得到最优萃取条件。其因素水平编码见表2。
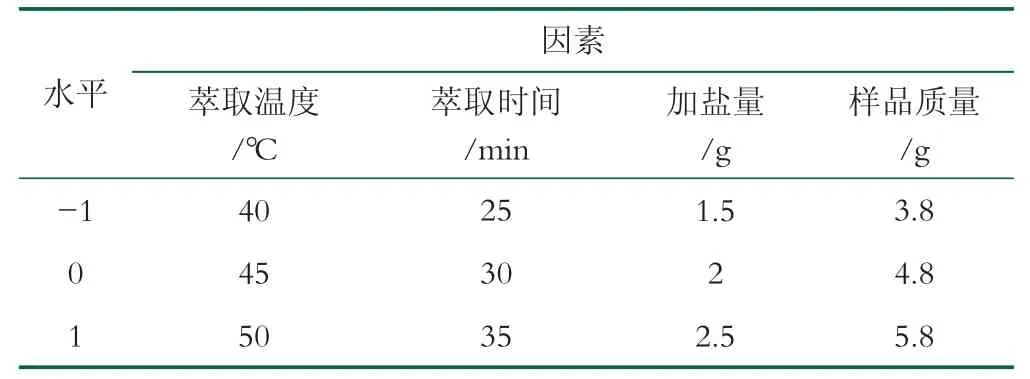
表2 响应面分析试验因素水平
5种乳酸菌发酵乳中丁酸及其他挥发性物质检测按最佳萃取条件对5种乳酸菌发酵乳进行挥发性成分萃取,按1.2.2的检测方法进行发酵乳的丁酸定量。同样的检测方法也可进行对其他挥发性成分的定性检测。
1.2.4 数据分析
采用响应面分析软件Design Expert8.0.6进行试验设计及数据分析,采用Excel2019和SPSS Statistics 17.0软件进行数据统计分析,使用origin 2017进行图形绘制。
2 结果与分析
2.1 单因素实验结果与分析
由图1(a)可知,加盐量2.0 g时丁酸浓度与总峰面积均达到最高值,由此选择2.0 g为最佳加盐量。萃取前,添加一定量的NaCl对样品进行盐析,可降低发酵乳中蛋白对挥发性香气成分的吸附作用,从而提高萃取效果[11]。加盐量大于2.0 g时,检测到总峰面积下降,可能是由于加盐量过大,阻止了挥发性成分扩散,影响了挥发性成分分子基团之间的作用力,从而对萃取效果产生负作用[12]。由图1(b)可知,萃取时间为30 min时丁酸浓度为最高值,30 min之后总峰面积呈上升趋势,但无显著差异,故最佳萃取时间设定为30 min。30 min之后丁酸浓度下降。原因可能是萃取头已达到最大萃取能力,过长时间萃取造成已附着到萃取头上的挥发性成分扩散,导致萃取效果下降[13]。升高温度有益于挥发性物质扩散有利于萃取效果,但是温度过高会降低萃取头对萃取挥发性成分的吸附能力。由图1(c)随萃取温度增加,总峰面积呈上升趋势,但丁酸浓度呈下降趋势,结合两种情况,萃取最佳温度设定为45℃。30~40℃范围内总峰面积上升不明显,可能是因为温度过低导致发酵乳挥发性成分未充分挥发,待测物未能完全被萃取,导致计算出丁酸浓度结果偏大。45℃后,总峰面积上升,丁酸浓度显著下降可能是因为温度过高导致萃取能力下降,并且可能造成部分挥发性成分变性。考虑温度过高会对风味物质产生不良影响,最佳萃取温度选择45℃。由图1(d)可知,样品质量在4.8 g时总峰面积达到最大值,样品质量3.8 g和4.8 g时丁酸浓度差异并不显著,由此选择4.8 g为最佳样品质量。样品质量在4.8 g之后总峰面积下降。可能是由于样品量增加,顶空瓶内空气压力变大,挥发性物质逸散导致总峰面积下降。
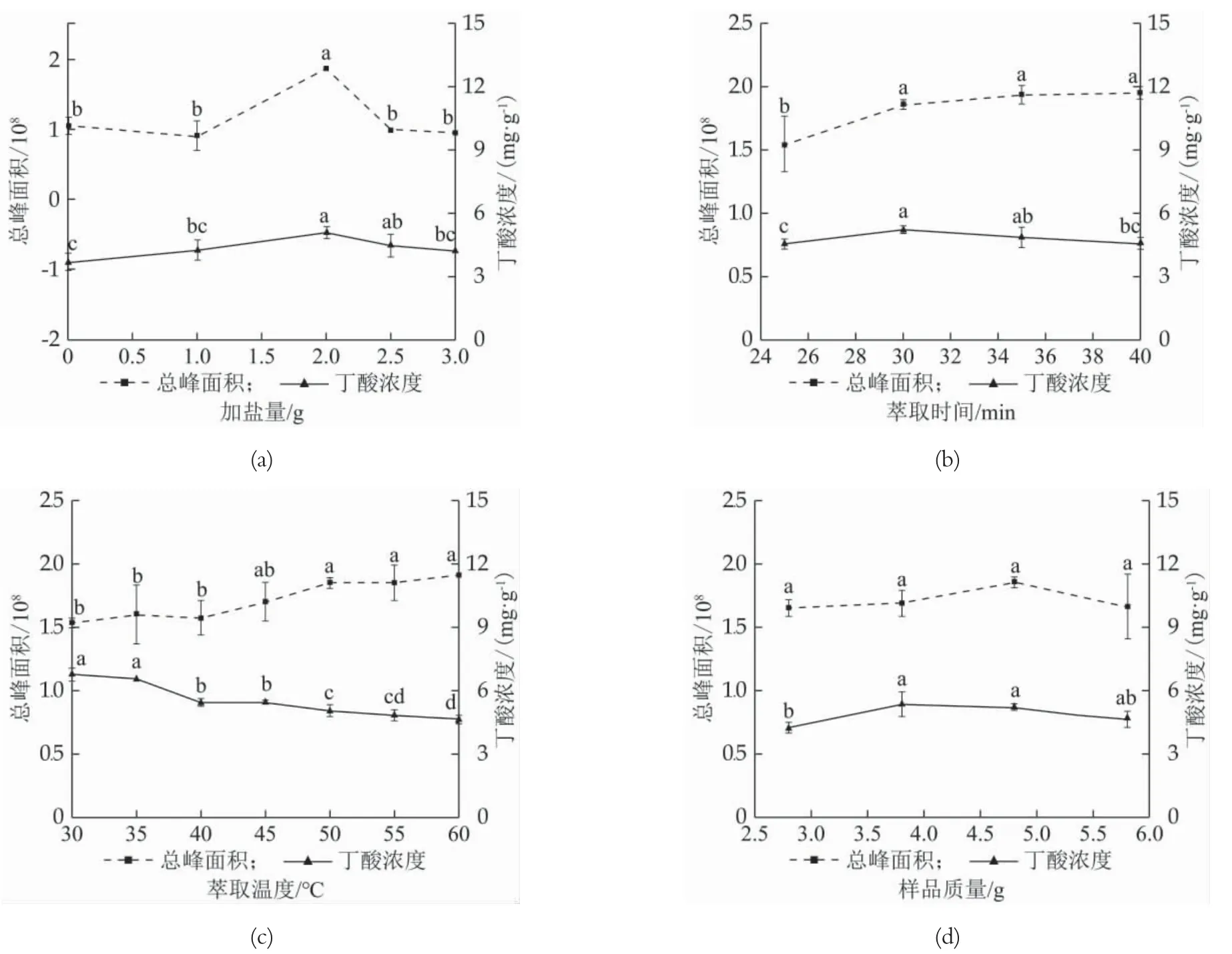
图1 单因素实验结果
2.2 响应面实验结果与分析
结合上述单因素实验结果,按照Box-Behnken试验设计原理,以萃取时间、萃取温度、萃取样品质量和加盐量作为影响因素,以丁酸浓度作为响应值,采用四因素三水平响应面分析方法,进行响应面试验。试验结果见表3,回归分析结果见表4。

表3 响应面方案设计及实验结果
经回归分析,得到乳酸菌发酵产丁酸的丁酸浓度模型的四元二次方程:丁酸浓度=5.46-0.65A-0.053B-0.15C+0.11D-0.48AB-0.23AC-0.086AD+0.34BC-0.14BD-0.27CD-1.24A2-1.03B2-0.47C2+0.11D2
由表4可知,F=3.25模型显著(P=0.0176<0.05)。4个因素对丁酸浓度仅有萃取温度对丁酸浓度影响显著。4个因素对响应值影响作用的大小顺序为A>C>D>B,即萃取温度>加盐量>样品质量>萃取时间。模型失拟性不显著(P=0.0695>0.05),方程对实验拟合程度较高,可以准确模拟各因素对丁酸浓度的影响。
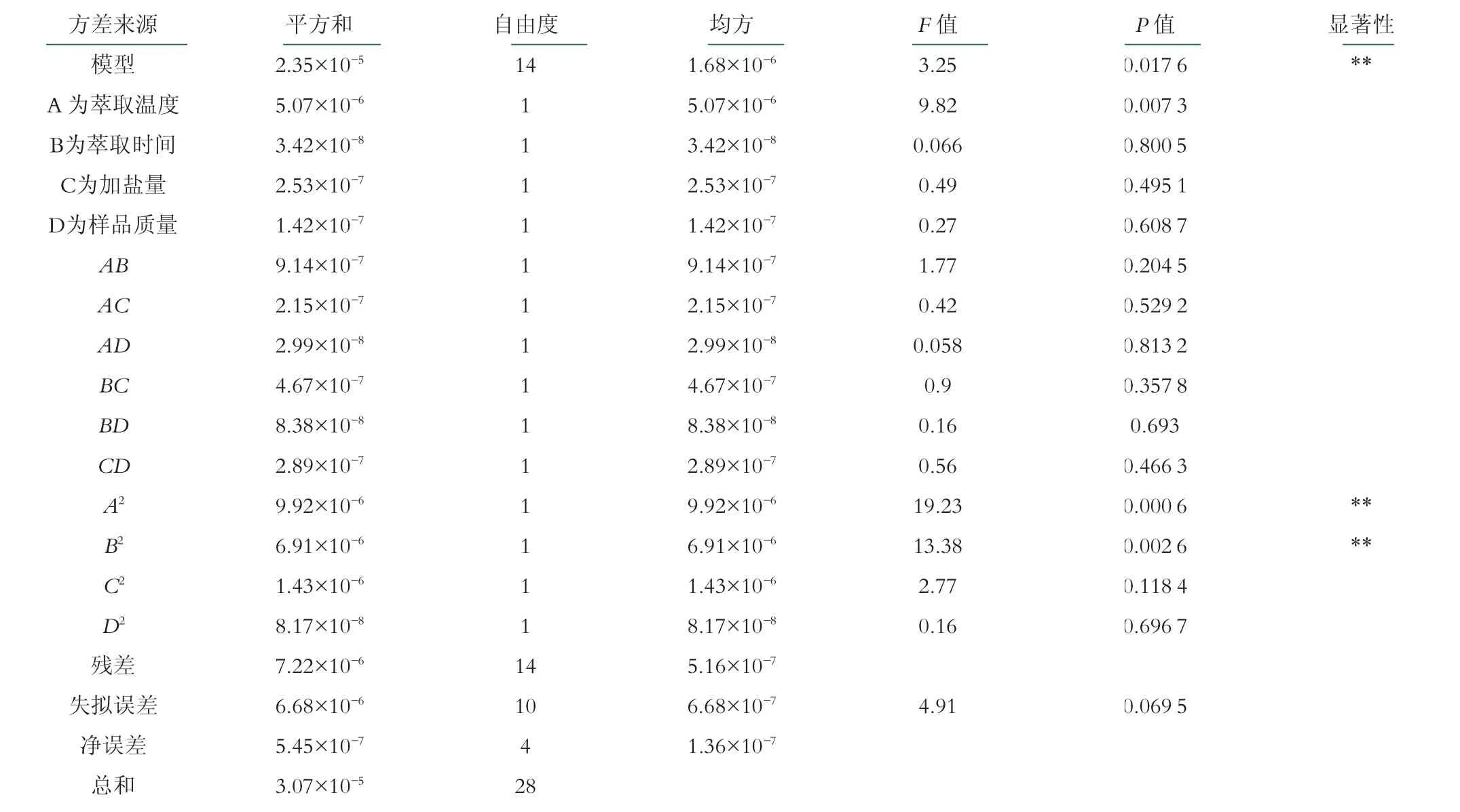
表4 回归分析结果
由图1(d)可知,样品质量的变化对总峰面积和丁酸浓度的作用均不显著;由表4数据,AD、BD、CD和D2的P值均较高(P>0.05),样品质量与其他3个因素的交互作用对丁酸浓度的影响并不显著。因此不在此列出样品质量与其他3个因素的交互作用响应面图与等值线图。图2是丁酸浓度对萃取温度、萃取时间、加盐量和样品质量两两因素交互作用的3D图及其等高线图。从图2中可以看出,萃取温度和时间对萃取后检测丁酸浓度的影响作用较大,表现为响应曲面较陡,这与方差分析结果一致。随着萃取温度的升高和萃取时间的延长,丁酸浓度呈现先增大后减小的趋势,45℃、30 min到达为最高点。温度升高可以缩短样品挥发所需要的时间,从而减少分析所用的时间。加盐量对丁酸浓度影响较小,丁酸浓度随加盐量的增加呈现先增大后减小的趋势45℃、2.0 g为丁酸浓度最高值。随着加盐量的增加和萃取时间的延长,丁酸浓度呈现先增大后减小的趋势,2.0 g、30 min到达为最高点。

图2 各因素相互作用响应面与等值线
根据所得到的模型,预测最佳的萃取条件,萃取温度为47.74℃、萃取时间为28.31 min、加盐量为1.65 g、样品质量为5.8 g、预测丁酸浓度值为0.005 17 mg/g。根据实际情况,调整最佳萃取条件为萃取温度48℃、萃取时间28 min、加盐量为1.65 g、样品质量为5.8 g。
进行最佳条件实验验证,以优化后的萃取条件对同一发酵乳进行重复3次样品丁酸含量测定。3次试验结果为0.005 0 mg/g,相对标准偏差为0.000 165,与预测结果的相对标准偏差为0.000 12。
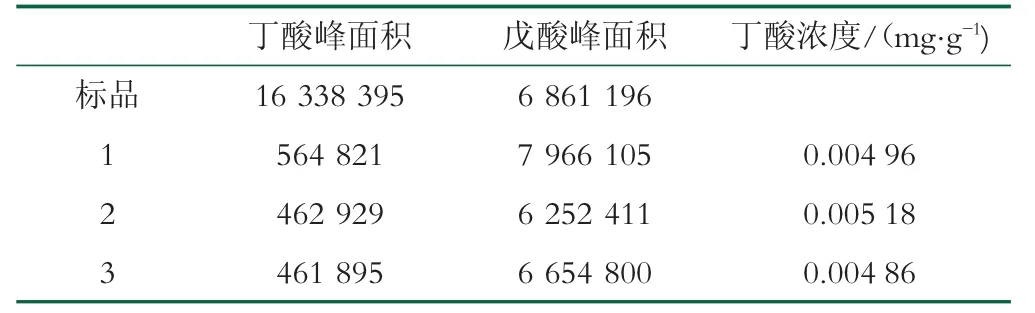
表5 萃取条件验证结果
2.3 发酵乳挥发性成分分析结果
在萃取条件优化的基础上,对发酵乳挥发性成分进行检测,计算出发酵乳中丁酸含量,得到总离子流图如图3所示,挥发性物质及相对含量见表6。

表6 不同菌株发酵脱脂乳挥发性成分相对含量

图3 5种发酵乳气质联用总离子流图
按1.2.3中计算方法计算5种单菌株发酵脱脂乳中的丁酸含量,由高到低排序为Lp1、Ld1、Lp2、La2、La1,分别为5.91、5.38、4.78、4.47、3.50 mg/kg。
对单菌株发酵脱脂乳进行挥发性成分检测,共检测出30种化合物。主要化合物是有机酸类,另有少量醇类、酯类、酮类和醛类化合物。有机酸类化合物中含量最高的是乙酸,其余还检出有丁酸、己酸等。发酵乳中的有机酸类主要是脂肪分解、乳酸代谢和蛋白质分解3种作用产生的[14]。除有机酸类化合物外还有丁二酮、二庚酮、乙偶姻等酮类化合物;糠醇、2-乙基己醇等醇类化合物;苯甲醛等醛类和戊酸丁酯、丁酸丁酯等酯类化合物,都是发酵乳制品中的主要呈味物质。此方法除了检测丁酸等短链脂肪酸还可用于其他挥发性风味物质的检测,用于对酸奶风味和功能的综合评价,具体的萃取条件还需要后续试验综合分析。

(续表6)
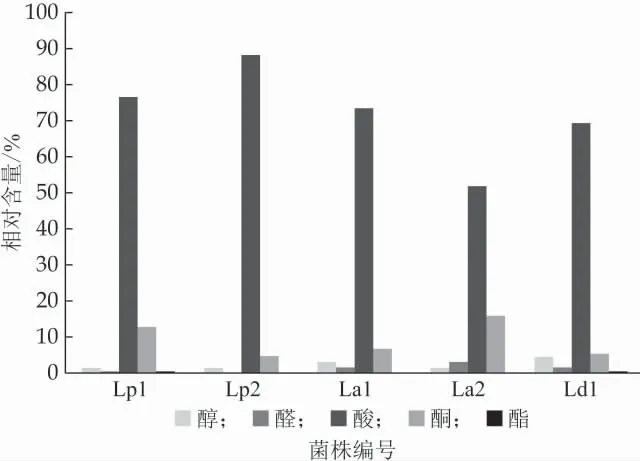
图4 不同菌株发酵乳挥发性成分相对含量
3 结论
顶空固相微萃取-气质联用是定量检测乳制品中挥发性成分含量的常用方法[15],萃取条件会直接影响样品检测的结果。本文以单菌株发酵脱脂乳所得的发酵乳制品为样品,以单因素和响应面实验优化了对发酵乳制品中丁酸的萃取条件。
结果表明,在研究丁酸平衡顶空浓度时,萃取温度被认为是最关键的因素。实验过程中发现萃取温度对丁酸浓度和总峰面积的作用显著,并且两者变化趋势相同。虽然高温有利于分析物从基质中释放出来,但由于分配系数降低,会对涂层吸附分析物产生不利影响[13,16]。因此,当温度升高时,在平衡状态下提取的挥发物量较少。所获得的结果表明,低于30 min的萃取时间不能达到平衡状态,而超过30 min,纤维发生饱和,导致挥发性物质的吸附减少。此外,30 min之后丁酸浓度下降但总峰面积上升,观察到高挥发性化合物的萃取效率降低。正如Plutowska[17]等人之前所述,平衡时间短的化合物可以逐渐从纤维中被取代,并被挥发性较低的化合物抵消。在某些情况下,当增加样品体积时,在稳定的小瓶中,SPME纤维吸附更多的挥发性化合物,然后保持相对恒定[18]。在小瓶的顶部空间中更快地达到平衡,挥发物可以更快和更有效地扩散到纤维上的涂层。但实验结果并不是这样,随着样品质量的增加丁酸浓度和总峰面积均呈下降的趋势,并且未发生显著性变化。实验的缺点是没有评估磁力搅拌器的速度。搅拌加速了相之间的传质,相平衡的建立使得挥发性较低的化合物得到更好的分离[19]。
使用气相色谱-质谱联用鉴定了使用DVB/CAR/PDMS纤维提取的总共30种化合物,定量了单菌株发酵脱脂乳中丁酸含量。为了研究SPME变量(萃取时间、萃取温度、样品量和加盐量)的影响,使用综合实验设计确定了萃取丁酸的最佳HS-SPME条件。验证优化后的萃取条件,重复性较好,与预测值相对标准偏差较小。优化后的方法可适用于发酵乳制品中丁酸的快速定量。

