福建酸竹提取物通过调节硫氧还蛋白1减轻紫外线诱导的皮肤光损伤的研究
于玲
(福建省轻工业研究所有限公司,福建 福州 350005)
皮肤是人体最大的器官,作为人体抵御外界侵害的第一道防线,有着保护、调节、分泌、保湿、屏障等功能[1,2]。但皮肤长期暴露在具有各种危险因素,如紫外线(Ultraviolet,UV)、化学物等外界环境中,其功能可能会因这些外源性损伤导致受损,从而失去重要功能。长期UV暴露是诱发许多皮肤病的主要危险因素,可出现一系列病理生理学改变,包括炎症、氧化应激、DNA损伤等[3-6],最终导致皮肤细胞损伤,甚至产生皮肤癌[7-9]。
硫氧还蛋白(Thioredoxin,TXN)系统是具有氧化还原活性的小分子蛋白系统,由硫氧还蛋白(TXN)、硫氧还蛋白还原酶(TXNRD)和烟酰胺腺嘌呤二核苷酸(NADPH)三部分组成,在氧化还原稳态中起着关键作用[10-12]。TXN系统中高活性的氧化还原位点(-Cys-X-X-Cys-),可以有效地保护生物体免受氧化应激和损伤[13]。TXN系统参与了许多至关重要的细胞生物学过程,包括细胞代谢、分化、增殖和凋亡等[14]。作为维持机体氧化还原稳态的重要组成部分,如果TXN系统被破坏有可能引起健康问题,包括肿瘤、神经退行性疾病和心血管疾病等[15]。
福建酸竹是中国东南部分布最广的竹种之一,蛋白质含量高,钙、磷元素及纤维含量丰富。据报道,不同的竹来源制品可用于治疗多种疾病,包括炎症性疾病、消化系统疾病、循环系统疾病、糖尿病等代谢紊乱性疾病[16-19],最新研究表明,韩国传统食品竹盐具有一定的抗炎活性。在2,4-二硝基氟苯诱发的特应性皮炎模型中,竹盐可显著降低小鼠的血清中瘙痒相关因子的水平,同时减少了炎症细胞的浸润[20],然而BEX在UV诱导的皮肤疾病中的作用还尚不明确,特别是在皮肤光损伤中的作用研究也较为有限。
本研究通过检测BEX对UVB导致的细胞死亡、凋亡水平及氧化应激水平,并通过蛋白印迹实验等一系列手段,在细胞水平上进一步探索并验证BEX在保护UVB诱导皮肤光损伤中的潜在作用机制。
1 实验部分
1.1 药品和试剂
本研究中使用的化学物质和试剂BEX购自福州百泰生物技术有限公司。
用天平称量适量BEX干粉剂,溶于蒸馏水中,然后用无菌 0.22 μm 注射过滤器过滤后,制得相应浓度的BEX(10、30、100、300 μg/mL)溶液,-20 ℃保存待用。
1.2 实验方法
1.2.1 细胞培养和紫外线辐射
原代人皮肤角质形成细胞在含10%胎牛血清(FBS)和1%青霉素/链霉素/谷氨酰胺的杜氏改良Eagle培养基(Invitrogen Life Technologies,Carlsbad,CA,USA)中培养,保存于37 ℃、5%CO2的培养箱中培养。UV辐射设备和步骤参照文献[21]~[25]。
1.2.2 抗体和试剂
Cleaved caspase 3 (#9661,1∶1000)、β-肌动蛋白(#3700,1∶3000)、硫氧还蛋白1(#2429,1∶1000)、硫氧还蛋白2(#14,907,1∶1000)、硫氧还蛋白还原酶1(#15,140,1∶1000)、硫氧还蛋白还原酶2(#12,029,1∶1000)购自Cell Signaling T ec hn ol o g y;种属特异性二抗购自L I-C O R Biosciences。
1.2.3 细胞活力测定
使用细胞计数试剂盒-8(Dojindo,日本)检测细胞活力,将2×105个细胞/孔种于96孔板,培养基100 μL。
1.2.4 蛋白印迹法
样品在变性的8%~12% SDS-PAGE凝胶(Bio-Rad)上电泳,然后通过电印迹转移到聚偏氟乙烯膜上。在室温下用封闭缓冲液封闭1 h,一抗在4 ℃下孵育过夜,第二天将封闭好的膜与特定的二抗在室温下孵育1 h,用ECL试剂检测,β-actin为内参。
1.2.5 细胞凋亡试验
通过TUNEL百分比(TUNEL/Hoechst 33,342×100%)测定细胞凋亡率,通过细胞凋亡ELISA检测试剂盒(Roche,Palo Alto,CA)检测细胞凋亡。
1.2.6 活性氧检测
细胞经DCFH-DA处理,每隔5 min混匀一次,使其充分作用,其与细胞内的ROS反应并导致荧光变化。通过流式细胞仪分析定量处理后细胞中荧光的变化,从而检测细胞ROS的含量。
1.2.7 细胞转染
混合稀释的shRNA和稀释的Lipofectamine 2000,使其制成复合物,在室温孵育20 min。直接将复合物加入到每孔细胞中,摇动培养板,轻轻混匀。在37 ℃,5%CO2培养箱中培养约4~6 h,将孔内含有shRNA-Lipofectamine 2000复合物的培养基移去,更换新鲜培养基。转染完成后24~72 h内可进行shRNA效果监测。
1.2.8 TXN 和TXNRD活性测定法
按分组处理细胞后培养24 h。用胰蛋白酶消化细胞,用PBS洗2次,然后在TE缓冲液中进行超声处理,随后测量蛋白浓度。按TXN活性荧光检测试剂盒(瑞士IMCO)和TXNRD检测试剂盒(美国Sigma公司)公司的方法说明,对总蛋白(20μg)进行TXN和TXNRD活性评估。
1.2.9 统计分析
各独立实验至少重复3次,分析数据采用平均值±SEM表示,所有数据采用GraphPad Prism 7.0进行数据统计分析,P<0.05时认为具有统计学意义。
2 结果与讨论
2.1 酸竹提取物对UVB诱导的皮肤光损伤具有保护作用
为了明确BEX在UVB对原代人角质形成细胞活性损伤的保护作用,我们使用BEX(100μg/mL)预处理原代人角质形成细胞30 min后,首先用不同剂量强度的UVB(5、10、15、20、25 mJ/cm2)照射原代人角质形成细胞后,在完全培养基中培养24 h。CCK8实验结果(图1A)表明,UVB照射可诱导原代人角质形成细胞的死亡,而上述现象可被BEX(100 μg/mL)预处理抑制。进一步的实验表明,BEX在原代人角质形成细胞中表现出剂量依赖的抗UVB活性(图1B),同时,发现用100 μg/mL的BEX预处理细胞表现出良好的抗UVB活性,接下来我们选择该浓度用于后续研究。
接下来应用western blot检测cleaved caspase-3水平分析原代人角质形成细胞中的细胞凋亡水平。结果表明,UVB(20 mJ/cm2)照射后cleaved caspase-3蛋白表达水平增高,而用BEX(100 μg/mL)预处理后蛋白表达水平可显著降低(图1C和D)。TUNEL测定检测结果表明,UVB(20 mJ/cm2)照射后凋亡细胞数显著增加,而经BEX(100 μg/mL)预处理后可显著降低细胞凋亡数(图1E)。流式细胞术检测发现在原代人角质形成细胞中,UVB(20 mJ/cm2)照射引起了显著的ROS产生,而BEX(100 μg/mL)预处理极大减少了这种效应(图1F)。
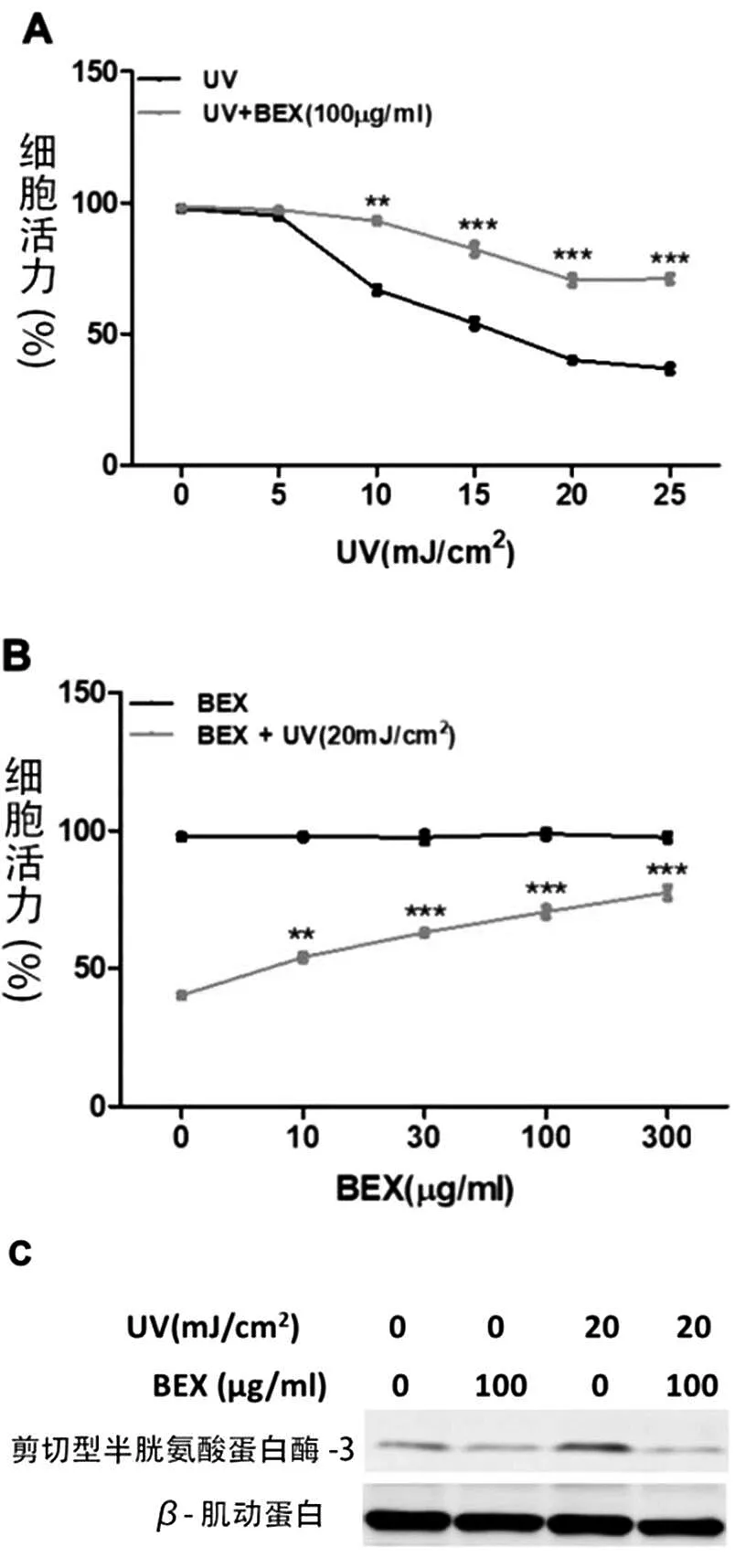

图1 BEX保护人皮肤角质形成细胞免受紫外线照射
2.2 BEX 调节原代人角质形成细胞中TXN1水平
TXN 系统是许多生理过程的基础,包括细胞增殖和凋亡[26],首先检测BEX在TXN系统中对UVB照射的原代人角质形成细胞的影响。TXN活性检测和TXNRD活性检测结果表明,经UVB(20 mJ/cm2)照射后,原代人角质形成细胞的TXN和TXNRD活性显著降低(图2A和图2B)。此外,BEX(100 μ g/mL)预处理则极大减弱了这种效应,表明BEX可以有效抑制UVB照射诱导的原代人角质形成细胞的TXN和TXNRD活性水平下降现象。
接着应用western blot检测蛋白TXN1、TXN2、TXNRD1和TXNRD2的表达水平(图2C和图2D)。Western blot检测结果表明,TXN1蛋白表达水平通过BEX(100 μg/mL)处理显著升高,而TXN2、TXNRD1和TXNRD2的蛋白表达水平与对照组相比无明显变化,表明TXN1在BEX的细胞保护功能中起关键作用。
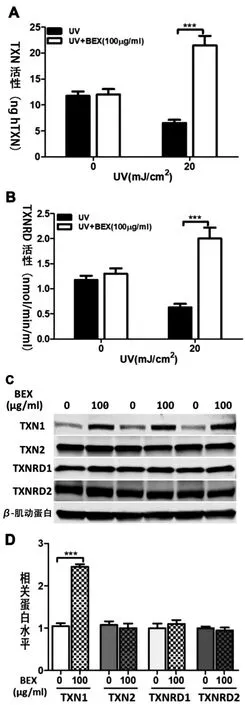
图2 BEX通过调节TXN1介导UVB照射诱导原代人角质形成细胞损伤的保护作用
2.3 TXN1 敲低减弱BEX介导的UVB诱导的原代人角质形成细胞的保护功能
为了研究TXN1在BEX介导的原代人角质形成细胞保护的作用,我们使用NTC或TXN1 shRNA转染的原代人角质形成细胞进行实验。如图3A所示,TXN1敲低显著降低了BEX(100 μg/mL)预处理组的细胞活力,但它不能完全阻断BEX的保护功能,表明BEX可能有其他机制来调节UVB诱导的皮肤细胞死亡。组蛋白-DNA ELISA测定的数据表明,当TXN1被敲低时,BEX(100 μg/mL)预处理,不能减少UVB(20 mJ/cm2)照射诱导的细胞凋亡(图3B)。以上这些结果表明TXN1对BEX介导的原代人角质形成细胞对UVB的细胞保护至关重要。

图 3 TXN1对BEX介导的原代人角质形成细胞的光损伤作用
3 结论
TXN 系统参与了BEX介导的原代人角质形成细胞的保护作用,BEX通过调节TXN1介导UVB照射诱导原代人角质形成细胞损伤的保护作用。这些实验结果表明BEX在对抗皮肤光损伤中的具有良好的应用前景,为预防或缓解光老化和其他UV引起的皮肤病提供一种潜在治疗试剂,并为研发新型皮肤抗光老化产品提供研究基础及理论依据。

