场地实际重金属复合污染土壤生态毒性效应定量评价
马喆,王美娥,姜瑢,陈卫平
1. 中国科学院生态环境研究中心,城市与区域国家重点实验室,北京 100085 2. 中国科学院大学,北京 100049
近年来,随着我国经济结构调整和经济增长方式转变,城镇工业企业搬迁遗留场地的土壤污染问题日益突出[1]。原环境保护部2014年调查报告显示,我国工业废弃地点位超标率为34.9%,主要涉及矿山开采、有色金属冶炼、电镀、制革、化工生产和加工等行业[2]。调查研究发现,电镀污染场地中镉(Cd)、铅(Pb)、铬(Cr)、铜(Cu)、锌(Zn)和镍(Ni)复合污染严重[3-4]。复合污染的联合毒性效应定量评价是污染土壤生态风险评估的关键内容,尤其在场地风险评估中,场地特异性(site-specific)是必须要考虑的重要因子。
目前对复合污染生态效应的评价通常采用“自下而上”效应评价(bottom-up evaluation)方法,即根据污染物的作用方式,基于单一污染物毒性数据,采用浓度加合模型(concentration addition, CA)、独立作用模型(independent action, IA)或复合指数模型(combination index, CI)进行毒性效应定量估算。然而,这种方法需要大量毒性数据,并且由于毒性数据库中的数据大多来自实验室模拟试验,在外推到野外实际污染土壤中往往会出现数量级的误差[5]。与之相比,“自上而下”效应评价(top-down evaluation)方法通过原位污染土壤生物试验,结合生物致毒机理的分析,基于主导污染物识别结果,进行基质整体毒性效应评价,与实际土壤污染特征相关性较强,能够符合场地风险中场地特异性的要求[6-7]。尽管如此,“自上而下”效应评价方法由于较难定量估算复合污染联合生态效应,同时缺乏统一的分析程序,其实际应用较少。
蚯蚓是土壤生态系统的重要组成部分,具有分布广、数量大和对污染物足够敏感等特点,常被用作土壤污染物毒性评价的模式生物[8]。蚯蚓的污染物暴露通常是通过皮肤或者与皮肤相似的肠道暴露,暴露途径简单,毒性效应与蚯蚓体内暴露及土壤环境暴露有关[9],同时,蚯蚓体内多种生物标志物如丙二醛(MDA)、金属硫蛋白(MT)、过氧化氢酶(CAT)、超氧化物歧化酶(SOD)和还原型谷胱甘肽(GSH)等,与污染物暴露之间的胁迫-响应关系明显[10-13]。目前蚯蚓的毒理试验在场地土壤污染生态风险评估、污染物土壤环境质量标准与基准制定、污染场地修复效果评估等方面均有广泛应用[14]。
本研究耦合“自下而上”与“自上而下”2种方法,采用多元统计分析手段,构建了既能够进行定量估算,又具有场地特异性的野外实际场地污染土壤的生态效应定量评价方法。并以江苏省某废弃电镀场地为研究对象,采用蚯蚓土壤微宇宙培养实验,进行野外实际重金属复合污染土壤的毒性效应定量评价。本研究旨在建立一套统一的野外实际污染土壤生态效应评价程序,为土壤污染生态风险评估提供技术支撑。
1 材料与方法(Materials and methods)
1.1 研究场地描述及土壤样品采集
本研究土壤取自江苏省某废弃电镀场地,该电镀厂是长三角地区典型的电镀加工、金属和非金属表面处理企业,1985年建厂,包括电镀车间、硝酸锌生产车间及废水处理池,2014年关停,厂区废弃至今,现场环境较差,厂区呈正方形,边长50 m,面积2 500 m2,土地利用类型属于建设用地。依据《建设用地土壤污染状况调查技术导则》(HJ 25.1—2019)[15],采用分区布点法,考虑场地功能分布,在电镀车间、废水处理池和硝酸银生产车间均布设样点,选取不同重金属污染程度的13个样点(S1~S13)进行研究。
每个土样采用五点混合采样法采集表层土壤(0~20 cm),将土壤样品装入自封袋中做好标记带回实验室。将带回实验室的土样置于干燥通风处自然晾干,土样去除石块及植物根系等杂物后碾磨,分别过10目和100目尼龙筛备用。
1.2 蚯蚓毒性效应实验
本实验的受试蚯蚓为赤子爱胜蚓(Eiseniafoetida),购自天津惠裕德生物科技有限公司。实验前先将蚯蚓在人工培养箱里预培养14 d,培养箱温度设为(20±1) ℃,湿度75%,光照20%。预培养后选取体质量200~300 mg发育好具有明显环带的成蚓进行微宇宙实验。
本研究采用室内土壤微宇宙实验。首先取500 g干土,加入一定量的去离子水使其含水量为35%,混合均匀后放入塑料烧杯中。然后在每个烧杯中放置15条蚯蚓,用保鲜膜封口,将保鲜膜上扎几个小孔,保证蚯蚓可正常呼吸同时减少土壤水分蒸发。将每个烧杯编号,放置于人工气候箱中(培养箱温度设定为(20±1) ℃,湿度为75%,光照为20%,白天∶黑夜=12 h∶12 h。根据采集到的土壤量,实验共设置13个处理(S1~S13),每个处理设置4个重复。培养14 d后,随机取出8~10条蚯蚓,经24 h滤纸清肠洗净后,测定蚯蚓体内重金属含量(干重)和酶活。本实验暴露过程中各土样蚯蚓的存活率均在80%以上。
1.3 土壤理化性质及重金属含量分析
1.3.1 土壤理化性质测定
土壤pH测定采用土水比1∶2.5混合后用pHS-3C型pH计(上海仪电,中国)测定[16]。土壤总有机碳采用盐酸预处理后,用元素分析仪ElementarVario ELⅢ(Hanau,德国)直接测定[17]。土壤阳离子交换量依据《土壤 阳离子交换量的测定 三氯化六氨合钴浸提-分光光度法》(HJ 889—2017)[18]测定。土壤重金属有效态依据《土壤8种有效态元素的测定 二乙烯三胺五乙酸浸提-电感耦合等离子体发射光谱法》(HJ 804—2016)[19],对2 mm风干土采用二乙烯三胺五乙酸(DTPA)浸提法测定。
1.3.2 重金属测定
土壤重金属测定:土壤重金属含量的测定采用HNO3-HF-HClO4-HCl四酸消解法[20],采用ICP-MS(7500A,安捷伦,美国)测定样品中Cd、Ni、Cr和Pb含量,采用ICP-OES(Optima 8300,珀金埃尔默,美国)测定样品中Zn含量。每批样品设置3个空白对照组、10%样品的重复和3个标准物质,其中标准物质使用国家标准土壤物质GSS-27进行质量控制,回收率为83.0%~119%之间。
蚯蚓重金属累积含量测定:将待测蚯蚓放入有湿润滤纸的培养皿中,进行24 h吐泥,后用去离子水冲洗干净,冷冻干燥48 h,使用研钵磨碎后采用微波消解法(GB 5009.268—2016)[21]在微波消解仪(Multiwave PRO, Anton Paar,奥地利)中进行消解,采用ICP-MS(7500A,安捷伦,美国)测定样品中Cd、Ni、Cr、Pb和Zn含量。每批样品设置3个空白对照组、10%样品的重复和3个标准物质,其中标准物质使用国家标准物质猪肝GBW10051(GSB-29)进行质量控制,回收率为85.1%~123%之间。
1.4 蚯蚓生物标志物响应测定
取清肠后蚯蚓3~4条,称量质量,液氮迅速冷冻,按照样品质量(g)∶缓冲液体积(mL)=1∶9的比例加入PBS缓冲液(pH=7.4),4 ℃冰浴下使用组织研磨器充分研磨,将研磨好的10%组织匀浆经离心机2 000 r·min-1离心10~15 min,离心后取上清液,置于-80 ℃冰箱保存。
蚯蚓生物标志物均使用试剂盒测定,严格按照试剂盒内说明进行操作。总蛋白选用BCA法,SOD选用WST-1法,CAT选用可见光法,GSH选用微板法,MDA和MT选用酶联免疫分析(ELISA法)。总蛋白定量测定试剂盒(A045-3-2)、SOD测定试剂盒(A001-3-2)、CAT测定试剂盒(A007-1-1)和GSH测定试剂盒(A006-2-1)购自南京建成生物工程研究所,昆虫MDA酶联免疫分析(ELISA)试剂盒(CD92025)和昆虫MT酶联免疫分析(ELISA)试剂盒(CD92144)购自武汉纯度生物有限公司。
1.5 数据分析
1.5.1 有效生物标志物筛选
首先对生物标志物进行KMO(Kaiser-Meyer-Olkin)检验和Bartlett检验,判断对其进行主成分分析(principal component analysis, PCA)的可行性。然后对生物标志物进行多元分析,通过PCA分析和聚类分析将不同样点分成多个组,并通过相似性分析(analysis of similarities, ANOSIM)检验分组是否具有统计学意义。最后,采用BVSTEP方法筛选有效生物标志物,并对所筛选的有效生物标志物与第一主成分进行回归分析,得到有效生物标志物与蚯蚓健康状况的关系。
1.5.2 主导污染物识别
采用典范对应分析(canonical correspondence analysis, CCA)确定生物标志物和污染物暴露指标之间的相关关系,采用方差膨胀因子法(variance inflation factor, VIF)对CCA建模中冗余环境因子进行选择[22],最后根据CCA结果筛选出主导污染物。
1.5.3 数据分析
本研究采用Microsoft Excel 2016进行原始数据处理;采用SPSS 24.0对土壤理化性质和土壤重金属含量进行数据统计性描述,对蚯蚓生物标志物进行单因素方差分析(one-way analysis of variance, ANOVA);采用Origin 2018软件对蚯蚓生物标志物响应进行多元分析;采用R语言进行ANOSIM分析和BVSTEP分析;采用Canoco5软件进行VIF和CCA分析;采用SPSS 24.0进行多元回归分析;采用Origin 2018软件完成作图。
2 结果与讨论(Results and discussion)
2.1 土壤理化性质及重金属含量
如表1所示,13个场地土壤样品的Cd、Cr、Cu、Ni、Pb和Zn等6种重金属总量和DTPA提取态含量变异较大,变异系数分别为93.8%~309%和114%~315%之间,其中土壤Cd和Zn的总量及DTPA提取态含量均较高。土壤pH值和CEC的变异较小,有机质含量整体较低,大多在1%以下。

表1 供试土壤关键理化性质、重金属总量和DTPA提取态含量Table 1 The total and DTPA extracted heavy metal concentration and the key physical-chemical properties of the tested soils
2.2 蚯蚓组织重金属生物累积特征
蚯蚓组织重金属生物累积特征如图1所示,与以往研究结果一致[23-24],蚯蚓对不同重金属的吸收和富集能力不同,对6种重金属的平均富集系数的大小顺序为:Cd>Cu>Zn>Ni>Pb>Cr。其中,Cu和Zn的富集系数接近,这一现象与多数报道结果[25-26]一致,这是因为Cu和Zn元素均为生物必需元素;Cr、Ni和Pb的生物富集系数之间的差异也较小,并且这3种元素与Cd、Cu和Zn相比均明显较低,这主要是由于这3种元素在土壤中的生物有效性含量较低。同时,蚯蚓对Cd的BCF均值为4.00,而其他元素BCF均值均<1,这是因为土壤中Cd具有较强的迁移性,易被蚯蚓吸收富集[27-28]。譬如,本研究中Cd的DTPA浸提率为7.71%~22.0%,明显高于其他5种元素;并且蚯蚓能够通过取食摄入和皮肤直接吸收2种方式吸收累积土壤中的Cd,对于其他元素,取食摄入与土壤成分结合的重金属,是其进入蚯蚓组织的最主要方式[29]。
此外,本研究采用了野外实际污染土壤,存在多金属复合污染现象,复合污染元素之间的相互作用能够影响生物的吸收和累积。Traudt等[30]在植物试验中发现,重金属Ni、Cu和Cd复合污染下,植物Lemnaminor对这3种重金属的吸收均存在竞争作用,但是进入植物组织内以后只有Cu与Cd之间存在着竞争作用。因此,在复合污染生态效应评价中必须考虑污染物的生物累积特征。
2.3 有效生物标志物筛选
对不同污染程度土壤样品培养下的蚯蚓生物标志物毒性响应进行单因素方差分析,结果如表2所示,6种蚯蚓生物标志物响应均呈显著差异(P<0.01)。对蚯蚓生物标志物毒性响应数据采用KMO检验和Bartlett检验,结果表明,KMO为0.503(>0.5)且Bartlett检验显著(P<0.01),表明该数据可以采用PCA进行分析。PCA和聚类分析结果(图2(a))表明,PC1和PC2的方差贡献率分别为30.1%和23.6%;不同样点土壤处理下生物标志物响应可以分为3个组,第1组(G1)包括S3、S7、S8和S9,第2组(G2)包括S2和S13,第3组(G3)包括S1、S4、S5、S6、S10、S11和S12。对分组结果进行ANOSIM分析,结果表明3个分组的样点之间存在显著差异(P<0.01)。而对3个组之间土壤重金属总量、DTPA提取态含量以及蚯蚓生物累积浓度之间的污染物生物体内和体外暴露量进行比较分析发现,重金属Cd和Zn在G1的3类暴露指标与G3相比均显著较高(P<0.05),与G2相比升高程度不显著;而其他的重金属在3个组之间均无显著差异(图3)。因此可以认为,在3个组的样点土壤培养下蚯蚓健康状况由好到差的次序如下:G3>G2>G1;PC1从左到右也因此体现了蚯蚓健康状况由差至好的趋势。
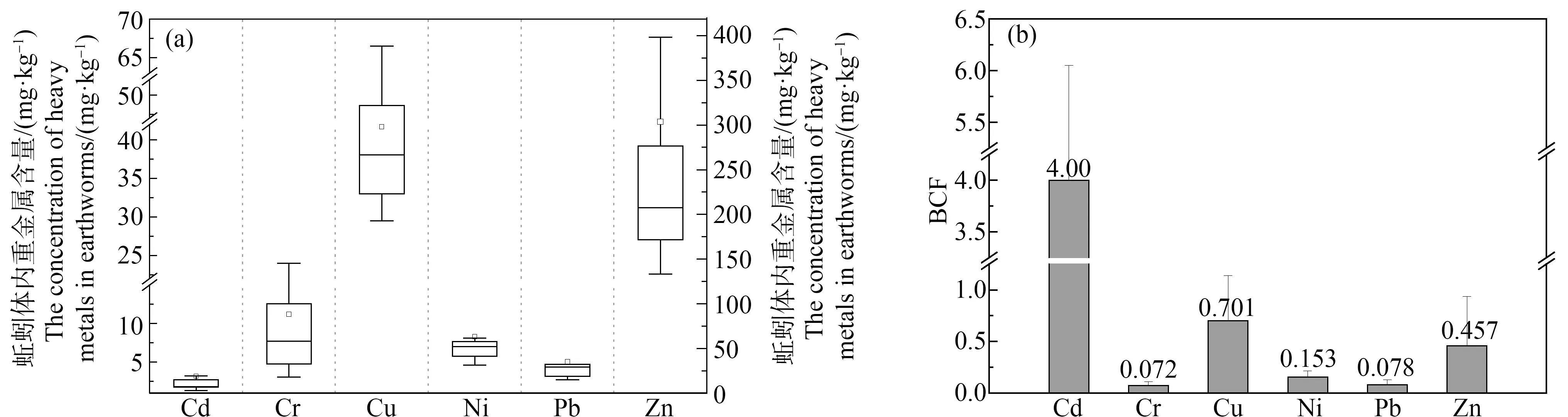
图1 蚯蚓组织重金属的生物累积量(a)和生物富集系数(BCF)(b)注:图(a)中Cd、Cr、Cu、Ni和Pb采用左边的纵坐标,Zn采用右边的纵坐标。Fig. 1 The concentrations (a) and the bioconcentration factors (BCF) (b) of heavy metals in earthwormsNote: In Fig.(a), Cd, Cr, Cu, Ni and Pb correspond to the ordinate on the left, and Zn corresponds to the ordinate on the right.
通过BVSTEP法进行有效生物标志物筛选,结果表明,GSH、MDA和CAT的组合与其他所有生物标志物的组合显著相关,因此,它们的组合可以视为所有生物标志物响应的最小数据集。通过3个有效生物标志物响应与主成分1(PC1)的回归分析结果(图2(b)~(d))发现,GSH和MDA含量随着蚯蚓健康状况的增加而显著降低(P<0.01),而CAT活性随着健康状况的增加而显著增加(P<0.01)。
2.4 土壤主导污染物识别
进一步采用CCA分析生物标志物响应与土壤重金属总量、DTPA提取态含量和蚯蚓重金属生物累积量之间的相关性。采用VIF法对CCA建模中的冗余环境因子进行选择,结果表明只有DTPA-Cu和DTPA-Pb的VIF值>10(表3),说明两者之间存在显著自相关关系(P<0.01),而土壤重金属总量和蚯蚓生物累积量在6种重金属之间不存在多种共线性。因此仅对土壤重金属DTPA提取态含量与生物标志物响应的CCA分析中剔除了DTPA-Cu。CCA分析结果表明,首先,土壤重金属总量对生物标志物响应变化的相关性显著的为Cu、Cd、Zn和Pb元素,贡献率分别为3.90%、54.0%、17.3%和11.8%;土壤重金属DTPA提取态相关性显著的元素为Cr、Cd和Zn元素,贡献率分别为5.40%、53.8%和22.7%;蚯蚓生物累积重金属相关性显著的元素为Cd、Cu和Zn元素,贡献率分别为41.1%、14.6%和28.2%(图4)。
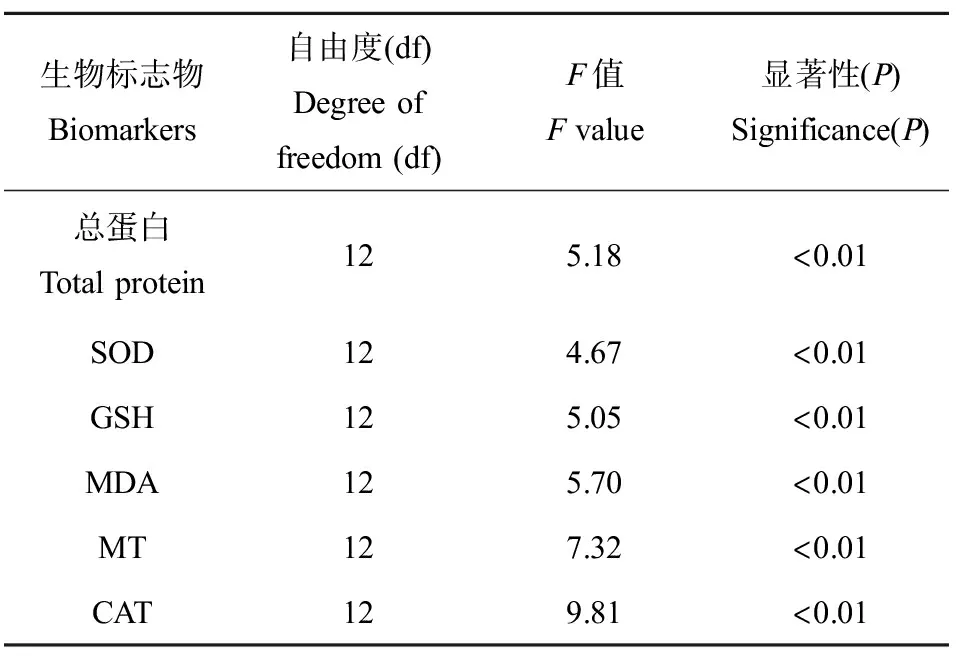
表2 不同重金属污染程度的样点土壤中蚯蚓生物标志物响应的方差分析Table 2 ANOVA of biomarker responses in earthworms treated with different levels of heavy metal contaminated site soil

图2 蚯蚓生物标志物响应的多元分析注:(a) PCA结合聚类分析;(b~d) 有效生物标志物GSH、MDA、CAT与第一主成分之间的回归分析结果。Fig. 2 Multivariate analysis of biomarkers responses of earthwormsNote: (a) Principal component analysis (PCA) superimposed with cluster analysis; (b)~(d) Regression analysis between each effective biomarkers GSH, MDA and CAT and the first principle factor.
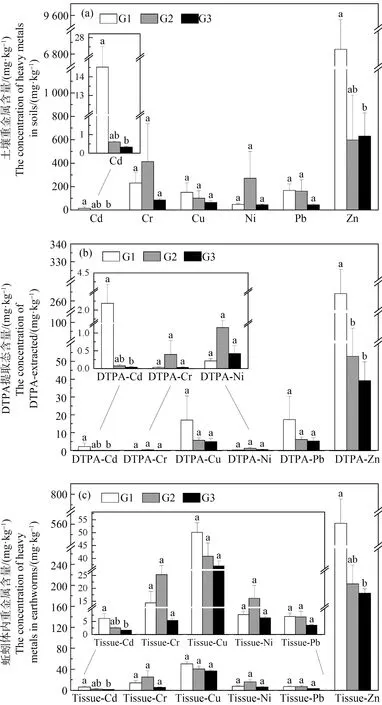
图3 不同样点分组(G1、G2、G3)之间重金属含量的比较注:(a) 土壤总量;(b) DTPA提取态含量;(c) 蚯蚓体内生物累积量的比较。Fig. 3 Comparison in heavy metal concentrations among the three divided groups (G1, G2, G3)Note: (a) Soil total heavy metal concentrations; (b) DTPA-extracted heavy metal concentrations; (c) Earthworm bioaccumulation of heavy metal concentrations.
由此可见,重金属Cd和Zn对生物标志物响应变化的贡献率在3类暴露方式下均较高,综合以上3个组(G1、G2和G3)体内和体外重金属暴露量比较结果,可以认为重金属Cd和Zn为引起蚯蚓生物标志物响应变化的主导污染物。
2.5 重金属复合污染对蚯蚓生物标志物的毒性效应评价
对3类特征生物标志物响应,即,GSH、MDA和CAT分别进行与主导污染物Cd和Zn的土壤总量、DTPA提取态含量以及蚯蚓生物累积量的逐步回归,结果如表4所示,蚯蚓GSH含量的变化与土壤Cd总量及Zn的DTPA提取态含量之间存在多元线性关系;蚯蚓MDA含量的变化能够通过土壤Cd的DTPA提取态含量进行预测;CAT活性的变化能够通过Zn的土壤总量及蚯蚓生物累积含量进行预测。
由于蚯蚓的GSH含量和CAT活性的变化涉及2种类型的污染物暴露,因此基于表4的回归方程,进一步采用CA模型来综合计算2类暴露的复合半效应浓度[31],结果如图5所示。以蚯蚓组织GSH含量变化为毒性效应终点的土壤Cd总量及Zn的DTPA提取态含量的复合半效应浓度(EC50mix)在各个样点均低于实测浓度(图5(a));以MDA含量变化为毒性效应终点的EC50值在S3、S7、S8和S9等4个样点低于实测值(图5(b));以蚯蚓组织CAT为毒性效应终点的土壤Zn总量及蚯蚓生物累积含量的EC50mix值在S2、S3、S4、S7、S8、S9和S10等7个样点低于实测值。以上结果一方面表明,3类有效生物标志物的敏感性从高到低的顺序为:GSH>CAT>MDA。这3类生物标志物都与生物的抗氧化系统有关,其中GSH作为一种含有巯基基团的三肽,易与重金属离子结合,减轻重金属污染物对蚯蚓组织的损伤;此外,重金属污染物会造成蚯蚓体内活性氧(ROS)升高,GSH作为一种重要的还原剂底物,在清除ROS的生化反应中起重要作用,并被氧化为氧化型谷胱甘肽(GSSG)[12,32]。当GSH消耗量突然増高导致其含量下降时,作为一种对环境污染的应激机制,生物体会诱导合成更多的GSH作为反馈[33]。另一方面,从主成分分析及多元回归分析的结果中可以发现,不同元素以及不同类型暴露之间(如,与GSH含量变化对应的土壤总Cd与DTPA-Zn),以及同一元素不同暴露之间(如,与CAT活性变化对应的土壤总Zn与蚯蚓组织生物累积Zn)都有可能存在交互作用,而这些污染物暴露之间不存在暴露量变化的相关性。尤其是土壤总Zn与生物累积Zn之间,由于Zn元素对生物的独特作用,导致蚯蚓的生物累积Zn与土壤总Zn含量之间的相关性不显著,但是2类暴露均与CAT活性变化有关。
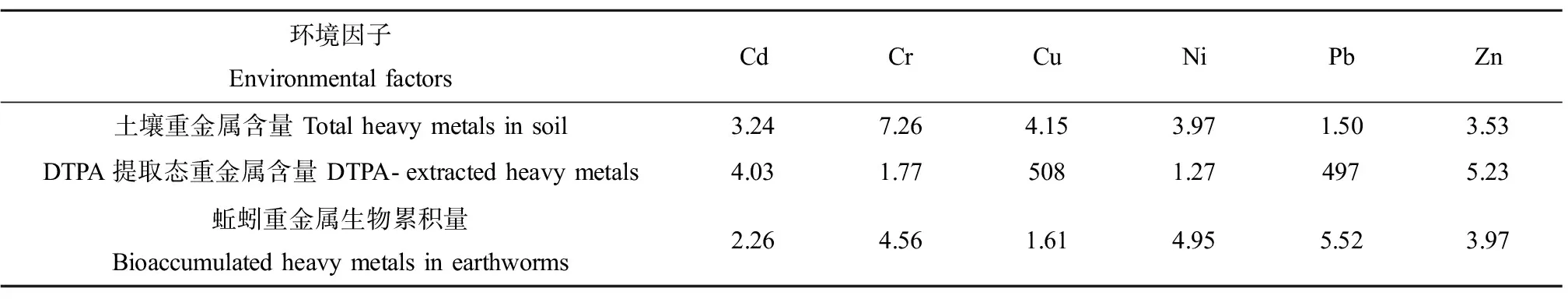
表3 方差膨胀因子分析(VIF)Table 3 Variance inflation factor (VIF) analysis

图4 蚯蚓生物标志物响应与土壤重金属(a)、土壤DTPA提取态含量(b)和蚯蚓重金属累积量(c)的CCA分析结果Fig. 4 CCA analysis of biomarkers responses of earthworms and the concentration of heavy metals (a), the concentration of DTPA-extracted in soils (b), and the concentration of heavy metals in earthworms (c)
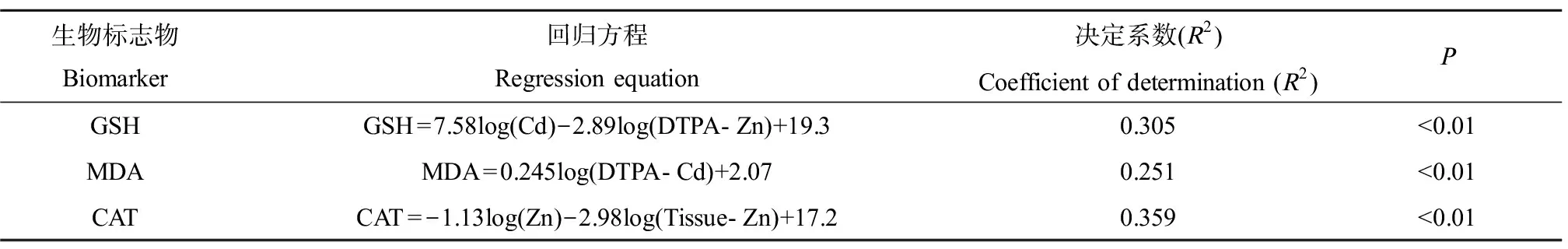
表4 有效生物标志物响应与重金属暴露的回归方程Table 4 Regression equations between the responses of effective biomarkers and heavy metal exposures

图5 主导污染物暴露的EC50值及其实测值的比较Fig. 5 Comparison of calculated EC50 and measured concentration of dominant heavy metals
综上所述,本研究结果表明,针对野外实际土壤重金属复合污染,采用多元统计分析手段,通过有效生物标志物响应、主导污染物的筛选以及联合效应估算,能够实现生态效应的定量评价。

