能量缓释拟谷物淀粉微球的构建及食用品质分析
赵起越,王思宇,胡晓沛,郭 凯,李拖平,李苏红
(沈阳农业大学食品学院 沈阳 110866)
淀粉是人类碳水化合物的重要来源,为人体健康和各种生理功能的运行提供必要的能量支持[1]。随着生活水平提高,能量物质过度摄入导致一些慢性非传染性疾病,如糖尿病、高血压、高血脂等发病几率不断上升。人们越来越多地关注食物摄入后是否会引起餐后血糖值的快速上升,从而导致负面的健康影响。能量缓释是指食用某种食品后不会使血糖迅速升高且产生血糖峰值,而葡萄糖能够缓慢释放并保持精力充沛[2]。具有能量缓释效果的食品将成为新的研究热点。根据淀粉在人体内的消化速率可分为快消化淀粉(Rapidly digestible starch,RDS)、慢消化淀粉 (Slowly digestible starch,SDS)及抗性淀粉(Resistant starch,RS)[3]。其中SDS 在人体内被缓慢消化,逐步释放葡萄糖,可维持稳定的餐后血糖,有效改善餐后血糖负荷,降低餐后胰岛素分泌,提高机体的胰岛素敏感性[4],同时增加饱腹感,提供持久稳定的能量作用[5]。
影响淀粉消化性的因素有很多,除淀粉颗粒的内在结构显著影响其消化性外,还与一些外在因素有关。淀粉的化学改性如醚化、酯化、接枝、交联等,会影响淀粉的消化性[6];食品体系中的其它组分如蛋白、脂质、多酚及食用胶等也会影响淀粉的消化性[7-10]。食品胶体可在淀粉分子外围形成物理屏障,能够在一定程度上降低淀粉的RDS 含量并提高RS 含量,具有可操作性强、成本低廉且安全性更高的特点[11-12],因而引起研究者的重视。目前的一些研究表明,食用胶与淀粉结合后能够降低RDS,提高RS,然而改变的幅度及可控性仍不理想,对SDS 的影响也十分有限,食用后仍会引起血糖较大波动,并未达到很好的能量缓释效果。
聚电解质复合物 (Polyelectrolyte complexes,PECs) 是带有相反电荷的聚电解质(Polyelectrolyte,PE) 通过静电相互作用形成的一种水溶性高分子复合物[13]。由天然PEs 制备的PECs 不含化学共价交联剂,安全无毒、耐受性好、细胞相容性好,可作为纳米颗粒、水凝胶、支架或凝聚体应用于生物、医学等多个领域[14-16]。PECs 具有很好的缓释性能,主要应用于构建活性成分的缓释微球。壳聚糖是自然界中唯一的阳离子多糖,在人体内可被降解为氨基糖,具有良好的生物相容性[17],被广泛应用于PECs 的研究中。利用海藻酸钠-壳聚糖PECs 包埋核桃多酚构建微球,能有效避免多酚在胃肠道的降解,表现出良好的缓释特性[18]。肉桂醛-海藻酸钠-壳聚糖缓释性纳米粒,显著避免了肉桂醛的光氧化,保护了其天然防腐功能[19]。PECs凝胶的孔隙率很低,机械强度较高,与海藻酸钠-钙离子凝胶相比,作为包埋材料可大大减少芯材的泄漏,具有更为优良的缓释效果[20]。结冷胶是一种无毒、无害的阴离子多糖,具有较强的抗酶解作用,并且其通过加热冷却形成的凝胶具有坚硬的机械强度,可弥补海藻酸钠凝胶强度弱的缺点,然而结冷胶和海藻酸钠协同作为PECs 凝胶原料的研究报道很少。目前尚无关于将PECs 应用于SDS领域的研究报道。理论上,利用淀粉与PECs 构建凝胶微球,提高淀粉中的SDS 含量,实现能量的缓释,使消化初期血糖处于较低水平,维持血糖的平稳,成为具有功能性质的能量缓释淀粉微球具有可行性。
马铃薯淀粉(Potato starch,PS)与谷物淀粉相比,其颗粒表面光滑、紧实、无裂缝,抗酶解能力强,原淀粉中RS 含量较高[21]。本研究以PS 为研究对象,将带有负电荷的海藻酸钠和结冷胶与带有正电荷的壳聚糖结合,形成聚电解质复合物凝胶包裹PS,构建能量缓释拟谷物淀粉微球。探讨淀粉凝胶微球构建条件对其SDS 增量的影响并进行响应面优化。进一步制备RS 含量更高,抗消化性更强的PS-月桂酸 (Potato starch-lauric acid,PSL)复合物凝胶微球。对两种能量缓释微球作为模拟谷物的可能性进行评估,分析其蒸煮品质与质构特性,并与大米、小米两种日常谷物进行对比,综合评价其食用品质。本研究为慢消化淀粉食品的研发提供了新思路。
1 材料与方法
1.1 材料与试剂
马铃薯淀粉为市场购买。
海藻酸钠、结冷胶、壳聚糖、无水氯化钙、冰乙酸、月桂酸(Lauric acid,C12 ∶0)、盐酸、磷酸氢二钠、磷酸二氢钠、碘、3,5-二硝基水杨酸,国药集团化学试剂有限公司;无水乙醇,沈阳市东兴试剂厂;猪胰α-淀粉酶,Sigma-aldrich 公司;糖化酶,上海瑞恩生物科技有限公司。
1.2 仪器与设备
DHL-A 恒流泵,上海青浦沪西仪器厂;UV-5100 紫外可见分光光度计,上海元析仪器有限公司;JHH6A 数显恒温水浴锅,常州智博瑞仪器制造有限公司;DHG-9070S 电热鼓风干燥箱,宁波乐电仪器制造有限公司;SPX-150A 恒温培养箱摇床,常州市国旺仪器制造有限公司;SC-3614 低速离心机,中科中桂仪器有限公司;CT3 质构仪,美国Brookfield 公司;BPH-303 pH 计,上海元析仪器有限公司。
1.3 试验方法
1.3.1 RDS、SDS、RS 含量测定 根据Englyst 等[22]的方法稍作修改。将400 mg 不同条件下构建的PSM 加入到含有15 mL,pH 5.2,浓度为0.2 mol/L 的醋酸钠缓冲液和3 个玻璃球的50 mL 离心管中。旋紧管盖后将其置于沸水浴中加热30 min,期间定期摇动避免结块。将悬浮液冷却并放入37 ℃水浴摇床中,加入5 mL 含1 450 U 胰α-淀粉酶和75 U 糖化酶的混合酶溶液水解淀粉。在反应10,20,60,120 min 时,将1 mL 水解液与4 mL无水乙醇混合以终止反应。将混合物在3 500 r/min 下离心2 min,并根据3,5-二硝基水杨酸(DNS)法测量上清液中的葡萄糖含量[23]。样品的淀粉水解率计算如下:
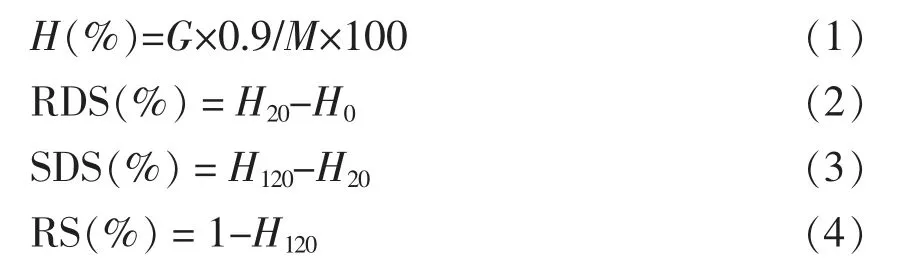
式中,H——淀粉水解率;G——水解产生的葡萄糖量(mg);0.9——从葡萄糖到淀粉的摩尔质量转化常数;M——淀粉样品的质量 (mg);H20和H120——20 min 和120 min 时的淀粉水解率。
1.3.2 能量缓释拟谷物淀粉微球 (Potato starch microspheres,PSM)的构建 将5 mL 海藻酸钠溶液、5 mL 结冷胶溶液以及一定质量的马铃薯淀粉(PS)充分混合均匀,通过恒流泵以50 r/min 的转速将混合液经过注射器针头(0.45 mm×16 mm)滴入100 mL 壳聚糖溶液(用1%乙酸溶液溶解)中,静置浸泡1 h 使混合液液滴与壳聚糖充分反应成凝胶球体结构,然后使用纱布将凝胶微球从壳聚糖溶液中滤出,将微球在40 ℃的烘箱中烘干。
1.3.3 制备条件对能量缓释拟谷物淀粉微球SDS含量的影响 分析微球制备体系中,当马铃薯淀粉添加量分别为1,2,3,4,5 g 时,对PSM 中SDS含量的影响,其中海藻酸钠溶液和结冷胶溶液浓度均为0.046 mol/L,壳聚糖溶液浓度为0.012 mol/L。
分析海藻酸钠溶液浓度分别为0,0.009,0.018,0.028,0.037,0.046,0.055 mol/L 时,对PSM中SDS 含量的影响,浓度为0 时即用5 mL 结冷胶溶液代替海藻酸钠溶液。其中结冷胶溶液浓度为0.046 mol/L,壳聚糖溶液浓度为0.012 mol/L,PS 添加量为1 g。
分析结冷胶溶液浓度对PSM 中SDS 含量的影响,用海藻酸钠溶液代替结冷胶溶液即可。
分析壳聚糖溶液浓度分别为0.003,0.006,0.009,0.012,0.016 mol/L 时,对PSM 中SDS 含量的影响,其中海藻酸钠溶液浓度为0.046 mol/L,结冷胶溶液浓度为0.009 mol/L,PS 添加量为1 g。
1.3.4 能量缓释拟谷物淀粉微球制备条件的优化 在单因素实验结果的基础上,利用Design-expert 8.0.6 分析软件对应的Box-Benhnken 做响应面试验设计,优化微球制备条件。以海藻酸钠溶液浓度(A),结冷胶溶液浓度(B)以及壳聚糖溶液浓度(C)3 个因素为响应面变量,以PSM 中的SDS含量(Y)为响应值,试验因素和水平见表1。
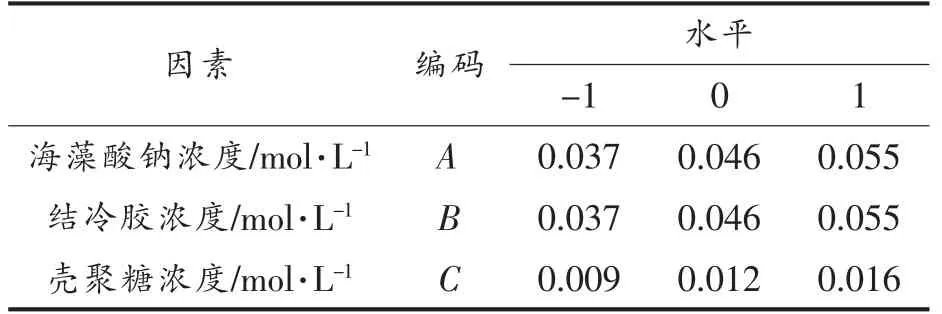
表1 响应面试验因素及水平Table 1 Factors and level of response surface test
1.3.5 淀粉-月桂酸复合物 (Potato starch-lauric acid,PSL) 能量缓释拟谷物淀粉微球的制备 将320 mg月桂酸和4 g PS 分散于80 mL 去离子水中,在室温(25±1)℃下搅拌混匀后,将混合物置于沸水浴中加热5 min,期间持续搅拌,使PS 和月桂酸充分接触反应。最后,将糊状物自然冷却至室温。
用PSL 复合物替代PS,以同样的方式制备淀粉-月桂酸复合物能量缓释微球(PSLM),进行下一步研究。
1.3.6 能量缓释拟谷物淀粉微球的食用品质评价
1.3.6.1 能量缓释拟谷物淀粉微球蒸煮品质 蒸煮品质分为吸水率、膨胀率、汤液pH、汤液干物质量以及汤液碘蓝值。以大米和小米两种常见谷物为对照,准确称取1 g 的大米、小米、PSM 和PSLM,放置于已知质量的铜丝笼内,一起放置于烧杯中,加入120 mL 蒸馏水,放于电炉上加热煮沸30 min,取出铜丝笼放于烧杯上直至无汤滴落,冷却10 min。
吸水率计算公式为:

样品膨胀体积计算公式为:

米汤pH 值测定:对烧杯中冷却至室温的米汤使用pH 计测定其pH 值。

汤液干物质量的测定:将测完pH 值的汤液用蒸馏水稀释至100 mL,在8 000 r/min 下离心30 min,将上清液放入烘箱中烘干并称重。汤液干物质量计算公式为:米汤碘蓝值的测定:取离心后的汤液1 mL,加入50 mL 蒸馏水、1 mL 0.5 mol/L HCL 溶液,1 mL 0.2 mol/L 碘试剂,用蒸馏水定容至100 mL。用紫外分光光度计在600 nm 波长处测吸光度。
1.3.6.2 能量缓释拟谷物淀粉微球质构特性 使用质构仪TPA 模式测定样品硬度,通过比较大米、小米、PS 球和PS-Lau 球的硬度、黏性、弹力、内聚性、胶着性和咀嚼性判断微球的食用品质。设定参数:TA39 探头,触发点负载5 g,测定速度0.5 mm/s,测定距离1 mm,每个样品重复10~12 次,取平均值。
1.3.7 数据处理与分析 所有试验均重复3 次,试验分析采用Origin 9.0 软件对数据进行图表处理;统计分析应用SPSS 19.0 软件,多组均数比较采用单因素方差分析中Ducan 进行显著性分析,以P<0.05 表示两者之前存在显著差异。
2 结果与分析
2.1 制备条件对能量缓释拟谷物淀粉微球中SDS 含量的影响
马铃薯淀粉PS 添加量对PSM 中SDS 含量有显著影响,如图1a 所示,天然PS 的SDS 含量仅有5.94%,形成PSM 后SDS 含量有大幅上升。随着PS 添加量的增大,PSM 中SDS 含量呈降低趋势。当增大到3 g 时,SDS 含量降低至42.6%,且不再发生显著变化。说明在微球形成过程中PS 添加量在一定范围内,PECs 可以对单个淀粉颗粒进行包裹,从而更好地降低淀粉的水解率;随淀粉添加量的增加,淀粉颗粒团聚,难以对单个淀粉颗粒进行完整的包裹,裸露的淀粉量增多,因此淀粉的水解率相对升高。同时,PS 添加量越大,形成微球的粒径也越大。考虑到实际生产效率,淀粉添加量不可过低,因此,将PS 添加量选定为1 g 比较适宜。
海藻酸钠是一种线性天然阴离子多糖,具有良好的成膜性、透气性等特点,被广泛应用于食用薄膜等领域[24]。海藻酸钠溶液浓度对PSM 的SDS含量的影响如图1b 所示,当PECs 体系中只有结冷胶-壳聚糖时,SDS 含量很低只有16.53%,说明单纯由结冷胶-壳聚糖形成的PECs 凝胶缓释效果较差,这可能是由结冷胶的分子特点决定的,Dixit等[25]的研究也发现结冷胶-壳聚糖凝胶对甲硝唑的缓释能力较差。随着体系中海藻酸钠浓度的升高SDS 含量显著提高。这说明由海藻酸钠-结冷胶-壳聚糖所构建的PECs 可更高效地延缓淀粉的消化。随着海藻酸钠含量的增加,形成的PECs凝胶膜壁的厚度和致密性增大,使淀粉难以透过凝胶膜扩散到溶液中,因此淀粉消化速率降低,缓释效果明显[22]。当浓度达0.046 mol/L 时,SDS 含量达54.64%,并不再显著增加。
结冷胶是一种胞外阴离子多糖,分子链上的羧基也可与壳聚糖形成PECs。结冷胶与PS 之间有良好的相容性,可以包裹在淀粉颗粒表面,抑制PS 的糊化[26]。图1c 表明,单纯由PS-海藻酸钠-壳聚糖形成的PSM 中,SDS 含量为30.32%,远高于PS-结冷胶-壳聚糖(图1b)。随着结冷胶的加入,增强了PECs 凝胶的缓释性能,SDS 的含量进一步提高。这是由于一方面结冷胶的加入提高了PECs的致密性和缓释效果,另一方面,结冷胶具有良好的凝胶性,蒸煮加热又冷却后,PSM 中未反应的结冷胶还可自动聚集形成稳定的凝胶,进一步增强了PSM 中凝胶骨架的机械强度,从而使缓释效果得以提升。当结冷胶浓度从0.046 mol/L 增加到0.055 mol/L 时,SDS 含量不再显著增加,且此时溶液黏度达到饱和,无法继续溶解结冷胶。图1b~1c,充分说明海藻酸钠和结冷胶在与壳聚糖形成PECs 过程中能够起到协同增效的作用。

图1 制备条件对PSM 中SDS 含量的影响Fig.1 Effect of preparation conditions on SDS content in PSM
壳聚糖是自然界中唯一的阳离子多糖,在整个体系中是不可或缺的。如图1d 所示,SDS 的含量随体系中壳聚糖浓度的增大而增大,这是因为当浓度较低时,形成的PECs 凝胶膜较薄,机械强度差,易变形[27]。随着浓度的增大,所形成凝胶膜的结构变得愈加稳定,缓释效果增强。如果浓度过大会导致溶液黏度过大,不利于液滴在溶液中的分散,影响PSM 的球形结构。当浓度高于0.012 mol/L 时,SDS 含量不再显著上升。
2.2 能量缓释拟谷物淀粉微球制备条件的优化
采用Box-Behnken 响应面试验设计 (见表2),利用Design Expert 8.0.6 软件对表1的数据进行多元回归拟合,得到PSM 中SDS 含量(Y)对海藻酸钠溶液浓度(A)、结冷胶溶液浓度(B)、壳聚糖溶液浓度(C)多元回归方程为:
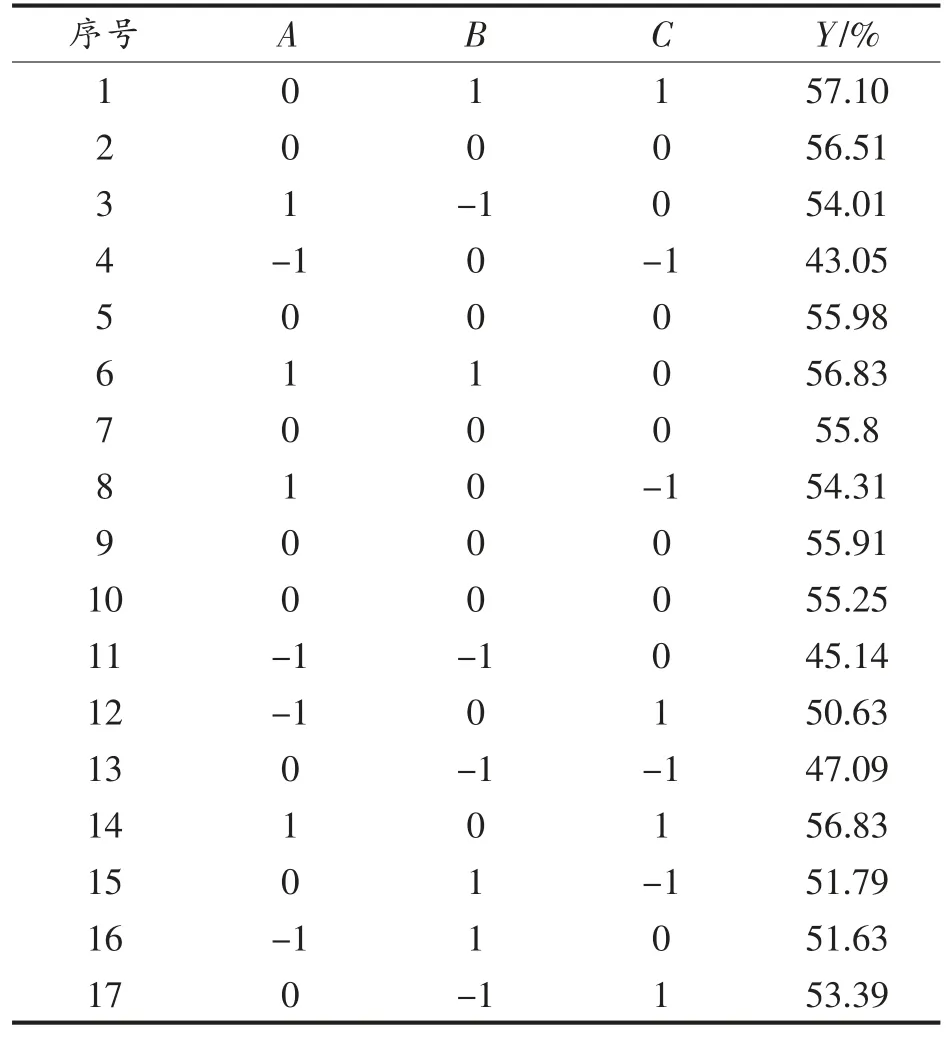
表2 Box-Behnken 试验方案及结果Table 2 Box-Behnken test scheme and results
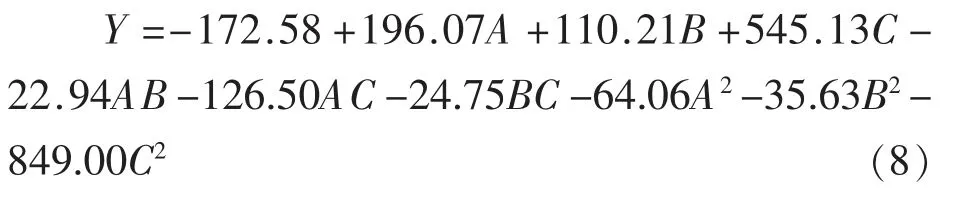
对回归模型进行方差分析(表3)可知,模型的P<0.0001,达到极显著水平,证明模型可用。其中失拟项不显著(P>0.05),说明试验残差是由随机误差引起的。模型的R2=0.9911,R2adj=0.9797,可见该回归方程与数据的拟合性良好,能相对准确地反映结果,可以用来对PSM 中的SDS 含量进行分析和预测。根据F 值可知试验因素对结果影响的主次顺序为A>C>B,即海藻酸钠溶液浓度>壳聚糖溶液浓度>结冷胶溶液浓度。
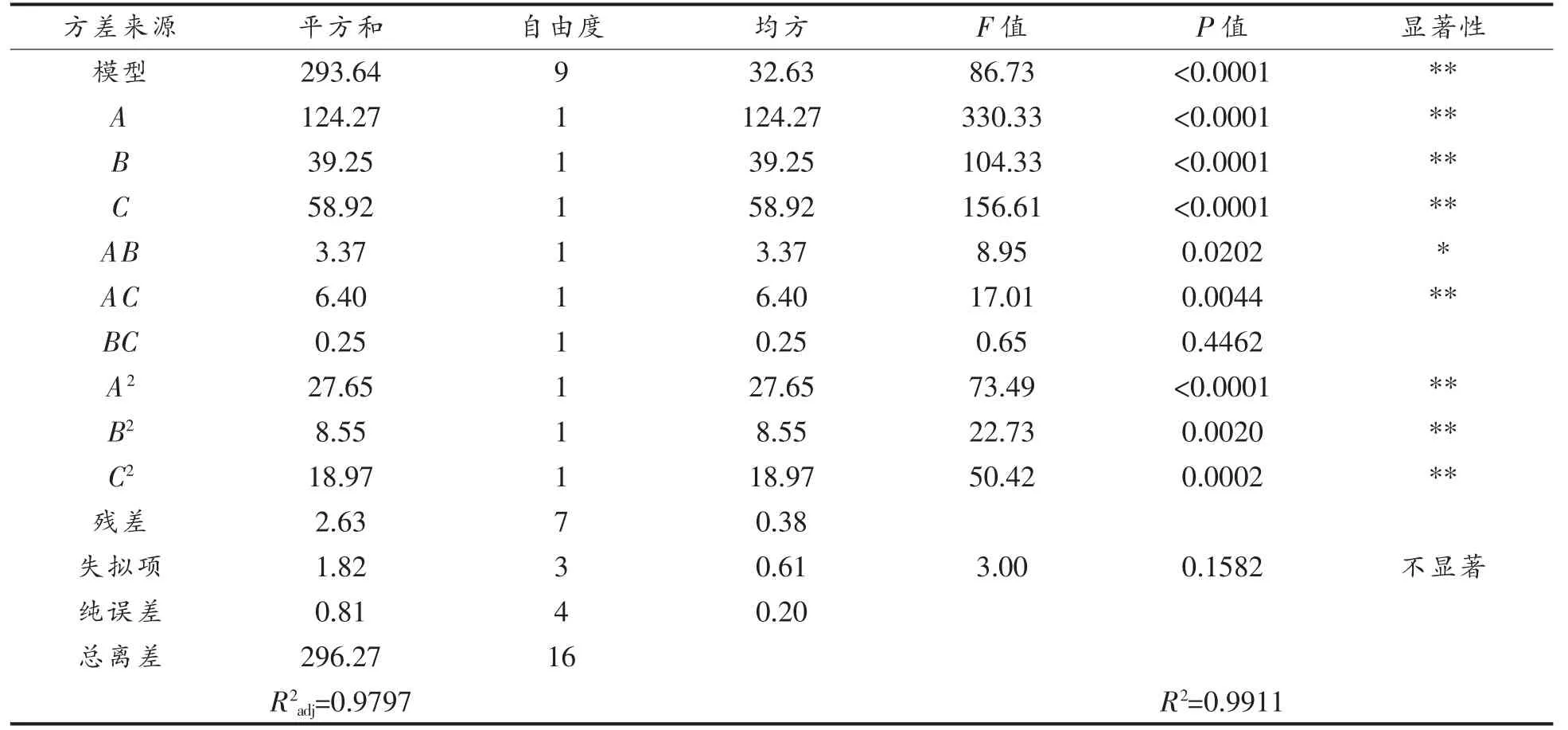
表3 回归模型的方差分析Table 3 Analysis of variance of regression model
各个因素对PSM 中SDS 含量影响的交互作用可通过响应曲面的形状来判断,如图2所示,响应曲面越陡峭,则该因素对结果的影响越显著。对回归方程模型进行优化求解所得出的最佳制备条件为:海藻酸钠溶液0.051 mol/L、结冷胶溶液0.047 mol/L、壳聚糖溶液浓度0.014 mol/L,此时PSM 中的SDS 含量预测值为57.88%。在此优化条件下,即1 g PS、5 mL 0.051 mol/L 海藻酸钠溶液、5 mL 0.047 mol/L 结冷胶溶液混合均匀后滴入100 mL 0.014 mol/L 壳聚糖后构建PSM,进行3 组平行试验,得到SDS 的实际值为56.34%±0.85%,与预测值基本相符。以此条件构建的PSM 中PS的含量约为90.4%。
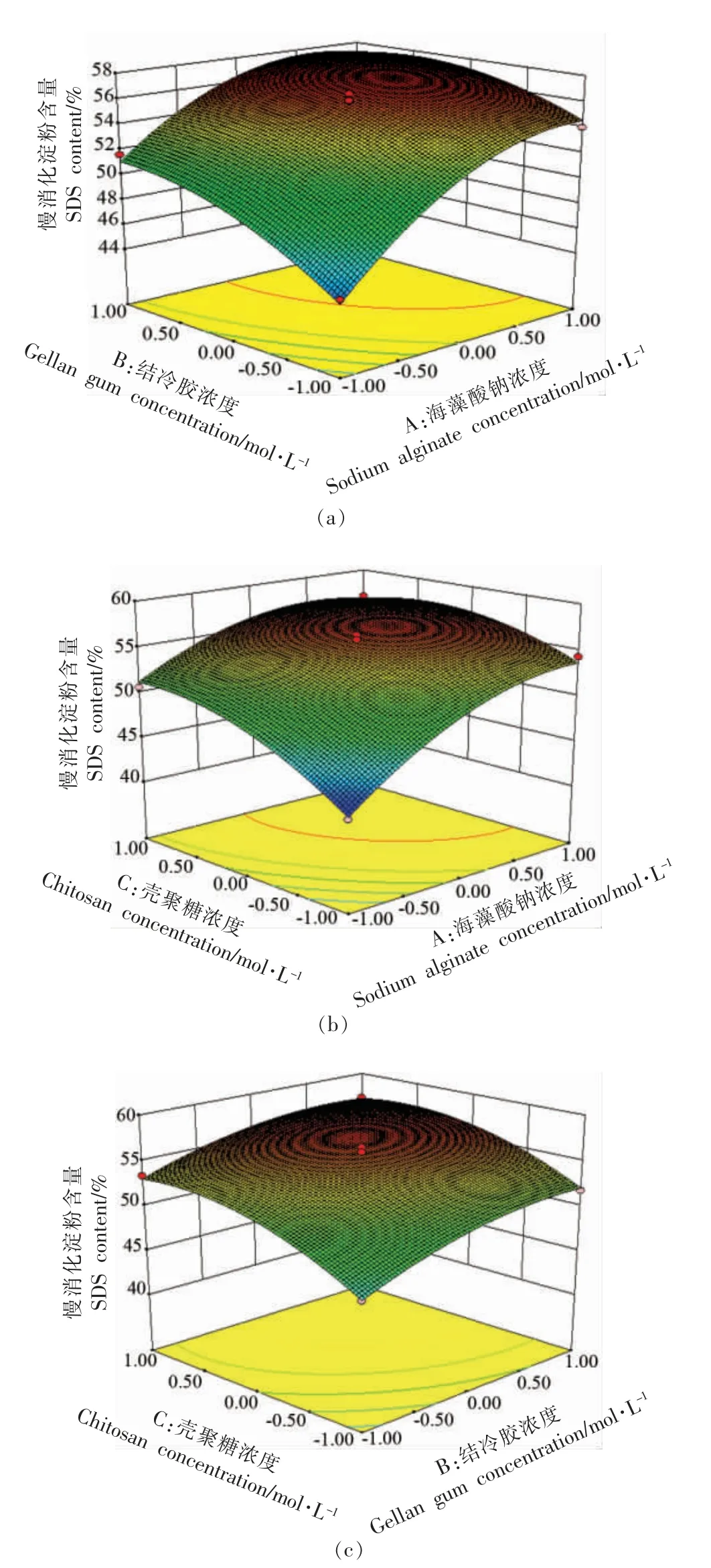
图2 响应曲面图Fig.2 Response surface graph
2.3 能量缓释拟谷物淀粉微球的体外模拟消化性
为进一步提高马铃薯淀粉的慢消化性,在相同条件下,用淀粉-月桂酸复合物PSL 替换PS 制备了PSLM 微球。淀粉的直支链分子结构使其可以与脂肪酸形成单螺旋V 型复合物,构建淀粉-脂肪酸复合物,得到了广泛的研究。淀粉-脂肪酸复合物的抗消化性与其晶体结构密切相关,而制备方法、脂肪酸的类型等因素都会对V 型结构的形成造成显著影响[28-29]。以人们经常食用的天然谷物大米和小米磨粉后作为比较,以马铃薯淀粉PS 及其与月桂酸复合物PSL 为对照,考察能量缓释拟谷物淀粉微球PSM 及PSLM 的体外模拟消化性。图3a 为体外模拟消化曲线,在淀粉的快消化阶段,淀粉水解率由大到小依次为:PS>PSL>大米粉≈小米粉>PSM>PSLM;慢消化阶段淀粉水解率变化的总体趋势未变,而PSL、大米粉、小米粉的水解程度非常接近;在难消化阶段,淀粉水解率明显分为2 组,较高的一组是PS、大米粉、PSM 和小米粉,较低的是PSL 和PSLM;从整个消化过程而言,PSM 和PSLM 微球均显现了优良的葡萄糖缓释作用,同时能够维持淀粉原有的抗消化特性,因此PSLM 的淀粉水解趋势要远低于PSM。
图3b 进一步分析了各试验样品中RDS、SDS和RS 的含量,结果表明:PSM、PSLM 微球中RDS的量大幅降低,其数值也远低于天然谷物粉,缓解了淀粉水解初期葡萄糖的快速释放;PSM、PSLM微球中SDS 含量无显著差异,比对照提高了6 倍,实现了淀粉的能量缓释控制;与PSM 相比,PSLM中PSL 的RS 含量更高,且得到很好的保持。
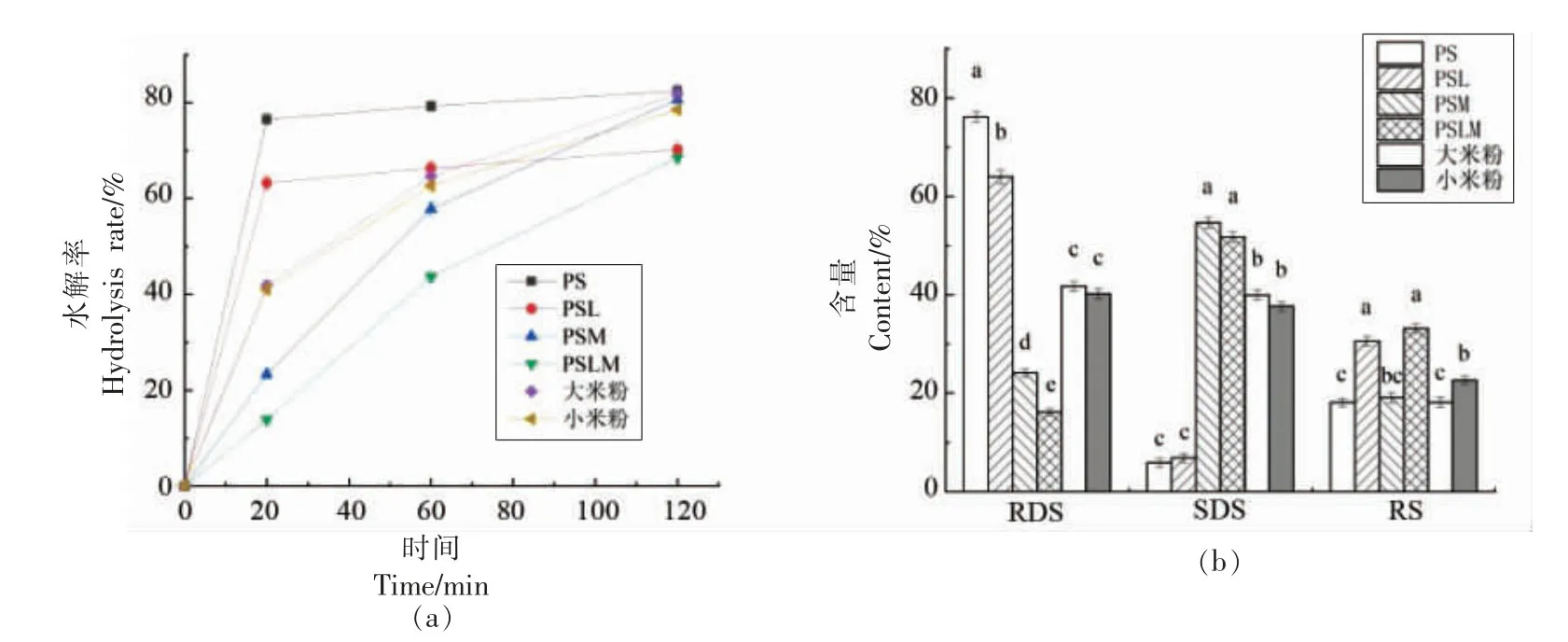
图3 PSM 和PSLM 的体外模拟消化性Fig.3 Simulated digestibility of PSM and PSLM in vitro
研究证实淀粉与脂肪酸复合能够提高RS 含量,然而淀粉中仍然存在许多无法与脂肪酸复合的短链淀粉和支链淀粉,这些淀粉碎片在消化时仍属于RDS。虽然淀粉与脂肪酸复合在一定程度上能够提高RS 含量,但仍有大量淀粉在消化初期被快速消化,能量缓释拟谷物淀粉微球的构建使这一问题迎刃而解。
2.4 能量缓释拟谷物淀粉微球的食用品质评价
2.4.1 能量缓释拟谷物淀粉微球的蒸煮品质 PSM和PSLM 微球具有与谷物类似的外观形态,如图4所示。为进一步研究其作为谷物模拟产品的可食用性,以常见主食谷物大米和小米为对照,对蒸煮品质和质构特性进行比较评价。

图4 PSM 和PSLM 的形态Fig.4 Morphology of PSM and PSLM
大米、小米、PSM、PSLM 的蒸煮品质如表4所示。吸水率和膨胀率是评价蒸煮品质的重要因素,与样品的组织结构相关[30]。根据表中数据可知,能量缓释微球的吸水率和膨胀率均显著(P<0.05)高于大米和小米,这可能是由PECs 的高溶胀率导致。微球的汤液pH 值较低,这可能是由微球的组成成分不同所造成的差异,而PSLM 中月桂酸的释放进一步降低了米汤的pH 值。微球的汤液干物质量和碘蓝值也明显低于大米和小米,说明微球的汤液中淀粉溶解量较低,其中PSLM 的值最低,可能与月桂酸的疏水性相关。总体来看,能量缓释微球的各指标与谷物的差异都在可接受范围内,且在水热处理下仍可保持完整的球形结构,具有较好的蒸煮品质和一定谷物品质特征。

表4 蒸煮品质Table 4 Cooking quality
2.4.2 能量缓释拟谷物淀粉微球的质构特性 大米、小米、PSM、PSLM 的质构特性如表5所示。PSM 和PSLM 蒸煮后内部充斥着PECs 凝胶结构,因此具有一定的机械强度,而硬度不及大米和小米,这是由于大米和小米具有完整的谷物结构,除淀粉外还包含蛋白质等其它组分,结构致密坚硬。微球的黏性、弹力和胶着性与小米更相似,均低于大米。由于微球内部只含有淀粉及PECs 凝胶,结构相对单一,物质间的缔合关系相对简单,因此内聚性和咀嚼性都相对较低。总体来说,能量缓释微球具有与小米相类似的质构特性,适用于日常作为拟谷物食品食用。
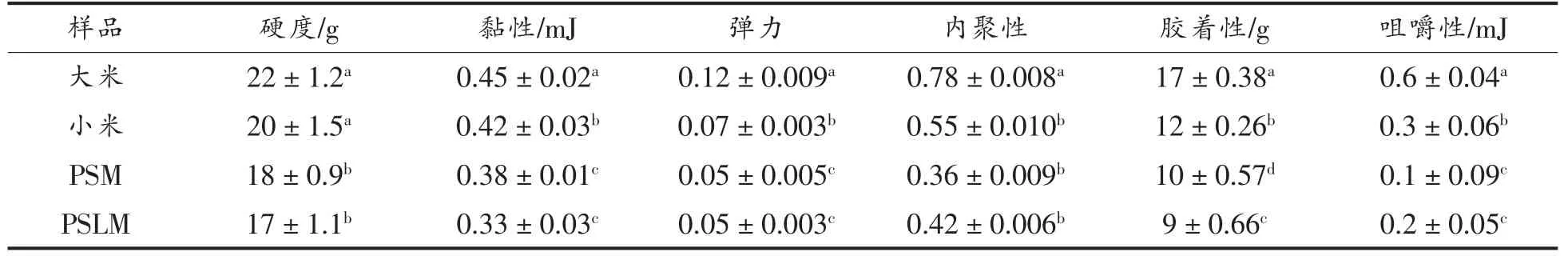
表5 质构特性Table 5 Texture characteristics
3 结论
本研究以PS、海藻酸钠、结冷胶和壳聚糖为原料,根据聚电解质复合物的形成机理,构建了一种能量能够缓慢释放并具有一定谷物品质特征的淀粉微球。研究结果表明,构建的PSM、PSLM 微球能有效控制消化初期淀粉的快速水解,同时在消化20 min 后又能够将葡萄糖缓慢释放提供能量,从体外消化的角度看,能够实现餐后血糖的平缓上升,既能够降低高血糖人群食用淀粉或高淀粉食品后带来的血糖波动风险,又能够预防血糖峰值过后出现低血糖的负面影响。通过淀粉与月桂酸的复合作用可进一步有效调节淀粉的慢消化进程,降低葡萄糖释放。另一方面,通过与大米和小米对比,发现PSM 和PSLM 具有良好的吸水性和膨胀性,在长时间蒸煮后也具有完整的球形结构,具有与小米相类似的蒸煮品质和质构特性,可作为一种拟谷物用于日常食用。能量缓释拟谷物微球的研究与开发,有助于推动以马铃薯为代表的高淀粉基谷薯类加工产业的发展,同时也为低GI 食品的研发提供了创新性的思路与理论依据。

