H1N1流感病毒HA蛋白疫苗构建策略的筛选
郑宁晨,杨姣姣,张 婷,王志荣,许雪梅
(中国医学科学院基础医学研究所 北京协和医学院基础学院 生物物理及结构生物学系,北京 100005)
全球每年因流感病毒导致的呼吸道疾病造成死亡病例达29万~65万[1],疫苗接种可以将普通人群中流感病毒感染引起的疾病风险降低40%~60%[2]。上市的流感疫苗主要为鸡胚或细胞培养生产的灭活疫苗,分别受鸡胚传代抗原漂变及细胞传代针对一些分离株滴度较低的限制,且都存在生产过程中活毒外溢的风险。蛋白疫苗稳定安全,诱导的免疫反应也强于灭活疫苗[3-4]。流感病毒表面的血凝素(hemagglutinin,HA)是病毒与受体结合的关键[5],因此为大多数疫苗的靶抗原。上市的流感蛋白疫苗Flublok采用全长HA蛋白[6],实验室研究中还有采用HA胞外区三聚化重组蛋白[7-9]以及病毒样颗粒(virus-like particle, VLP)[10-11]的形式,都呈现良好的血凝活性和免疫原性。VLP的外形与天然病毒相似,免疫原性强;不含病毒核酸,安全性好;且流感病毒VLP可以自行组装,因此是研发的热点。
目前,还未有研究将上述3种蛋白疫苗形式进行系统性地比较分析,包括表达量、血凝活性及纯化难易程度等。本研究拟以世界卫生组织推荐的候选毒株A/Nebraska/14/2019(H1N1)的HA为靶抗原,构建不同形式的HA重组蛋白,比较并筛选基于HA该毒株的蛋白疫苗的最佳形式。
1 材料与方法
1.1 材料
1.1.1 细胞、菌种与质粒:E.coliDH5α菌种、E.coliDH10Bac菌种、草地贪夜蛾(Spodopterafrugiperda)细胞系Sf9(Invitrogen公司),pFastBac 1质粒和pFastBac Dual 质粒(本实验室保存)。
1.1.2 试剂及试剂盒:Super Pfx DNA聚合酶Mix和E star DNA 聚合酶(北京康为世纪生物科技有限公司);DNA Marker(上海生工生物工程技术服务有限公司);质粒 DNA 提取试剂盒和胶回收试剂盒(北京庄盟国际生物基因科技有限公司); T4 DNA 连接酶和限制性内切酶(北京百灵克生物科技有限责任公司);转染试剂盒 Cellfection Ⅱ Reagent (Invitrogen, Thermo Fisher公司);抗HA(H1N1) 兔多克隆抗体(polyclonal antibody, PAb)和抗M1(H1N1) 兔多克隆抗体(北京义翘神州科技股份有限公司);HRP-羊抗兔IgG(康希诺生物公司);SF-900无血清昆虫细胞培养基(深圳壹生科有限公司);Capto Core700层析介质(GE公司)。
1.2 方法
1.2.1 重组蛋白基因及其重组杆状病毒的构建:PCR扩增A/Nebraska/14/2019(GenBank:QGW43756.1)的HA胞外区(aa.18~527,截去末尾两个氨基酸)基因序列, C端添加T4噬菌体来源的三聚化序列foldon(GYIPEAPRDGQAYVRKDGEWVLLSTFL)和亮氨酸来源的三聚化序列GCN4p(MKQ IEDKIEEILSKIYHIENEIARIKKLIGEV),凝血酶位点以及链霉素标签(Strep-tag Ⅱ)基因序列,经Sf9 密码子优化后分别获得胞外区C端突变体HA-F和HA-G基因,经BamHⅠ/XbaⅠ酶切位点装入pFastBac 1载体;PCR扩增HA全长基因,经BamHⅠ/XbaⅠ酶切位点插入pFastBac 1载体。 Sf9 密码子优化的A/Indonesia/5/2005的M1(GenBank:ABI36004.1)基因序列经NheⅠ/SphⅠ酶切位点插入双启动子表达载体pFastBac Dual的p10启动子下,PCR扩增HA全长基因,经BamHⅠ/HindⅢ 酶切位点插入pFastBac Dual的pH 启动子之下。提取含HA全长、HA-F和HA-G基因的重组pFastBac 1质粒以及同时含有HA和M1全长基因(HA/M1)的重组pFastBac Dual质粒,转化DH10Bac感受态,挑选阳性克隆,经菌落PCR鉴定后提取重组杆状病毒质粒(baculovirus plasmid, Bacmid)。
按照Bac-to-Bac杆状病毒穿梭系统,将重组Bacmid混合转染试剂Cellfection Ⅱ Reagent转染预先铺满3.5 cm 培养皿的Sf9细胞,72~80 h 后收获杆状病毒上清为P1代,扩增病毒至P3代。
1.2.2 Western blot 鉴定重组蛋白的表达:取含有抗原蛋白的杆状病毒感染细胞培养上清,经10% SDS-PAGE分离后,将蛋白条带转移至硝酸纤维膜上,5%牛奶封闭1 h,一抗为抗HA PAb(1∶5 000)或抗M1 PAb(1∶5 000),4 ℃孵育过夜,洗膜4次;二抗为HRP-羊抗兔IgG(1∶5 000),室温孵育1 h,洗膜4次,至发光仪发光成像。
1.2.3 重组蛋白的表达和纯化:将悬浮培养、处于对数增殖期的Sf9细胞以2.5×106~3.0×106/mL接种于500 mL 摇瓶中,以最佳感染复数感染P3代重组杆状病毒,27 ℃振荡器中80/min培养80 h;800 r/min离心5 min收集上清。上清经50 ku超滤管浓缩后滤至20 mmol/L Tris、150 mmol/L NaCl中,pH为7.5。5倍柱体积上样至5 mL Core700层析柱,收集穿透峰,经50 ku超滤管浓缩后,置PBS缓冲液透析,产量约为15 mg/L细胞培养液。最终得到的蛋白溶液经10% SDS-PAGE,考马斯亮蓝染色进行纯度鉴定。
1.2.4 动态光散射(dynamic light scattering, DLS)检测颗粒粒径分布:样品经过0.45 μm滤器过滤,25 ℃平衡60 s,蛋白的水动力直径记录为Z-average 直径。
1.2.5 血凝试验检测蛋白的血凝活性:参照《国家流感中心标准操作规程》中的“流感/禽流感病毒红细胞凝集试验”的流程操作。取50 μL重组杆状病毒上清加入Ⅴ型96孔板中,随即加入50 μL 1%红细胞,静置30 min后观察血凝情况。
1.2.6 透射电镜(transmission electron microscope, TEM)观察颗粒大小及形态:将样品送至中国科学院生物物理研究所进行负染透射电镜观察。
2 结果
2.1 各种HA突变体蛋白表达的鉴定
各突变体在75 ku处均存在特异条带,均与其理论分子质量相符,且两种突变体的表达水平均较HA全长蛋白及HA/M1的高(图1)。
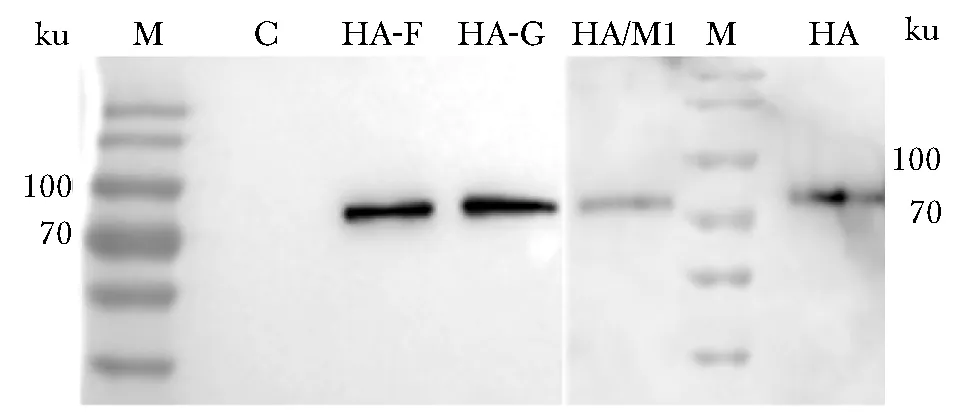
M.marker; C.negative control; HA-F.HA-foldon C-terminal mutants; HA-G.HA-GCN4p C-terminal mutants; HA/M1.co-expression of HA and M1; HA.full length HA图1 Western blot鉴定突变体表达上清中的HA蛋白Fig 1 Identification of HA proteins in the mutant expressing supernatant by Western blot
2.2 HA突变体蛋白表达上清的血凝活性的鉴定
HA-F、HA-G无血凝活性,HA和HA/M1有血凝现象(图2)。

H1N1.A/Brisbane/59/2007图2 HA突变体表达上清的血凝试验Fig 2 Hemagglutination assay of HA mutant expressing supernatant
2.3 有血凝活性蛋白的表达及纯化
穿透峰组分在~37 ku处可见1条主带,在~75 ku和~36 ku处可见2条蛋白免疫印迹条带(图3)。
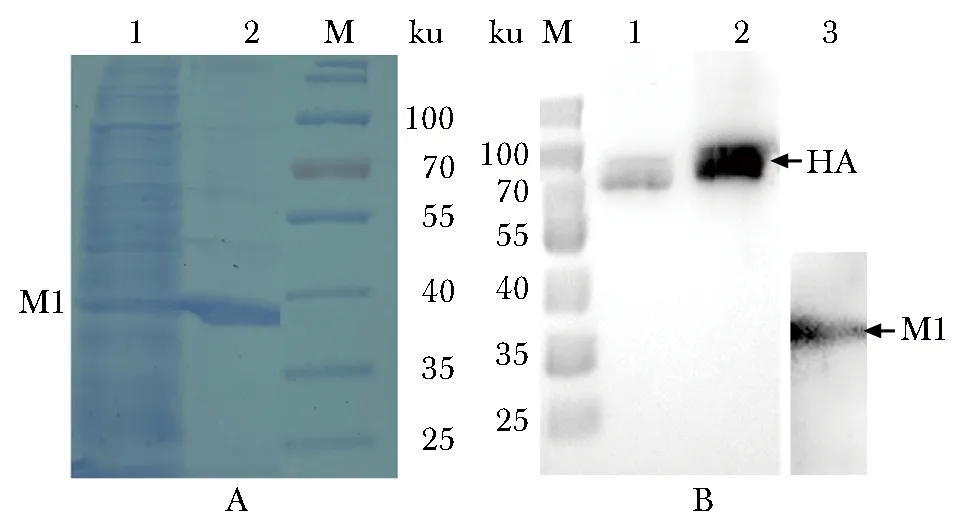
M.marker; 1.unpurified sample; 2,3.purified HA/M1 proteins图3 SDS-PAGE考马斯亮蓝染色(A)及Western blot(B)鉴定经Core700 纯化的HA/M1蛋白
2.4 HA-M1-VLP的鉴定
VLP的平均水合直径为125.2 nm,多分散系数PdI为0.225,表明蛋白的均一性较好,以颗粒形式存在。电子显微镜观察显示,颗粒成病毒样,直径约为80~150 nm(图4)。
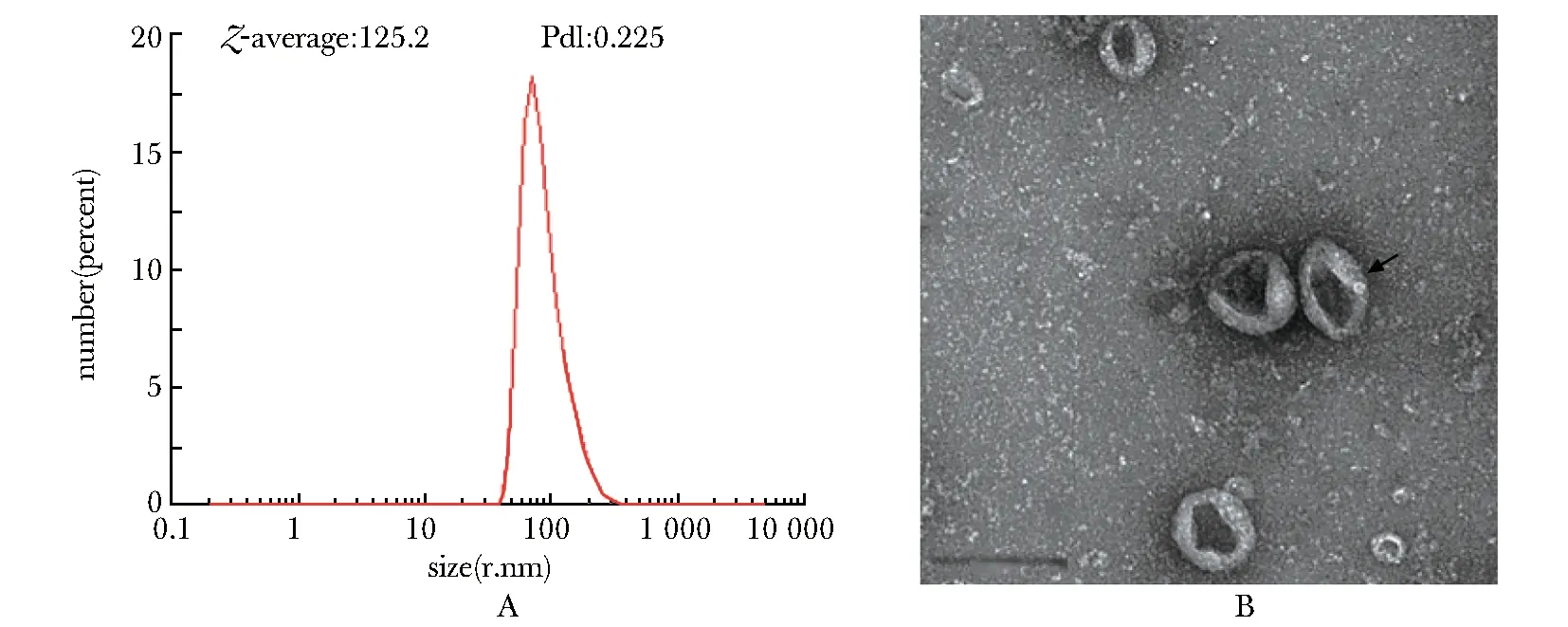
The magnification of TEM was×97 000, scale bar=200 nm图4 动态光散射(A)和透射电镜(B)分析HA/M1蛋白表达为HA-M1-VLP
2.5 VLP血凝效价的分析
PBS对照组血凝阴性,而HA-M1-VLP血凝滴度达26 血凝单位(hemagglutination unit, HAU)/50 μL(图5)。
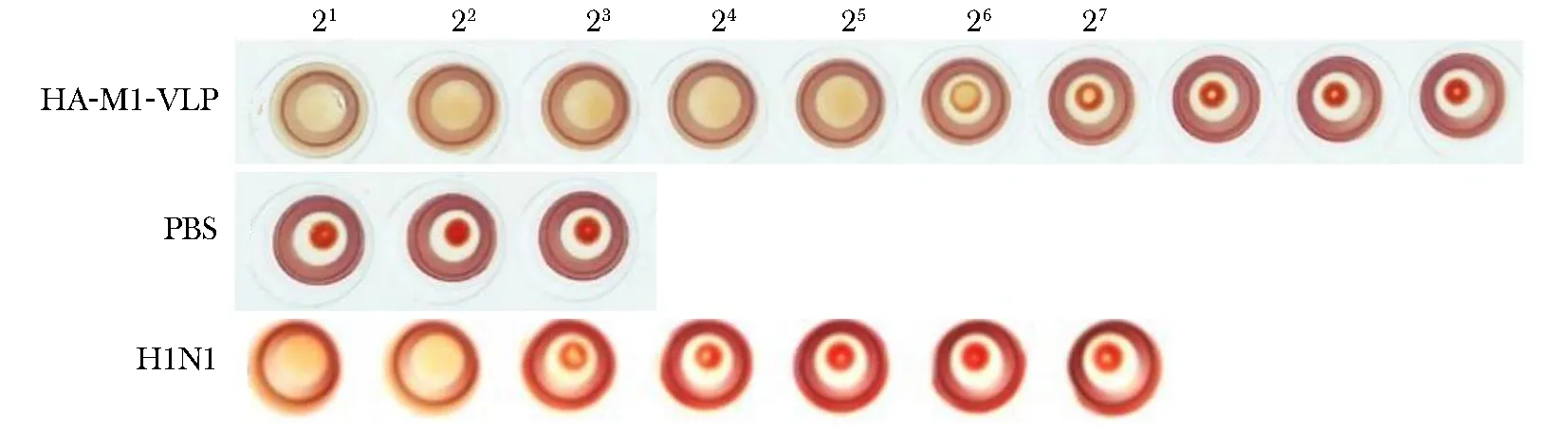
H1N1.A1/GDBA151/2008图5 血凝试验测定HA-M1-VLP的血凝效价Fig 5 Hemagglutination titer determination of purified HA-M1-VLP by hemagglutination test
2.6 VLP的稳定性分析
HA-M1-VLP分别于4 ℃放置3个月,动态光散射分析结果呈现为单峰,平均水合直径为149.1 nm,PdI为0.224,与新鲜制备的样品结果一致。经Western blot鉴定结果显示,VLP在75 ku左右有一条带,无降解带(图6)。

M.marker图6 动态光散射(A)和Western blot(B) 分析HA-M1-VLP于4 ℃存放3个月后的稳定性
3 讨论
蛋白质疫苗的生产要求为活性好、表达量高和容易纯化。本研究首次系统性地从表达量、纯化方式和血凝活性方面比较分析了HA胞外区C端突变体、HA和H1-M1-VLP 3种构建形式。C端突变体无血凝活性;VLP的表达量与HA相近,且具有血凝活性, 但比HA膜蛋白的纯化方法[12]更方便简单,并且该VLP在4 ℃存放3个月性质稳定,所以HA-M1-VLP是最佳的适合H1N1 A/Nebraska/14/2019分离株的蛋白疫苗策略。
HA胞外区C端添加了三聚化基序后,反而丧失了血凝活性,这与293T表达的H1N1重组三聚体HA蛋白的结果[7]不同,可能是由于不同病毒株对三聚化基序的适应性不同,本研究所用的HA三聚化后的构象发生改变,导致受体结合位点的改变;另一原因可能是昆虫细胞表达与哺乳动物细胞表达蛋白的糖基化修饰不同,但考虑到哺乳动物293T表达大T肿瘤抗原,需控制传代次数并检测宿主残余DNA和蛋白含量,所以认为昆虫细胞更适用于疫苗生产。此外,有研究比较了C端截短不同数量氨基酸的重组H3N2 HA三聚体蛋白的血凝活性,发现血凝滴度会受到C端氨基酸截短数量的影响[13];推测本研究所用毒株的HA对氨基酸截短比较敏感,因截短HA末尾两个亲水性氨基酸改变了近膜区的结构,使其丧失血凝活性。而HA-M1-VLP以膜锚定的方式展示HA,与HA全长膜蛋白一样,具有天然的HA构象,因此具有血凝活性。
目前流感病毒VLP的纯化皆采用蔗糖梯度离心的方法[14-15],本研究首次采用Core700纯化流感病毒VLP,也具有较好的纯化效果。因Core700同时具有吸附层析和分子筛的作用,病毒或大蛋白被排除在介质之外,所以VLP可快速在穿透峰中收集。而HA膜蛋白的纯化需要经过阴离子交换层析、扁豆凝集素亲和层析和阳离子交换层析[12],步骤多,成本相对较高。因此,相比于HA膜蛋白的纯化方法,本研究用Core700纯化VLP的方法更方便快速,适用于疫苗生产。
总之,HA-M1-VLP保留了血凝活性,容易纯化,且稳定性好,是利用昆虫细胞生产A/Nebraska/14/2019(H1N1)流感病毒蛋白疫苗的最佳策略。

