TLR3激活协同干扰素α抑制小鼠海马神经元DISC1表达
姚景宏,李加欢,刘子建
(1.华中科技大学同济医学院附属协和医院 感染科, 湖北 武汉 430022;2.华中科技大学 同济医学院 基础医学院 解剖学系,湖北 武汉 430030)
丙型肝炎病毒(hepatitis C virus, HCV)感染是一个全球公共卫生问题,约感染2.5%的人口,是造成肝硬化、肝衰竭和肝细胞癌等肝脏相关疾病的主要原因[1]。干扰素是临床上最常用的抗病毒药物,但慢性丙型肝炎患者接受干扰素α(interferon α, IFNα)治疗后有超过20%出现神经精神综合征,如抑郁症,其机制仍未阐明[2]。DISC1(disrupted-in-schizophrenia 1)是一种多功能的神经元突触后致密物蛋白,与神经元干细胞分化、迁移以及神经元可塑性等关系密切,DISC1基因突变或功能异常与家族性精神分裂或抑郁症等精神疾病的发生紧密相关[3]。慢性应激和炎性反应是精神疾病的重要致病因素,但炎性反应对DISC1的表达及功能影响尚不清楚。TLR3(Toll-like receptor 3)受体属于天然免疫受体,能感知病毒感染,启动抗病毒天然免疫反应。中枢神经系统内多种细胞都表达TLR3,其中神经细胞表达的TLR3激活后可抑制神经前体细胞的增殖、分化,影响神经元突生长锥的生长[4]。聚肌胞苷酸(polyriboinosinic-polyribocytidylic acid, polyI:C)是人工合成的双链RNA,能与TLR3特异性结合激活天然免疫,诱导合成、释放炎性细胞因子和Ⅰ型干扰素,模拟病毒感染[5]。IFNα是细胞感染病毒后首先产生的细胞因子之一,能通过JAK-STAT通路抑制病毒复制,并调节天然免疫和获得性免疫反应[6]。在中枢神经系统,外源性IFNα可影响神经内分泌功能、睡眠-觉醒周期,增加神经元兴奋性等[7]。本文通过研究polyI:C与IFNα对神经元DISC1表达的影响,探讨病毒感染后IFNα治疗诱导抑郁症的分子机制。
1 材料与方法
1.1 材料
SPF级C57BL/6J孕鼠(同济医学院实验动物中心,SYXK2016-0057)。重组小鼠IFNα、鼠抗β-actin抗体(Sigma-Aldrich公司);polyI:C(LMW)、B27、Neurobasal培养基(Invitrogen公司);兔抗DISC1多克隆抗体(Santa Cruz生物公司);兔抗STAT1、磷酸化STAT1(p-STAT1)、兔抗MAPK p38和磷酸化MAPK p38(p-p38)抗体(Cell Signaling Technology公司);鼠抗PSD-95单克隆抗体(Synaptic System公司);RNA提取试剂盒、real time PCR试剂盒及引物(Qiagen公司);PCR引物信息(表1)。

表1 RT-qPCR引物Table 1 Primers used for RT-qPCR
1.2 方法
1.2.1 神经元的分离、培养及分组处理:取C57BL/6J小鼠的E17-E18胚鼠,冰上取脑,解剖显微镜下取出海马组织,0.125%胰蛋白酶37 ℃消化15 min,抛光的巴氏管机械分离细胞,以2×105/mL种植在24孔培养板,用含10%胎牛血清DMEM培养基培养6 h,促使细胞贴壁后,改用含2% B-27的Neurobasal培养基,在37 ℃、5% CO2培养箱中继续培养,每3天换液一半,第7天可见典型的神经元,胞体折光性好,突起丰富。经MAP-2免疫细胞化学鉴定,神经元纯度≥95%。第9天将神经元分为4组:1)对照组(control);2)polyI:C组;3)IFNα组;4)共刺激组(co-stimulation),同时用polyI:C 和IFNα处理细胞。IFNα终浓度为1×108IU/L,polyI:C终浓度为1.0 g/L。对各组神经元刺激24 h后进行后续实验。
1.2.2 RT-qPCR检测mRNA:提取细胞总RNA,取1 000 ng样本总RNA进行RT-qPCR检测。实验结果与管家基因β-actin拷贝数标准化,所有样本均作复孔并重复3次,并用Bio-Rad CFX Manager处理结果。
1.2.3 免疫细胞化学染色检测蛋白:将盖玻片用0.01 mol/L PBS洗3遍,4%多聚甲醛固定20 min,依次加入含0.125% Triton X-100的PBS液、1∶50的正常小牛血清中封闭30 min。加一抗于4 ℃湿盒内孵育过夜,二抗室温孵育2 h,各步骤之间用PBS漂洗3次,Prolong Gold试剂封片。Carl Zeiss Apotome荧光显微镜观察结果。
1.2.4 Western blot检测:用PBS缓冲液洗细胞3遍,加入细胞裂解缓冲液(20 mmol/L Tris-HCl,150 mmol/L NaCl,1 mmol/L Na2EDTA,1 mmol/L EGTA,1% Triton,2.5 mmol/L sodium pyrophosphate,1 mmol/L beta-glycerophosphate,1 mmol/L Na3VO4,1 μg/mL leupeptin,100 μg/mL PMSF,pH 7.5),冰上静置20 min裂解细胞,裂解液在4 ℃ 12 000×g离心15 min,取上清。部分细胞裂解液中加入磷酸酶混合抑制剂。用BCA试剂盒进行样品蛋白浓度的测定。每组蛋白15 μg上样以恒压(110 V)电泳2.5 h;电转法将蛋白质从凝胶转移至PVDF膜,转移电流300 mA,转移时间2 h;随后将PVDF膜用含5% BSA的TBS封闭液于室温封闭1 h,与一抗在杂交袋内4 ℃孵育过夜,再与HRP标记羊抗兔IgG(1∶12 000)在杂交袋内37 ℃温育1 h,ECL显色,Fusion FX拍照保存。图像经软件Image J进行相对吸光度测定,并对数据进行统计学分析。
1.3 统计学分析
2 结果
2.1 RT-qPCR结果
干扰素刺激基因15(interferon stimulated gene, ISG15)是对IFNα刺激高反应的基因,在IFNα组和共刺激组,ISG15 mRNA表达均显著升高(P<0.001),但在共刺激组,经polyI:C和IFNα共同处理24 h后,DISC1 mRNA的表达显著低于对照组(P<0.05)(图1)。

2.2 免疫细胞化学染色结果
培养至第9~11天的小鼠海马神经元突起丰富,胞体折光性好,进一步行MAP2免疫细胞化学鉴定表明:神经元纯度>90%。予以IFNα或polyI:C刺激24 h后,未见明显细胞死亡。Tau-1和DISC1免疫双标结果显示:对照组神经元胞体和突起均有Tau-1和DISC1表达,而polyI:C组和IFNα组Tau-1和DISC1的表达与对照组相比无明显变化。而共刺激组Tau-1表达无明显变化,DISC1的定位虽无改变,但其表达明显减弱(图2)。
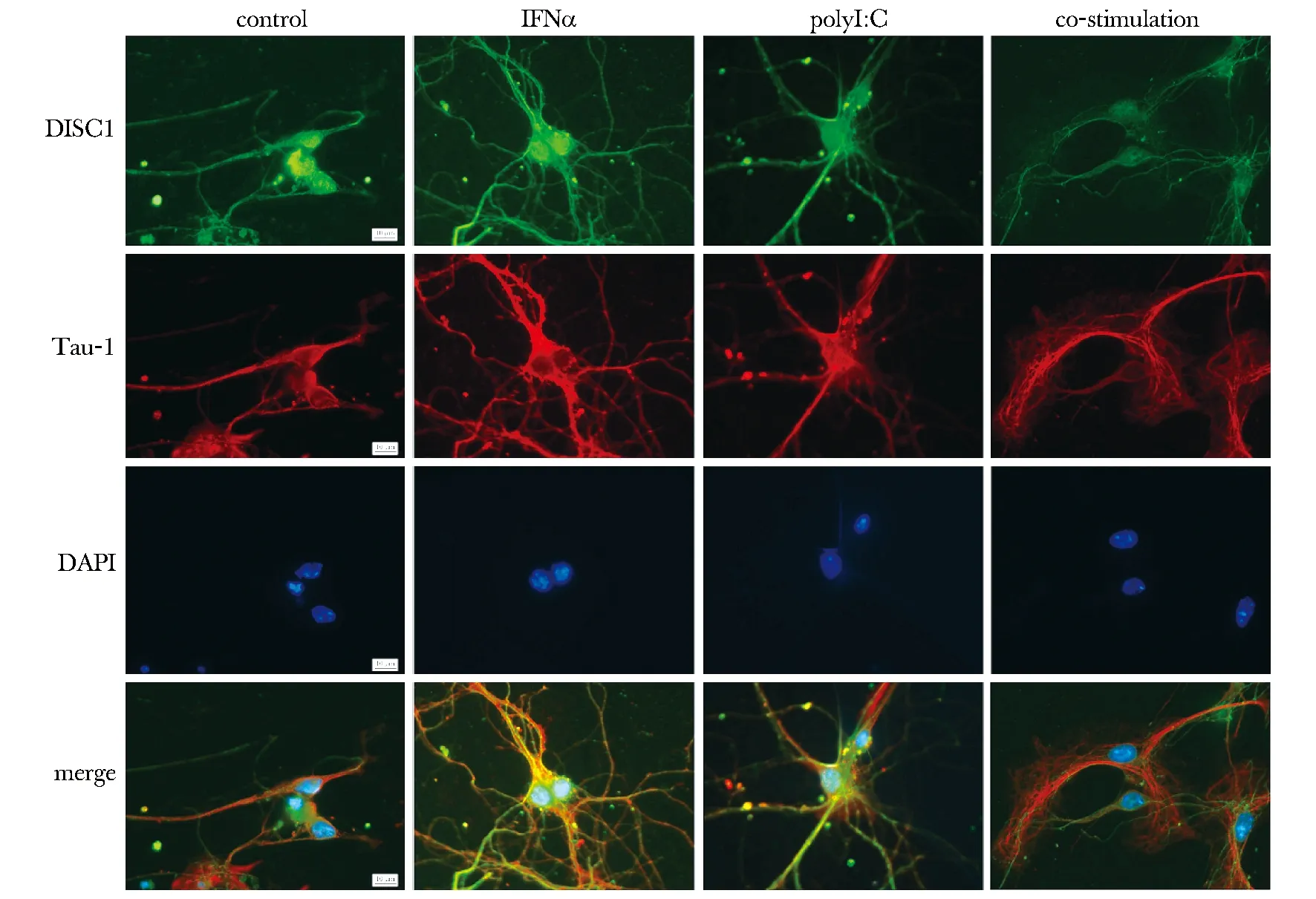
图2 免疫细胞化学染色显示TLR3激活和IFNα共刺激抑制神经元表达DISC1
2.3 Western blot检测结果
与对照组相比,polyI:C组和IFNα组神经元DISC1的表达无显著差异,而共刺激组DISC1蛋白的表达明显降低(F=24.99,P<0.01)(图3A)。转录因子STAT的磷酸化在IFNα组和共刺激组显著增加。p38 MAPK是TLR3介导抗病毒状态的关键下游信号分子,其磷酸化水平在polyI:C组和共刺激组亦显著增高。此外,各组之间GSK-3β与p-GSK-3β的表达并无改变(图3B~C)。

A.the protein expression and statistical analysis of DISC1 in different groups;B.the protein expression and statistical analysis of p-STAT1 and STAT1 in different groups;C.the protein expression and statistical analysis of p-p38 MAPK, p38 MAPK, p-GSK-3β, GSK-3β in different groups; *P<0.05 compared with control group
3 讨论
丙型肝炎患者接受IFNα、利巴韦林联合治疗后有超过20%出现抑郁症表现,其分子机制尚不清楚[2]。DISC1基因是目前已知的与精神分裂症、抑郁症等精神疾病密切相关的遗传风险基因之一,其发生点突变或表达异常与精神分裂症患者的认知功能损害存在一定关联[3],但其机制仍待阐明。
DISC1是一种多功能的突触后脚手架蛋白,在神经元的细胞核、胞质、中心体、线粒体、细胞骨架、神经突起以及突触等部位广泛表达[8]。在成年鼠,DISC1主要在海马齿状回、海马下托、内嗅皮层及嗅球高表达,以齿状回表达最高[9]。研究表明DISC1参与调节神经干细胞的增殖、分化和新生神经元的迁移,并可通过调节GABA受体或NMDA受体信号影响神经元的突起生长、突触形成。腹腔注射NMDA受体拮抗剂盐酸美金刚胺可降低成年小鼠海马DISC1蛋白表达,并使齿状回新生神经元发生异位迁移[10]。本实验结果显示,在polyI:C和IFNα共同刺激下,培养神经元DISC1 mRNA和蛋白水平均显著下降,而单独polyI:C或IFNα刺激,DISC1的表达无显著变化,说明只有天然免疫受体激活联合IFNα刺激下才会影响DISC1的表达。
IFNα是一种抗病毒细胞因子,临床常用于某些病毒感染(如HCV)或肿瘤治疗。在中枢神经系统中,IFNα与细胞表面的Ⅰ型IFN受体结合后,通过激活JAK/STAT信号,诱导神经细胞产生更多的IFNα和其他细胞因子,如IL-6、IL-1、TNFα等,抑制神经元长时程增强和兴奋型突触后电位[11]。polyI:C是天然免疫模式识别受体TLR3的合成配体,能激活TLR3受体及其下游信号通路,如NFκB、p38 MAPK和ERK信号,模拟病毒感染激活天然免疫[12]。在中枢神经系统中,TLR3激活参与神经干细胞的增殖、分化调节,影响神经元可塑性[13]。本实验中,在polyI:C和IFNα共刺激组,神经元内p38 MAPK和STAT1磷酸化水平均显著升高,提示p38 MAPK和JAK/STAT1信号通路激活参与了DISC1表达的调节。
GSK-3β是重要的信号分子,参与调节神经系统发育、神经递质功能和突触可塑性,其功能失调与老年痴呆、精神分裂症、抑郁症等神经精神疾病的发生密切相关[14]。由DISC1的基因多态性产生的突变体可干扰Wnt/ GSK-3信号,进而影响神经发育[15]。DISC1蛋白通过GSK-3β相互作用可抑制其活性,但本实验结果显示GSK-3β的表达及磷酸化水平在各组之间无显著差异,提示在polyI:C和IFNα的炎性刺激下,神经元的DISC1表达虽受到抑制,但GSK-3β表达及功能尚未受影响,说明可能存在其他代偿机制维持神经元GSK-3β的功能。
综上,本研究证实了TLR3激活联合IFNα刺激可通过激活p38 MAPK和JAK/STAT1信号通路,抑制DISC1的表达,为阐明病毒感染和细胞因子在神经精神疾病(如抑郁症)发生中的分子机制提供了实验依据。

