胚胎滞育研究进展
陈昊天,张 鲁
(中国农业大学 动物科学技术学院,北京 100193)
胚胎的正常发育是动物体生长过程的关键,要经历受精、卵裂、孵化、形态转变、附植及器官分化等多项重要的生理过程[1]。然而当环境中存在不利于胚胎发育的因素时,胚胎会出现发育终止、发育畸形乃至胚胎死亡的现象。为适应复杂多样的环境,胚胎进化出了多种发育模式,胚胎滞育便是其中之一。
1 胚胎滞育的发现
胚胎滞育(embryonic diapause)又称延迟着床,是指囊胚期的细胞增殖过程受到抑制而导致的动物胚胎发育暂时停滞的可逆生理现象[2]。早在1651年,人们观察狍子交配与分娩之间的妊娠期,发现部分个体妊娠期远长于预期,但该名词在1980年才被首次定义[3]。在此后30余年的研究中陆续发现胚胎滞育现象广泛存在于啮齿目、食肉目及有袋目中,在偶蹄目、翼手目中也陆续有报道[4]。
胚胎滞育现象是将受精与分娩两个重要的繁殖过程进行分离,从而保证后代出生于最有利的环境条件,以提高新生幼崽存活率的一种重要动物繁殖进化策略[5]。通常情况下,胚胎在植入子宫前自行发育,到达胚泡阶段时其固有代谢减弱,因此胚胎需要受到适当的刺激才能够进一步发育;当环境或母体条件不适宜时,胚胎于早期囊胚停止发育,进入滞育阶段[6]。
胚胎滞育可分为发生、维持和再激活三个过程,滞育的发生往往与光周期、哺乳及母体的营养状况密切相关,而滞育的维持则存在着较大的物种乃至个体差异[7]。例如:小鼠胚胎滞育的维持时间一般在1~7 d;而对于大鼠,当哺育幼崽数量少于4个时滞育的平均维持时间仅有2 d,随着其哺育幼崽数量的增加滞育维持时间呈延长的趋势[8]。
2 胚胎滞育的分类
2.1 兼性胚胎滞育
兼性胚胎滞育(facultative embryonic diapause)是一种与代谢性压力相关的胚胎发育停止现象,只有当应激条件解除后胚胎才开始着床,主要发生于哺乳期与发情期重叠的物种,啮齿动物是研究兼性滞育的常用模式动物[4,9]。通常情况下,小鼠在交配后的第3天受精卵分裂成桑椹胚,移动至输卵管峡部,在第5天胚胎转移至子宫后胚泡伸长变形,附着于子宫内膜上[10]。该过程受妊娠母鼠体内黄体酮水平的影响,母鼠分娩后立即进入新的发情周期,此时若存在哺乳现象或运输等压力,会导致黄体酮水平下降,进而子宫内的胚胎进入滞育阶段,表现出发育迟缓、无法着床等现象,这时胚胎停留在子宫腔闭合的子宫窝内,逐渐从溶解的透明带中显现出来,细胞增殖至130个左右时停止分裂并均匀分布于胚泡中[5,10-12]。研究发现,应激条件解除后伴随着胚胎滞育过程的终止,小鼠子宫内蛋白质的合成和分泌量均大幅提高、子宫蜕膜化过程启动,这是诱导雌激素脉冲和胚胎成功着床的重要因素[9,13]。
2.2 专性胚胎滞育
专性胚胎滞育(obligate embryonic diapause)也称专性滞育或强制性滞育,广泛发生于臭鼬、獾和水貂等物种[14]。对于这些动物,胚胎在每个繁殖季节都会进入休眠状态,只有当环境条件适合分娩时专性滞育结束、恢复妊娠,进而保证雌性个体在繁殖周期中的各种繁殖活动均在1年中最有利的时间进行[15]。专性滞育主要受到光照周期季节性变化的影响,当光照少于12 h时褪黑素分泌量增加,催乳素(prolactin,PRL)的分泌受到抑制,进而诱导胚胎进入滞育阶段;而在春分后光周期的增加可能通过诱导松果体减少褪黑素的分泌,提高垂体分泌催乳素水平,最终使胚胎重新被激活[6,16-18]。此外,对处在滞育阶段的水貂胚胎施加外源性催乳素,可以诱导胚胎终止滞育和植入着床[19-20]。作为广泛研究专性滞育的模式动物水貂,其胚胎在滞育期间分布于子宫角中并被卵母细胞的透明带所包裹,细胞数量在200~500个范围之间均有报道[5,20]。此时受低水平催乳素的影响,黄体分泌黄体酮的功能受到抑制,胚胎滞育过程得到维持;而当水貂滞育终止后,在高水平催乳素信号刺激下黄体细胞恢复有丝分裂能力,黄体体积及黄体酮水平快速提升,进一步促进囊胚的再激活过程[4,7,9]。
3 胚胎滞育的调控机制
3.1 环境对胚胎滞育的调控作用
环境作为一种重要的复杂调节因素,在胚胎的植入过程发挥关键作用,其中光周期对于诱导滞育终止及胚胎植入着床过程发挥重要作用[9]。研究发现褪黑素和催乳素参与光周期诱导的专性滞育过程:光照通过视网膜被动物感知后,经过视交叉上核昼夜节律产生系统的夹带过程,抑制松果体分泌褪黑素,而褪黑素却可以干扰垂体催乳素的分泌以维持胚胎的滞育过程[21-22]。以水貂为例,在短光照周期下,褪黑素水平升高而催乳素浓度下降,胚胎滞育维持;光照周期增长后,水貂松果体活动受到抑制,褪黑素水平下降,催乳素水平上升,滞育终止[2,18,21]。高水平的催乳素可以诱导催乳素受体,促进促黄体素受体基因的表达,其中促黄体素可能通过诱导黄体的激活、提高黄体酮水平来诱导滞育的终止、促进胚胎的植入[23-24]。而在母体哺乳的刺激下,尽管催乳素水平提高,但雌激素的分泌受到抑制,胚胎也会进入滞育阶段(见图1)。
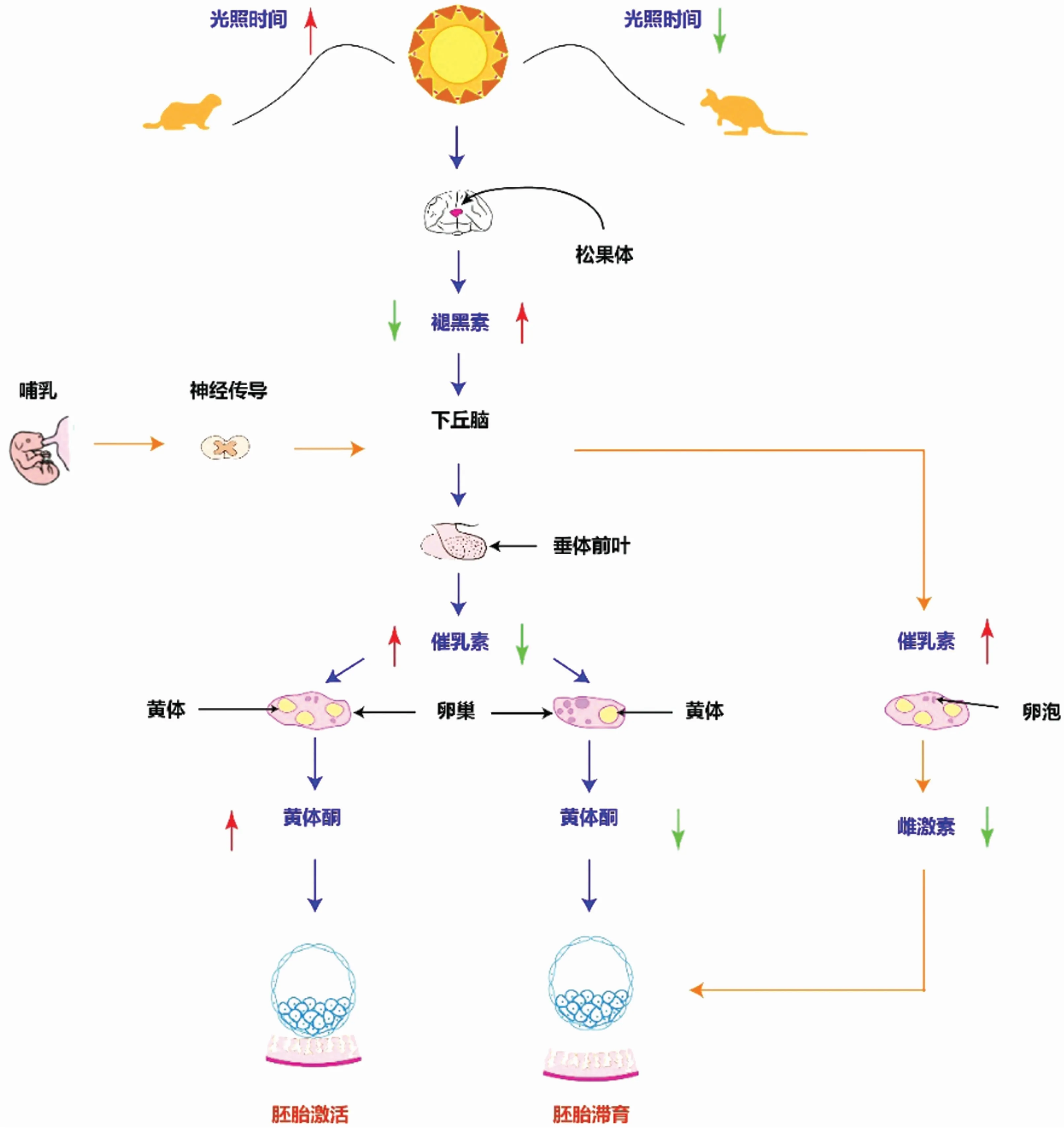
图1 光周期和哺乳对胚胎滞育过程的调控Fig.1 Embryonic diapause regulated by photoperiod and lactation
环境温度对于胚胎发育过程也具有重要的调控作用,研究发现:当环境温度比体温低3~5℃时会诱发妊娠的雌性蜥蜴出现胚胎滞育现象[26];而果蝇暴露于高温环境时容易造成胚胎滞育的终止[27]。另一方面也有试验证实,高温会诱导啮齿动物兼性滞育的发生,低温会延长某些肉食性动物滞育的维持时间[2]。家禽早期胚胎处于高温条件下可以加速对蛋黄及蛋白中营养物质的吸收,促进发育;但在人胚胎及卵母细胞上的研究表明,高温可能影响卵母细胞纺锤体形态、抑制胚胎的发育和着床过程;而低温条件则会降低牛胚胎的新陈代谢活性甚至在更极端的温度下导致RNA损伤[28-31]。这些研究表明,胚胎滞育可能是动物为适应环境而进化出的关键生存策略,但温度条件影响胚胎滞育的具体机制仍需探索。
3.2 激素调控胚胎滞育的作用
目前研究发现,催乳素和性腺类固醇激素对于胚胎滞育具有重要调控作用。催乳素是一种由垂体后叶释放的多肽类激素,具有促进乳腺生长、发育,启动、维持泌乳的功能[32]。在妊娠过程中,催乳素通过维持黄体和生长因子水平,为胚泡着床提供适宜的微环境,调控胚胎的着床与发育过程[33]。在专性滞育动物中,垂体后叶催乳素的释放受到光周期的调控,催乳素可能通过参与调控体内鸟氨酸向氨基化合物的转化,干预胚胎发育的可逆停止及滋养层和内细胞团增殖的停滞过程[34]。在兼性滞育的动物中,催乳素直接作用于黄体,使其处于静止状态,进而维持胚胎滞育[35]。对于产后发情交配的小鼠,哺乳行为会导致母体内循环催乳素水平的增加,阻止妊娠3.5天时雌激素(estradiol,E2)水平升高,进而诱发胚胎滞育[36]。此外在妊娠小鼠雌激素水平提升前切除卵巢,可以诱导囊胚表现出滞育的特征,外源补充的雌激素具有激活囊胚、促进胚胎植入的功效[37]。因此,催乳素可能通过介导雌激素水平来干预妊娠期动物胚胎的活性和植入过程,进而调控滞育的发生。
类固醇激素参与动物的繁殖行为,其中雌激素、黄体酮(progesterone,P4)在胚胎的发育和植入等过程中发挥关键作用。雌激素具有调控子宫对胚胎容受性的功能,向切除卵巢的胚胎滞育模型小鼠注射外源雌激素可以诱导囊胚激活及植入的发生[38-39]。黄体酮在黑斑海豹和灰海豹胚胎滞育期间保持较高水平,并且随着滞育的结束黄体酮水平也呈下降趋势[40]。子宫对胚胎的接受性是影响胚胎滞育的关键因素,黄体酮和雌激素可以协同作用于小鼠子宫,改变胚胎着床的窗口期,进而调控胚胎滞育过程:黄体酮通过下调黏蛋白-1(MUC1)、降钙素,上调心脏和神经嵴衍生物表达转录本2(Hand2)去除子宫抗黏附屏障,为胚胎提供着床位点,同时抑制小鼠子宫腔上皮细胞增殖,并使上皮组织结构分离,有利于胚胎的侵入,提高子宫对胚胎的接受性[4,41]。胚胎黏连后,子宫基质细胞立即发生蜕膜化,并在着床部位分泌雌激素,在IGR1和IGFBP3信号转导作用下胚胎着床的窗口期关闭,小鼠子宫转变为非接受状态,保证植入胚胎的继续发育[42]。但有研究者认为,卵巢类固醇激素在狍子胚胎滞育再激活过程中可能并不起决定性作用[43]。此外睾酮作为一种调节卵巢功能的必需激素,在胚胎滞育期间通常保持较高的水平,并在滞育再激活过程中发挥重要作用[44]。
另外,褪黑素是一种受光周期调控、由松果体分泌的胺类激素,对于胚胎发育同样具有重要的调控作用。在水貂的研究中发现,褪黑素可以通过抑制垂体催乳素的分泌进而调控胚胎的发育[45]。
3.3 子宫环境对胚胎滞育的调控作用
胚胎植入过程是激活态胚胎与容受性子宫相互协调的结果,适宜的子宫环境对于胚胎的植入过程至关重要,子宫分泌物也是调控胚胎发育的另一关键因素[7,46]。研究表明,将处于滞育状态的水貂胚胎移植至正常雪貂子宫内,可以诱导休眠状态的胚胎被重新激活;而将正常山羊胚胎移植至处于滞育状态下的小鼠子宫后,胚胎随即进入休眠状态,表明在动物子宫内存在诱导和维持胚胎滞育的关键因素[7,47-48]。虽然目前在母体子宫内筛选出的白血病抑制因子(leukemia inhibitory factor,LIF)和多胺水平被证实对子宫环境、胚胎的发育和植入过程具有重要的调控作用,但子宫与胚胎滞育诱导和维持相关性等方面的具体机制仍未建立[49-50],在未来揭示其中作用机制需要借助更多分子生物学手段。
3.4 micro RNAs对胚胎滞育的调控过程
microRNA(miRNA)是一类广泛存在于动植物体内、大小为21~25个核苷酸的内源性非编码单链小分子RNA,能靶向作用于信使RNA(mRNA)抑制其翻译过程,对生物体转录后的基因表达调控起关键作用。目前发现多种miRNA在动物胚胎滞育及重新激活的过程(见图2)中发挥重要作用。
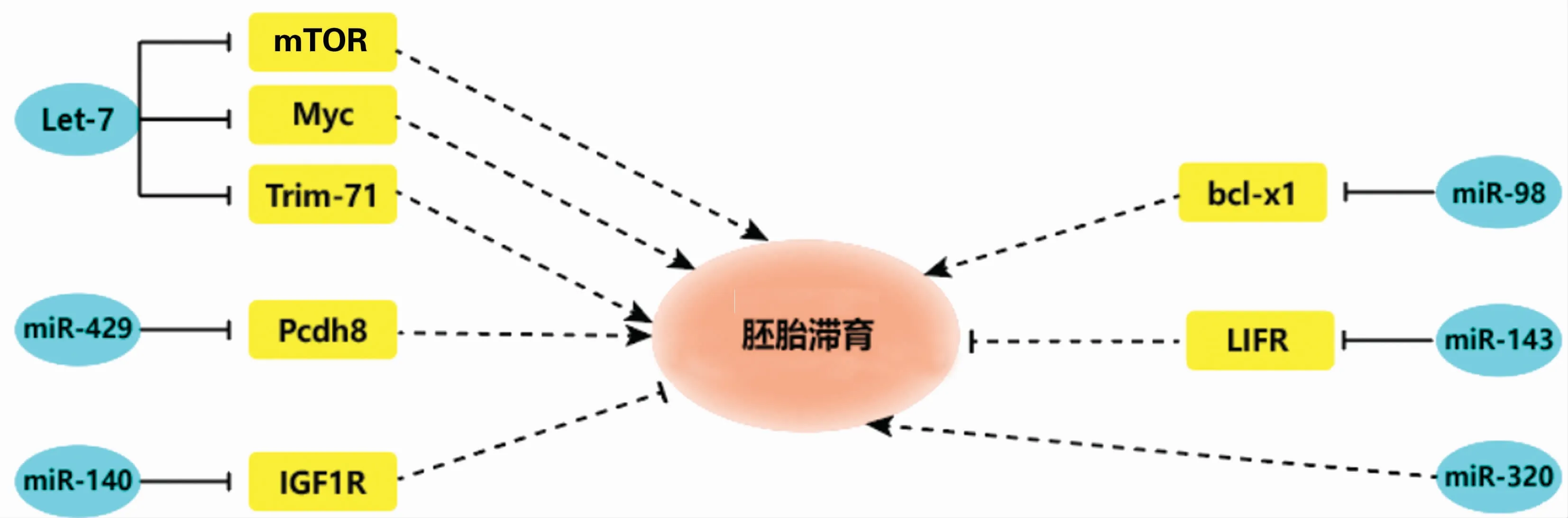
图2 miRNAs调控胚胎滞育过程Fig.2 miRNAs regulate embryonic diapause network
研究发现,在胚胎滞育的模型小鼠中筛选的45个miRNA存在差异表达,其中多数(38/45)miRNA在滞育胚胎中的表达水平显著提高,尤其是Let-7家族的5位成员[51];与此同时mTOR和Myc信号转导途径在小鼠胚胎滞育过程中发挥关键的作用,其中mTOR的抑制对转录、翻译和代谢的组合作用可能是决定胚胎滞育的重要因素,而Myc活性的降低是决定植入前的胚胎能否进入滞育状态的关键[52-53]。有研究证实,Let-7家族可以通过抑制Myc、mTORC1和mTORC2信号通路,诱导胚胎滞育的发生[54]。此外Trim71作为Let-7的另一标靶,可以抑制细胞周期蛋白依赖性激酶抑制剂Cdkn1a的表达,调节胚胎干细胞由G1期向S期过渡,对于胚胎发育和干细胞增殖具有重要影响[55]。miR-429在小鼠胚胎植入过程中通过反向调节钙黏蛋白家族的Pcdh8水平,抑制上皮-间充质转变过程,进而抑制细胞的转移和侵袭功能,减少胚胎植入的数量[56]。 在大鼠上的研究发现,miR-140通过靶向子宫内胰岛素样生长因子1受体(IGF1R)抑制下游效应因子整合素β3和黏附斑激酶(focal adhesion kinase,FAK)的表达,实现对胚胎植入过程的抑制,诱导胚胎滞育的发生[57]。miR-98可以通过靶向抗凋亡因子bcl-xl,诱导细胞色素c的释放,促进细胞凋亡;miR-98水平下调具有防止子宫细胞过度死亡的效果,使子宫容易接受胚胎,有利于胚胎的正常着床[58]。在胚胎滞育模型中miR-320水平显著上调,通过外源雌激素使胚胎恢复植入过程后miR-320水平降低,推断miR-320可能在胚胎着床过程中发挥重要的功能[59-60]。在胚胎滞育的激活过程中miR-143的表达显著上调,miR-143可能与白血病抑制因子受体(LIFR)3′UTR区域结合,抑制其翻译过程,因此子宫内的miR-143可能通过调控LIFR水平进而影响胚胎植入过程[61]。
4 胚胎滞育与细胞周期
胚胎是由受精卵经过细胞分裂和分化过程而形成,胚胎滞育发生的主要原因是胚胎细胞的增殖受到抑制、细胞周期停滞、细胞进入休眠状态。与此同时,细胞控制合成代谢和氧气的消耗水平,维持蛋白质水平及基础代谢,从而防止细胞凋亡的发生[6]。在试验中发现,多数哺乳动物及昆虫在细胞周期的S期之前是胚胎滞育高发时期,其中袋鼠囊胚的生长通常在细胞周期的G0阶段受到抑制[9,62]。
在昆虫细胞周期调控胚胎滞育过程的研究中发现,存在于细胞核内的DNA聚合酶辅助蛋白——增殖细胞抗原是保证DNA复制的必需因素,其表达水平在胚胎滞育期间显著降低,但在功能上增殖细胞抗原可能并不能作为滞育过程的决定因素[63-64]。此外也有研究发现,细胞周期蛋白依赖激酶(CDK1)和微小染色体维持5(MCM5)在滞育期间的表达具有显著的差异性[64]。CDK1是一种驱动细胞周期并调节细胞分裂、分化过程的重要物质,由其所介导的线粒体活性和ATP合成是保证细胞周期由G2到M期过渡的必要条件[65-66]。CDK1在G1后期由于磷酸化水平的降低其活性提升,而滞育胚胎中CDK1磷酸化水平显著提升。表明在胚胎滞育期间该蛋白活性下调,诱导细胞周期的停滞可能是引发胚胎滞育的关键因素[64]。MCM5作为细胞周期的另一种关键调节物质的亚基,在DNA复制的过程中通过被ORC募集而打开DNA双链、启动DNA复制过程,MCM5功能的缺失同样会导致细胞周期出现停滞[67-68]。在果蝇滞育胚胎中MCM5水平显著下调,由此推测MCM5可能作为调控细胞周期的另一重要因素影响胚胎滞育的过程[64]。
5 胚胎滞育的分子机制
目前研究发现,在胚胎发育、滞育及滞育激活的过程中,存在大量转录因子、亚细胞结构及环境胁迫因子介导的基因表达及代谢途径改变,进而发挥重要的调控功能[6]。转录因子是指参与细胞转录起始过程的多种蛋白协助因子,目前已被证实参与人、猪和小鼠等多种动物早期胚胎发育的调控过程[69-71]。其中同源盒基因Msx作为Homebox基因家族成员,被广泛用于胚胎发育过程[72]。在哺乳动物上的研究中发现,Msx1和Msx2是启动和维持胚胎滞育不可或缺的因素,其表达量在滞育期间持续处于较高水平,随着胚胎滞育的激活及植入过程的发生其表达量迅速下调,但在子宫Msx1和Msx2失活的小鼠、水貂和袋鼠中,胚胎滞育及再激活过程均无法实现[73]。Msx蛋白作为一种发育过程的转录抑制因子,主要通过靶向Wnt5a调控胚胎滞育过程;另一方面,Msx蛋白能够限制子宫的炎症反应,也是维持胚胎滞育的关键因素[74]。另外的研究表明,在子宫腺中另一转录因子FOXA2水平的下调是诱导子宫静止、从而支持胚胎发生滞育的关键因素,在FOXA2缺失的子宫中可能通过保持Msx蛋白处于高水平以维持静止状态,但FOXA2和Msx的复杂关系至今仍未得到阐述[49]。
白血病抑制因子(LIF)也是囊胚植入的重要信号,在臭鼬中LIF水平的升高与胚胎滞育现象之间存在显著的正相关[75]。LIF可能作为终止专性胚胎滞育的信号,在水貂胚胎植入前LIF的mRNA通常维持较高水平,而胚胎滞育阶段或植入后则不表达[76]。此外,FOXA2可能作为上游的调控因子干预LIF对滞育胚胎的调控过程,但至今也缺少相关试验证实[49]。Myc作为一种癌基因,当表达受到抑制后会通过调控转录、剪接及蛋白质合成过程使胚胎细胞的增殖潜力减弱,但多能性仍保持不变,在视网膜母细胞瘤家族蛋白(retinoblastoma protein,RB)存在时,胚胎可进入滞育阶段[77-78]。
小鼠在饥饿条件下诱导的LKB1-AMPK途径对mTOR的抑制被证明是胚胎进入滞育状态的必需条件,而滞育状态的终止则需要依赖mTOR的谷氨酰胺转运体SLC38A1的启动,因此mTOR途径的关键因子被认为是胚胎进入和退出滞育状态的门户[79]。mTOR活性受到谷氨酰胺水平的影响,谷氨酰胺可以通过诱导mTORC1易位并转移至溶酶体而降低mTOR水平,进而保证胚胎维持在滞育状态[79-80]。
此外,脂质液滴(lipid droplets,LDS)在小鼠胚胎早期发育、植入以及维持滞育等过程也发挥关键作用,去除滞育胚胎中的脂滴后胚胎无法存活;随着滞育状态的进展,胚泡中碳水化合物代谢向脂肪分解代谢转化,由脂肪分解或自噬产生的脂肪酸可能通过β氧化作为胚胎的主要能量来源,因此脂滴水平也通常呈现下降趋势[81-83]。
6 展望
随着现代分子生物学技术的发展,对胚胎滞育机制的认知愈发清晰。对于动物胚胎发育、附植、停滞及再激活等生理过程的研究也筛选出很多关联基因,但胚胎滞育的内在复杂分子机制并未得到清晰的诠释。并且有关胚胎滞育的试验研究也主要集中于小鼠、大鼠及水貂等实验动物上,对于家禽家畜、经济动物及伴侣动物的相关研究较少。此外,目前胚胎滞育研究主要处于基础知识的积累阶段,在未来的应用方向也仍未明确。胚胎滞育作为一种动物对环境适应的繁殖现象,也可能为其他领域的研究提供一条新的思路:(1)由于胚胎滞育过程是一种可逆的现象,胚胎再激活后仍具有很高的活性,并且在小鼠、大鼠、水貂等动物中可实现人为的诱导控制,在未来该技术可能成为一种新型的胚胎保存方法,以降低冷冻保存所导致的机械、化学损伤。(2)胚胎的激活、植入等过程与癌症的发生发展、侵袭存在较高的相似性,并且目前研究筛选到的调控胚胎滞育过程的基因也具有调控细胞周期的功能,因此诱导癌症进入类似胚胎滞育的状态可能是癌症治疗领域的一个思路。(3)目前对于胚胎滞育诱导的完整机制仍不清晰,相关激素浓度的变化能否通过级联反应影响miRNA水平、调控靶基因的表达,进而干预子宫条件、细胞周期以及胚胎滞育等过程,仍需研究和探索。

