CT增强扫描与高分辨MRI在直肠癌术前分期评估中的应用
张学勤 张 涛 杨浩然
徐州市第一人民医院影像中心(江苏 徐州 221000)
直肠癌是多发于40岁以上中老年男性的原发于直肠黏膜上皮细胞的恶性消化道肿瘤,早期症状不明显,缺乏特异性,病情进展后出现排便习惯改变、便血、腹痛、腹胀等肠腔狭窄症状[1]。目前临床治疗直肠癌多以手术方式为主,通过切除病灶,帮助患者获得长期生存[2]。而在手术之前,通过影像学检查明确并肿瘤定位、分期,对于临床治疗方式的选择具有积极意义[3]。CT增强扫描和高分辨磁共振(MRI)是现阶段常用的直肠术前分期检查技术,可通过评估直肠肿瘤对邻近组织器官的浸润和淋巴结转移程度评估肿瘤分期,对于手术具有较好的指导意义[4],有利于帮助医生制定科学有效的手术治疗方式。本次研究通过对98例直肠癌患者进行CT增强扫描和高分辨MRI检查,对比两种方式对术前分期评估的诊断价值,希望为临床直肠癌术前分期提供更多理论依据,现将具体内容报告如下。
1 资料与方法
1.1 一般资料选取2018年7月至2020年7月期间我院收治的直肠癌患者98例,病例入组标准如下。
纳入标准:临床资料、影像学检查结果完整;术前未接受过放疗、化疗等相关治疗;术前均接受CT增强扫描及高分辨MRI检查。排除标准:多碘过敏者;CT增强扫描及高分辨MRI检查禁忌症者;重要器官功能不全者;临床资料或影像学资料缺失,精神障碍,无法配合完成研究者。98例患者中男性62例,女性36例;年龄为37~78岁,平均年龄(56.95±8.31)岁;直肠癌患者均出现排便习惯改变、腹痛、腹胀及大便带血症状。
1.2 检查方法
1.2.1 CT增强扫描 扫描开始前4h内禁食,并进行碘过敏实验,确认无过敏症状后让患者保持仰卧位,脚部先进入,双臂上举,采用德国西门子EMOTION 16排螺旋CT仪进行扫描,CT机由膈顶至盆底进行扫描,设置参与为准直器宽度20mm,螺距1mm,电压120 kv,电流300~400mA。采用高压注射器一次性将扎喷酸葡胺以0.2mL/kg按照2mL/s的速率肘静脉注射,待注射完毕后以20mL无菌氯化钠溶液同样以2mL/s的速率冲管,采用三维容积内插体部检查序列,行冠、矢、轴三平面T1WI脂肪抑制扫描,设置参数为:TR=4.18ms,TE=2.01ms,矩阵320×256,层厚3mm,层间隔0.6mm,NEX2。
1.2.2 高分辨MRI检查 检查前4h内禁食,前2h对患者进行灌肠处理,前30min给予10 mg山莨菪碱肌肉注射以抑制肠道蠕动,采用3.0 T磁共振成像仪进行高分辨MRI检查,18通道体部相控阵线圈,患者保持仰卧位,以头部先进入的方式进行检查,行横断、矢、冠状面扫描,TSE序列T2WI(TR=4600~5240 ms,TE=124 ms),层厚3mm,层间距0.15 mm,FOV(18~20)×(15~18)cm,体素大小为0.7mm×0.7mm×3.0×mm。
1.3 图像分析由两名经验丰富的放射科医师对CT增强扫描和高分辨MRI检查结果以双盲法进行阅片,当两名医师阅片结果意见不一致时,再共同探讨出最终结果。
1.4 观察指标观察直肠癌患者CT增强扫描和高分辨MRI检查影像学结果,将病理检查结果作为“金标准”,比较两种检查方式在直肠癌术前分期评估诊断中的准确率。
1.5 分期标准直肠癌分期标本按照美国癌症联合委员会公布的第七版TNM分期作为影像学检查的诊断标准[5],(1)T分期标准:T1期为肿瘤组织侵犯直肠黏膜下组织,T2期为肿瘤组织侵犯直肠壁黏膜固有层及肌层,T3期为肿瘤组织穿透固肌层、肌层和浆膜层,或者侵犯结直肠周围组织,T4期为肿瘤组织侵犯临近器官,甚至累及腹膜。(2)N分期标准:N0期为未出现淋巴结转移情况,N1期为出现少数1~3个淋巴结转移,N2期为出现3个以上淋巴结转移。
1.6 统计学分析采用SPSS 22.0软件对本研究数据进行统计学处理,计算影像学检查对直肠癌术前分期评估的敏感性、特异性、阳性预测值、阴性预测值,准确率用%表示,Kappa法检验术前分期检查与病理结果的一致性,当0.01<kappa<0.39为一致性较差,0.40<kappa<0.74为一致性较好,0.75<kappa<1.00为一致性好,均以P<0.05代表有统计学差异。
2 结 果
2.1 两种诊断方式T分期结果对比以直肠癌术后病理结果作为诊断“金标准”,CT增强扫描检测术前各T分期的准确率为70.97%、80.00%和77.27%,显著低于高分辨MRI诊断准确率87.10%、91.11%和90.91%(P<0.05),高分辨MRI在直肠癌术前T分期评估中的诊断效能优于CT增强扫描(P<0.05),见表1、表2。
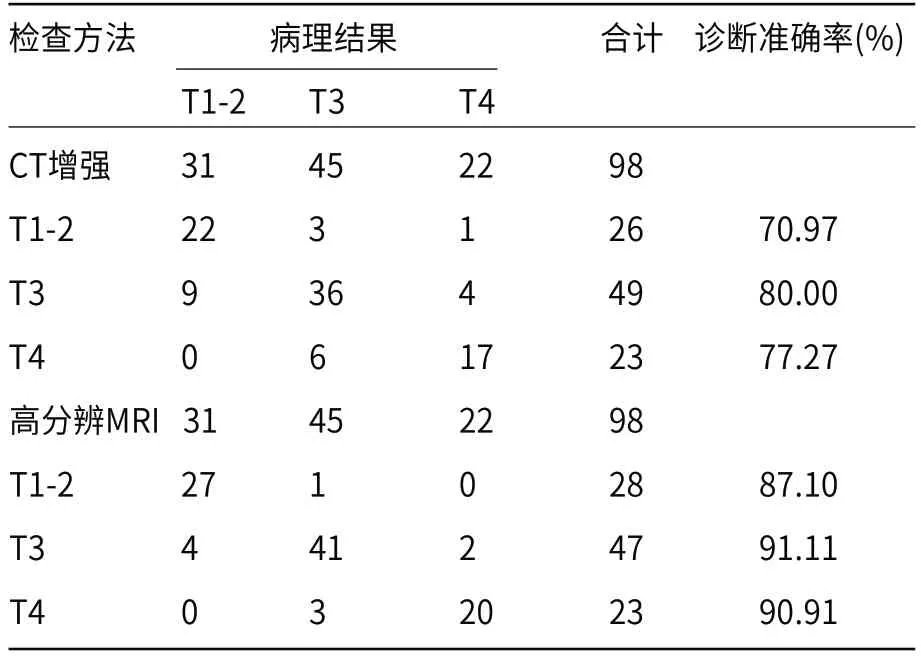
表1 直肠癌术前T分期诊断结果比较(例)
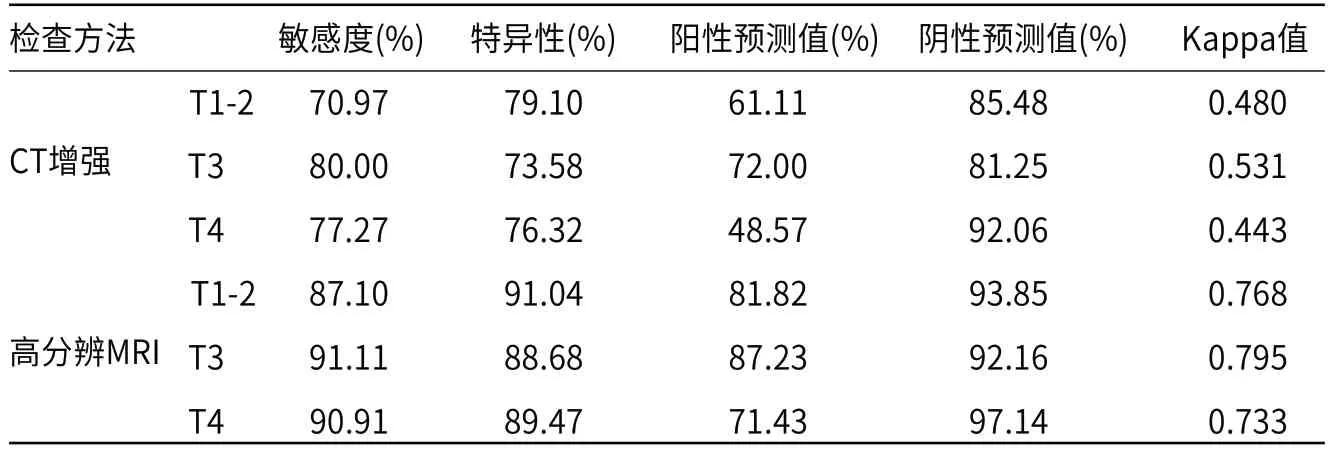
表2 两种诊断方式对不同T分期直肠癌患者诊断效能分析
2.2 两种诊断方式不同N分期结果对比以直肠癌术后病理结果作为诊断“金标准”,CT增强扫描检测术前各N分期的准确率为80.86%、79.25%和70.00%,显著低于高分辨MRI诊断准确率91.43%、88.68%和80.00%(P<0.05),高分辨MRI在直肠癌术前N分期评估中的诊断效能优于CT增强扫描(P<0.05),见表3、表4。

表3 直肠癌术前N分期诊断结果比较(例)

表4 两种诊断方式对不同T分期直肠癌患者诊断效能分析
2.3 图像分析典型病例CT增强扫描和高分辨MRI影像学结果见图1~图5。患者,女,58岁。图1~图2:CT:直肠轴位及矢状位,显示直肠壁不均匀增厚,管腔狭窄,增强呈明显强化,管壁毛糙。图3~图5:磁共振直肠管壁不均匀增厚,管腔狭窄,弥散明显受限,增强明显强化,管壁毛糙,周围脂肪系膜可见条索影。
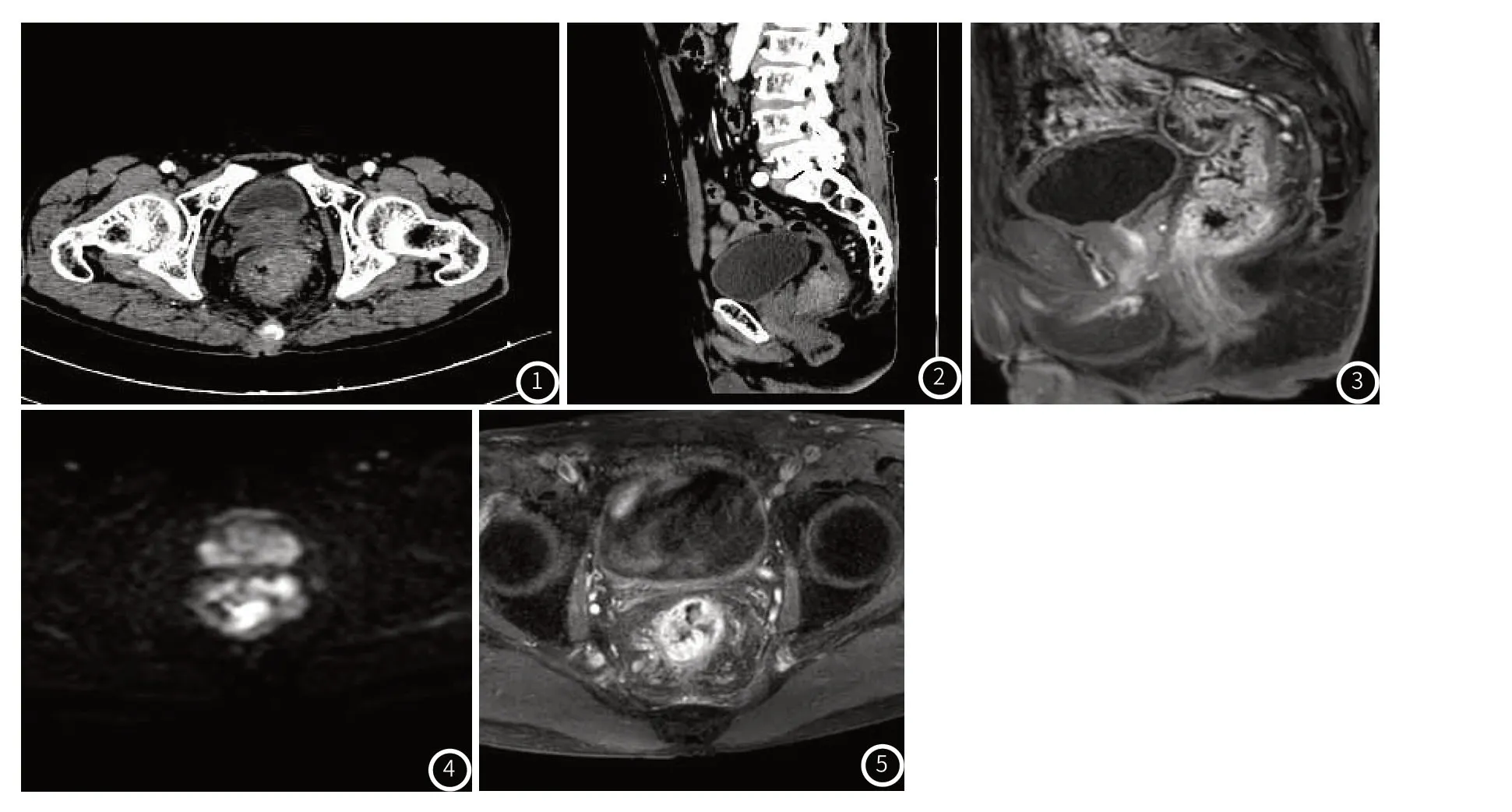
图1~图5 典型病例CT增强扫描和高分辨MRI影像学结果
3 讨 论
直肠癌是世界第三大恶性肿瘤之一,发病率高,死亡率高,恶性程度较高[6]。直肠癌患者的预后情况与肿瘤浸润直肠系膜和手术环周切缘的能力密切相关,肿瘤浸润程度越高,淋巴结转移越多的患者,术后复发风险越高,预后越差[7]。有效的术前评估对于手术方案的制定和临床实施而言十分关键,在术前明确肿瘤分期可极大保障手术成功率,提高患者预后[8]。本研究通过对比98例直肠癌患者行CT增强扫描和高分辨MRI的影像学结果,与术后病理结果进行对比,评估两种检查方法对直肠癌术前分期评估的效能,旨在为直肠癌患者预后的改善提供有效帮助。
CT增强扫描对肿瘤组织和肠内容物的识别作用主要依靠各组织之间密度的不同,而直肠内黏膜下层、固有层、肌层和浆膜层的密度差异较小[9],CT增强扫描难以很好区分T1期和T2期。此外,通过观察直肠壁光滑或粗糙程度,有无向腔外延伸的肿块来判断肿瘤是否实现浆膜层的浸润,当出现上述征象时说明直肠癌已进入T3期[10]。高分辨MRI是基于传统MRI手段进一步升级的高空间分辨和大扫描野影像技术,可清晰的扫描直肠壁各肌层结构。直肠内黏膜下层、固有层、肌层和浆膜层等肌层在直肠癌术前分期诊断中发挥重要作用,高分辨MRI诊断时,肌层信号环中断表示该层受到侵犯,从而较好地反应肿瘤浸润深度[11],同时结合周围组织炎性纤维增生、肿瘤癌性外侵及血管病变情况区分T1、T2、T3、T4期。本次研究发现,与高分辨MRI技术相比,CT增强扫描对直肠癌术前T分期的诊断受限,难以很好的评估肿瘤浸润程度,主要原因可能在于CT增强扫描图像对上段直肠和前壁肿瘤的扫描难度较大,对于肌层浸润程度和分辨和肌层病灶边界的判断弱于高分辨MRI技术[12]。
本研究还发现,高分辨MRI技术对于N分期的诊断效能优于CT增强扫描,目前临床上多将直径大于10 mm、边缘不规则的结节视作转移淋巴结[13],CT对于淋巴结转移情况的诊断作用同样通过密度来判断,但当直肠肿瘤周围组织和邻近器官受到肿瘤侵犯时,周围组织器官粘附性下降,密度差降低,导致CT增强扫描无法区别混合在组织器官中的转移淋巴结[14]。而高分辨MRI对淋巴结转移的识别作用是通过分辨软组织结构来实现的,当观察到直肠周围组织出现直径超过10mm的圆形、椭圆形结节时即可较好诊断淋巴结转移情况,区分N0、N1和N2分期[15],因此,相较于CT增强扫描而言,高分辨MRI技术对于N分期的诊断效能更佳。
综上所述,与CT增强扫描相比,高分辨MRI可有效诊断直肠癌术前T分期和N分期,可较好的反映肿瘤病灶、周围组织和临近器官的情况,为直肠癌手术治疗提供更加有效精准的信息,辅助临床制定合理的治疗方式,提高手术成功率,减轻手术带来的创伤,有利于患者术后恢复。

