基于FAERS数据库的胰高血糖素样肽-1受体激动剂药物不良信号的数据挖掘与分析
王安妮,李轶凡,马小磊,冯 欣(首都医科大学附属北京妇产医院/北京妇幼保健院,北京 100026)
美国糖尿病学会最新指南指出,使用胰岛素的2型糖尿病患者(diabetes mellitus type 2,T2DM)联合应用胰高血糖素样肽-1受体激动剂(glucagon-like peptide-1 receptor agonist,GLP-1 RA)可提高治疗有效性。目前国内已上市7种GLP-1 RAs并批准用于治疗T2DM,包括艾塞那肽、利拉鲁肽、贝那鲁肽、利司那肽、度拉糖肽、司美格鲁肽和洛塞那肽。GLP-1 RAs可通过多种途径治疗并改善T2DM,如增加胰岛素分泌、延迟胃排空、增加饱腹感等[1]。FAERS是一个对公众免费开放的药品不良事件(adverse drug event,ADE)数据库,可对药品上市后进行安全性再评价。本研究从数据库中获取国内外均上市的5种GLP-1 RAs(艾塞那肽、利拉鲁肽、利司那肽、度拉糖肽和司美格鲁肽)的全部数据,进行ADE信号的数据挖掘与分析,为安全应用GLP-1 RAs提供真实世界数据支持。
1 资料与方法
1.1 数据来源
FAERS数据库包含了医疗保健专业人员、消费者和制造商等提交给美国FDA的不良事件和用药错误报告。本研究使用openFDA访问FAERS,以“exenatide”、“liraglutide”、“lixisenatide”、“dulaglutide”和“semaglutide”为关键词,对“drugname”进行模糊匹配,提取数据库中2004年第一季度至2021年第三季度的数据并删除重复报告。
1.2 数据筛选与标准化
将提取数据导入SQLitefile,从中筛选出以艾塞那肽(62 023份)、度拉糖肽(39 531份)、利拉鲁肽(29 227份)、司美格鲁肽(6661份)和利司那肽(1379份)为目标药物和首要怀疑药物的报告。FAERS数据库中不良事件的表示方式使用国际医学用语词典的药品不良反应术语集进行标准化,本研究使用MedDRA 24.1软件将报告中的低位语整理为对应的首选术语(preferred term,PT),并将PT映射到对应的系统器官分类(system organ class,SOC)。
1.3 数据处理与分析
本研究采用比例失衡分析法进行药品不良反应分析,应用比例报告比值比法(proportional reporting ratio,PRR)和报告比值比法(reporting odds ratio,ROR)进行信号检测,提示信号即表示药品与目标事件之间有潜在关联性[2]。PRR的信号判断标准为:95%CI下限> 1,报告数≥3,PRR≥2且χ2≥4。ROR的信号判断标准为:95%CI下限> 1[3]。
2 结果
2.1 ADE报告分析结果
在FAERS数据库中共提取5种GLP-1 RAs的ADE报告138 821份。对以上报告进行筛选,排除产品质量问题、装置功能故障、各类损伤、中毒及操作并发症、社会环境等与药品无关的报告后,共收集ADE报告203 325例次。分别按报告例次、ROR值大小进行排序,详见表1、表2。
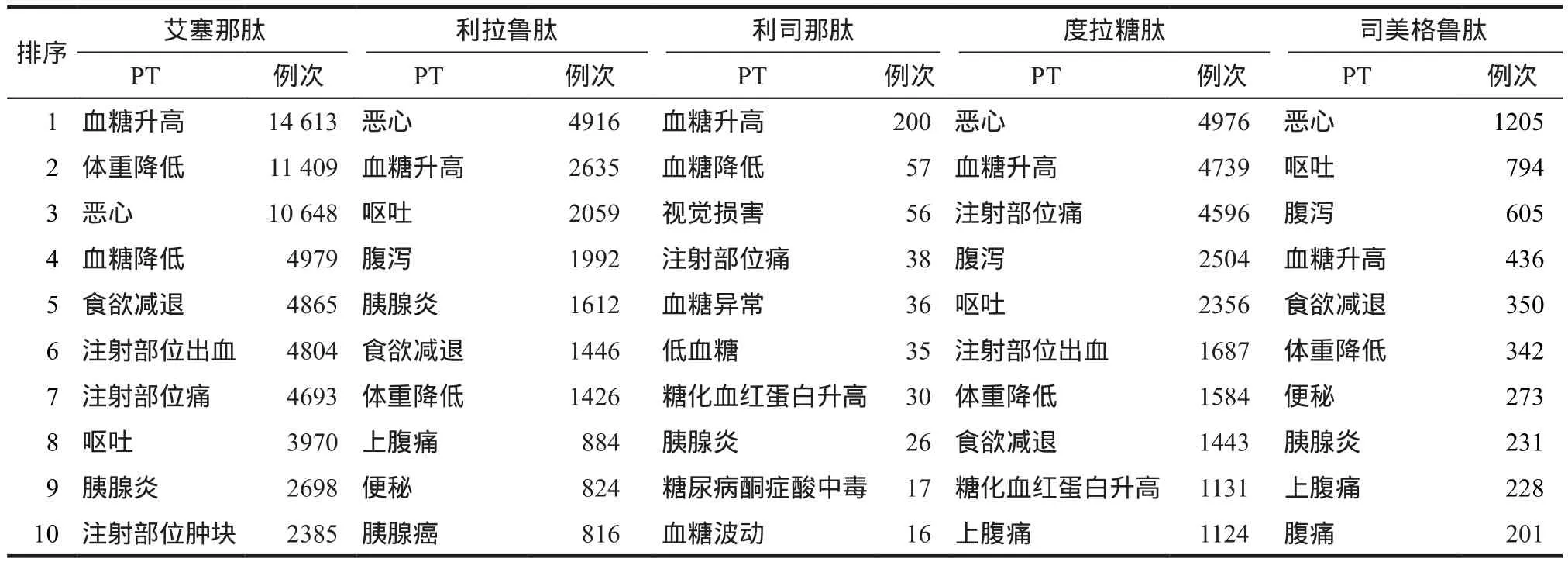
表1 5种GLP-1 RAs报告例次排名前10位的ADE信号Tab 1 Top 10 ADE signals of 5 kinds of GLP-1 RAs reports
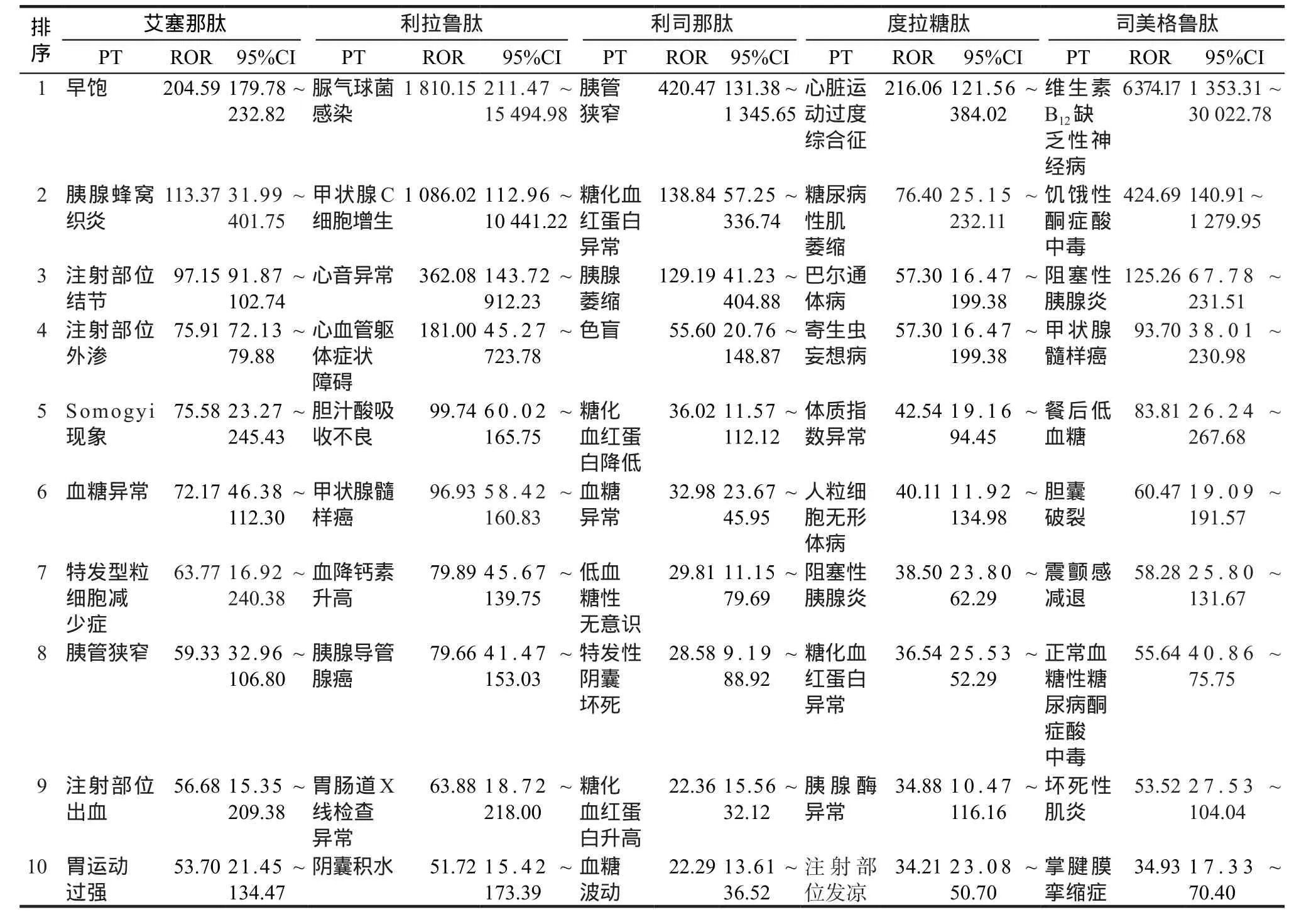
表2 5种GLP-1 RAs ROR值排名前10位的ADE信号Tab 2 Top 10 ADE signals for ROR values of 5 kinds of GLP-1 RAs
2.2 各系统器官分类ADE及信号分布
对5种药品目标信号的PT进行SOC分类排序,按照报告总例次大小排序,详见表3。
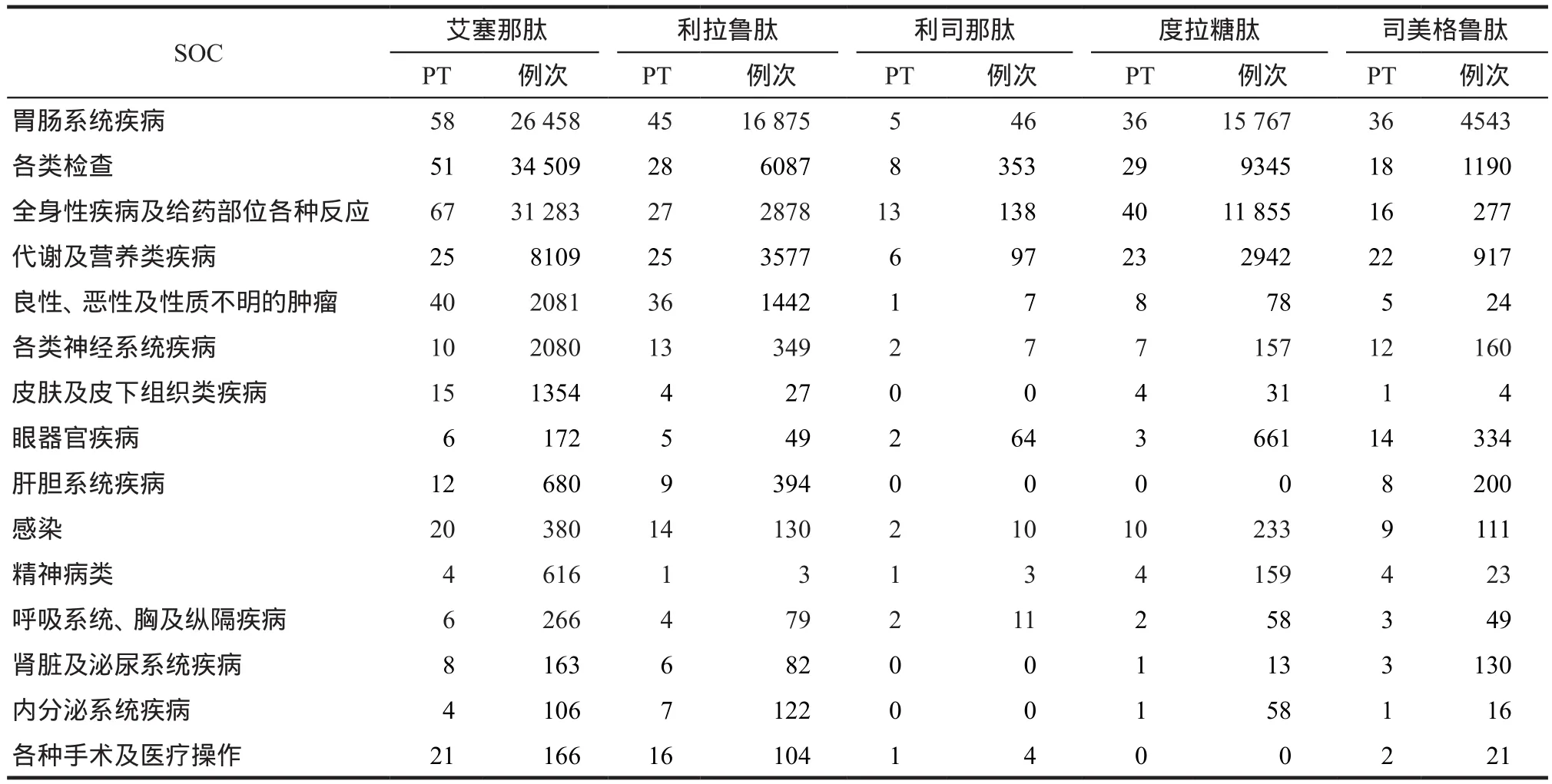
表3 5种GLP-1 RAs ADE累及系统/器官Tab 3 Systems/organs involved in ADE by 5 kinds of GLP-1 RAs
3 讨论
GLP-1 RAs从肠道分泌,可刺激胰岛素分泌并抑制胰高血糖素释放,延迟胃排空、增加饱腹感,从而减少食物摄入帮助减重[4]。部分胰岛素强化治疗的患者会加用GLP-1 RAs联合治疗[5],长期应用此类药品的安全风险往往通过其上市后再评价获取数据。故笔者使用FAERS数据库进一步研究了药品不良反应,为国内安全应用GLP-1 RAs提供数据支持。
3.1 说明书已收录的不良反应
GLP-1 RAs说明书中提示该药主要不良反应是胃肠道副作用,尤其是恶心、呕吐、非机械性肠梗阻和胰腺炎等[6-7]。有研究[8]指出GLP-1 RAs与噻唑烷二酮类、磺酰脲类药品相比,恶心发生率更高。本研究结果显示,相比于其他4种药品,利司那肽的胃肠道不良反应报告少,提示有胃肠道疾病的患者使用利司那肽可能是更好的选择。5种药品说明书中均提及用药与胰腺炎有相关性,一项针对1269例T2DM急性胰腺炎患者的病例对照研究指出,GLP-1疗法可能会增加急性胰腺炎的风险[9]。
除胃肠道不良反应外,GLP-1 RAs说明书中的主要不良反应还有注射部位皮肤或组织异常、低血糖和神经系统异常。有研究[10]表明GLP-1 RAs与赖脯胰岛素相比,更易引起局部反应。GLP-1 RAs致低血糖风险较小,但如果联用其他可导致低血糖的药品,则会出现低血糖症状。神经系统的不良反应包括头晕、头痛、眩晕、味觉障碍、嗜睡等[7],临床应监测患者相关症状,并提示眩晕、嗜睡、震颤患者防止跌倒,并且避免高危作业或驾驶机动车等。
3.2 新的疑似ADE信号
值得关注的新的疑似ADE信号为胰腺癌,一项上市后研究表明应用GLP-1 RAs后亚临床胰腺炎症和胰腺癌风险增加[11],另有研究指出接受GLP-1 RAs治疗的患者急性胰腺炎或胰腺癌风险与安慰剂组风险无显著性差异[12],所以目前对于其致胰腺癌的风险尚存争议,在获得确切数据前,胰腺炎、胰腺癌仍将被视为用药风险。
将5种药品的ROR值按降序排列,结果显示利司那肽和司美格鲁肽均有致糖尿病酮症酸中毒的报告,英国药监机构和FDA曾提出GLP-1 RAs与糖尿病酮症酸中毒之间的关联性[13],药品说明书中只提示药品不可用于糖尿病酮症酸中毒患者,在不良反应中仍未提及有导致糖尿病酮症酸中毒的风险。
另外,SOC提示应关注肝胆系统疾病和眼器官疾病,有研究提示GLP-1可抑制糖尿病患者餐后胆囊收缩素的分泌和胆囊收缩性,与胆囊功能障碍有关[14],蒋王艳等[7]发现,与其他GLP-1 RAs不同,司美格鲁肽更加强调致眼系统疾病的风险。因此在使用GLP-1衍生药物治疗期间,应关注相关不良事件风险。
3.3 GLP-1 RAs致甲状腺相关疾病差异
GLP-1 RAs已被证明可刺激啮齿动物的甲状腺C细胞增殖[15],5种GLP-1 RAs药品说明书均提示有引起甲状腺C细胞肿瘤的风险,但利司那肽注射液没有相关黑框警告和禁忌症,FAERS数据库中也无甲状腺相关的不良事件信号。通过查询电子健康记录数据库比较了使用GLP-1 RAs和使用二甲双胍患者之间的癌症发病率,并在FAERS中得到验证,即GLP-1 RAs与前列腺癌、肺癌和结肠癌风险相关度低,与甲状腺癌风险高度相关[16]。故在临床应用中应关注患者甲状腺系统相关疾病。
综上所述,本研究基于FAERS数据库对艾塞那肽、利拉鲁肽、利司那肽、度拉糖肽和司美格鲁肽进行了真实世界数据挖掘与分析,结果显示应用GLP-1 RAs后需要关注胃肠道不良反应、注射部位皮肤或组织异常、神经系统异常以及甲状腺C细胞肿瘤风险等。同时,本研究发现其可能存在的新的风险信号,如注射部位外渗(艾塞那肽微球剂型)、胰腺癌、糖尿病酮症酸中毒、眼器官疾病和胆囊功能障碍,建议临床应密切监护患者有无相关症状。本研究也存在一定局限性,FAERS是自发性呈报数据库,上报人员复杂,故报告数据质量参差不一,存在数据信息不全、错报误报等问题。且FAERS数据库的主要上报国家多为欧美国家,亚洲人群相关数据少。未来还需要进一步完善相关研究,以保障患者用药安全。

