乳腺癌改良根治术患者采用TPVN与Pecs-Ⅱ阻滞效果对比及对血流动力学、应激反应的影响
刘国增 李继锋
1.浚县人民医院(河南 鹤壁 456250);2.鹤壁市人民医院(河南 鹤壁 458030)
乳腺癌是发生于乳腺上皮组织中的恶性肿瘤,主要机制:机体免疫功能低下,致癌物质及致癌因子诱发的突变细胞未能及时清除,导致乳腺上皮细胞出现增殖失控致使恶变,诱发乳腺癌[1]。乳腺癌改良根治术是治疗乳腺癌的有效方案,能够有效切除肿瘤,抑制肿瘤细胞生长繁殖,但手术作为一种有创手术,术间机械性损伤等多种因素可引起患者疼痛剧烈,造成术后机体活动受限,对患者生存质量和安全产生负面影响,预后不良。因此,术中选择一种有效、合理的镇痛方案极为关键。既往临床普遍应用胸椎旁神经(thoracic paravertebral nerve,TPVN)阻滞,通过阻滞疼痛神经传递信号,可减轻疼痛,解除活动受限,有利于术后进行康复训练,但乳腺癌涉及范围较广,手术不仅引起切口处疼痛,还可造成切口周围组织疼痛,而TPVN镇痛范围较为局限,为维持镇痛效果,需多次用药,增加继发并发症发生概率,严重时发展为慢性疼痛,导致临床效果不佳,超胸神经Ⅱ(Pectoral nerves Ⅱ,Pecs-Ⅱ)阻滞是改良的一种神经阻滞法,在超声引导下增加了二次药物注射,有效增加病灶药物浓度,提高镇痛效果[2]。或许Pecs-Ⅱ临床价值更高,基于此,本研究通过两种方案分别应用于乳腺癌改良根治术中,并通过分析对比探讨何种方案更具有临床价值。现报道如下。
1 资料与方法
1.1一般资料 本研究经院伦理委员会批准,纳入本科2018年11月至2020年11月接诊的乳腺癌患者91例按照随机数字表法分为两组,其中对照组45例,年龄34~51(43.21±5.24)岁,手术时间89~115(105.69±3.26)min,体质量指数(BMI)20~25(22.60±2.14)kg/m2;观察组46例,年龄35~50(42.96±5.78)岁,手术时间80~121(106.78±3.15)min,BMI20~26(22.78±2.03)kg/m2。两组患者上述资料比较无统计学意义(P>0.05)。纳入标准:符合乳腺癌诊断标准[3],且行乳腺癌改良根治术者;患者和家属自愿签署知情同意书;均首次进行手术。排出标准:穿刺位点存在皮肤破损者;合并凝血禁忌症者;局部存在麻药过敏者。
1.2方法 两组患者入手术室后,进行监测心电图、体温及血压等常规生命体征检测。麻醉诱导:使用芬太尼(国药集团工业有限公司,国药准字:H20123298,10ml)3μg/kg和罗库溴铵(华北制药股份有限公司,国药准字:H20103459,2.5ml∶25mg)0.6mg/kg等,麻醉后连接麻醉机,喉罩通气参数设置:潮气量:8×10ml/kg,二氧化碳分压(PCO2):30×40mmHg,呼吸:12次/min,
对照组在麻醉诱导前给予TPVN阻滞,患者采取坐位,位点确认于T4间隙,进行常规消毒和铺巾,局部麻醉后注入0.5%罗哌卡因(江苏恒瑞医药股份有限公司,国药准字:H20080137,10ml∶100mg)10ml。观察组麻醉诱导前给予超声引导下Pecs-Ⅱ阻滞:指导患者采取仰卧位,将超声探头放置于锁骨外三分之一处,定位至胸大肌和胸小肌肌肉间隙,于探头平面通过外周神经丛穿刺针注射0.5%罗哌卡因10ml,然后超生探头定位至前锯肌和胸小肌间,进行局部麻醉,继续行针注射0.5%罗哌卡因20ml后拔出,期间24h密切观察患者是否出现不良反应,并予以相关治疗。手术24h后观察两组结果。
1.3观察指标 (1)镇痛效果:记录患者手术时间及24h内舒芬太尼用量。使用视觉模拟评分(VAS)(0~10分)对患者术后24h疼痛情况进行评估,评分越高表示疼痛症状越重。
(2)血流动力学指标:使用血压仪检测患者收缩压和舒张压,平均动脉压计算公式=(收缩压+2×舒张压)/3。
(3)应激反应指标:抽取患者空腹静脉血10ml,以3000r/min速度离心10min,取上层清液,使用全自动生化仪(济南泰医生物技术有限公司,BK-400)检测患者手术前后血清肾上腺素、去甲肾上腺素水平、血清皮质醇水平。

2 结果
2.1镇痛效果比较 观察组手术后、24h内舒芬太尼用量及VAS评分水平均低于对照组(P<0.05)。见表1。
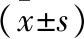
表1 2组患者镇痛效果对比
2.2血流动力学指标比较 观察组手术后收缩压、舒张压及平均动脉压水平均高于对照组(P<0.05)。见表2。

表2 2组患者血流动力学对比
2.3应激反应指标比较 观察组肾上腺素、去甲肾上腺素、血清皮质醇水平均低于对照组(P<0.05)。见表3。
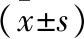
表3 2组患者应激反应指标比较
3 讨论
研究表明,乳腺癌占据我国女性恶性肿瘤首位,且发病率呈上升趋势,还具有遗传风险,逐渐引起医学界和社会广泛关注[4],严重威胁女性生理健康。乳腺癌改良根治术是用于临床的一种常用方法,通过将患者乳腺及癌瘤周围5cm宽的皮肤、乳腺周围脂肪组织及锁骨下所有脂肪组织和淋巴结等整块摘除[5],可有效降低肿瘤对机体的压迫,提高患者生存率,同时具有一定损伤性,可激活机体伤害性感受器,刺激感觉神经末梢传递神经疼痛信号,进而引起疼痛剧烈[6],不利于术后恢复。
目前临床上多予以TPVN阻滞,通过神经干旁注射麻醉药,可起到阻滞神经传导功能,以此达到手术无痛作用[7],虽说在减轻患者疼痛方面取得一定成就,但操作复杂,对穿刺者的专业性要求极高,效果具有局限性,因此,需寻找新的有效手段进行干预,相关研究指出,Pecs-Ⅱ阻滞通过定位至胸小肌与胸大肌肌肉间隙,对胸长神经、胸内侧神经等多处神经均起到良好阻滞效果[8],有效降低患者因疼痛引起的心理应激亢进,在超声引导下可准确定位穿刺针穿刺相应位点,减少正常组织损伤程度,安全性较高,逐渐成为主流趋势[9]。
乳腺癌根治术作为一种有创手术,可刺激致痛物质的分泌和聚集,致使局部损伤部位及损伤周围组织出现疼痛症状,可引起患者心理应激反应过高,依从性下降,对手术质量起到直接影响。因此,通过疼痛程度的检测可判断患者康复程度。本研究通过VAS评分水平评价患者疼痛程度,水平越高表示疼痛程度越重。本研究数据显示,观察组镇痛效果优于对照组(P<0.05)。TPVN阻滞通过在T4间隙进行局部麻醉,可达到阻滞神经根,使所支配区域痛感消失或减弱,抑制致痛物质的分泌和聚集,进而减轻痛觉。Pecs-Ⅱ通过在胸大肌和胸小肌注射麻药并沿着胸外侧动脉扩散,可有效阻滞胸内侧神经、胸背神经、肋间神经等多处神经,为胸部的前外侧及部分后侧提供麻醉作用,范围较广且持续时间长,减轻疼痛效果更优,有效提高患者依从性,缩短手术时间,还可避免术后疼痛重复用药引起额外不良反应,同时在超声的引导下,还可实时动态观测麻药扩散情况,提高药物效率和病灶药物浓度,完善神经阻滞效果,减少麻醉药物的使用。Pecs-Ⅱ阻滞麻醉方案镇痛效果更佳,可有效缩短住院时间。
手术引起的疼痛和伤害性以及手术期间全麻处理,均可造成神经内分泌系统亢进,导致血液中炎性细胞因子和应激激素大量释放,引起低血压或肾脏、肝脏等缺血缺氧性损伤,本研究数据显示,两组患者收缩压、舒张压及平均动脉压均有所降低,而观察组水平低于对照组(P<0.05),去甲肾上腺素、肾上腺素和血清皮质醇水平低于对照组(P<0.05)。TPVN通过局部注射麻药,可抑制从传入神经向中枢神经传递有害信号,稳定中枢神经内分泌系统,进而减轻应激反应程度,降低血清皮质醇等应急激素水平。Pecs-Ⅱ对2~6肋间神经神经外侧皮支等多处胸外神经均具有麻醉效应,有效阻滞伤害性刺激信号传递,使乳腺周围皮肤麻痹,降低神经元及中枢灵敏性,从而降低疼痛,减少细胞内信号级联反应,减少炎性细胞因子数量,收缩血管,稳定血流动力,同时在超声的引导下,将盲目性手术改变为可观性手术,定位准确性及神经阻滞效果均有所增强,避免周围正常组织损伤,可降低机体应激反应,抑制炎症因子及应激激素的合成与分泌,维持正常血压水平,相较于TPVN,TPVN阻滞可有效调节血液动力学,降低机体应激反应水平。与崔秀玲等人研究相符合[10]。本研究纳入例数较少,可能造成结果出现一定偏移,后续研究将弥补上述不足以证实其应用于乳腺癌改良根治术患者中的应用价值。
综上所述,超声引导下Pecs-Ⅱ阻滞可有效抑制交感神经兴奋性,提高镇痛效果,降低应激反应,避免心率及血压过快。

