肠外营养联合肠内营养对肺癌术后化疗患者营养状况及免疫功能的影响
张璐芳,于士昌,翟建宾,赵臣亮,赵宏达,赵 亮
(1.河北省卫生健康委员会综合监督服务中心中医处,河北 石家庄 050200;2.河北省中医院外三科,河北 石家庄 050200)
肺癌是临床常见的恶性肿瘤疾病,主要临床症状有咳嗽、咯血、胸痛等,其发病率和病死率居恶性肿瘤首位,严重威胁患者的生命健康[1]。目前,临床治疗肺癌的方法主要包括手术治疗、放疗、化疗、免疫治疗等,其中手术结合化疗应用较广泛,但手术治疗会导致肺癌患者机体处于应激状态,进一步增加能量消耗,导致患者出现营养不良、免疫力下降等现象,而化疗亦会导致患者营养不良,使术后恢复效果受到影响;因此,给予肺癌术后化疗患者营养支持对促进患者术后恢复具有积极意义[2]。肠内营养是营养治疗中的一种,能够为肺癌术后化疗患者提供代谢所需的营养物质,同时可维持肠黏膜结构及屏障功能[3],但化疗会导致患者出现胃肠道反应进而影响普通饮食的营养摄取,而肠外营养治疗不经肠道吸收,可有效改善患者营养摄取状况[4]。有研究认为采用肠外营养联合肠内营养可提高化疗患者的生存质量,改善预后[4]。患者的营养状况及全身的免疫状态是影响患者生存质量和预后的重要因素,但采用肠外营养联合肠内营养对肺癌术后化疗患者营养状况及免疫功能的影响尚缺乏深入研究。基于此,本研究选取110例肺癌术后化疗患者进行随机对照研究,旨在为肺癌患者术后营养恢复提供有效参考依据,现报告如下。
1 资料与方法
1.1 临床资料
选取2019年5月至2021年11月我院收治的110例肺癌术后化疗患者作为研究对象,采用随机数字表法分为对照组(55例)和观察组(55例)。对照组中,男40例,女15例;手术切口5~14 cm,平均(9.54±1.85)cm;年龄40~61岁,平均(50.54±4.98)岁;肺癌类型[5]:鳞癌21例,腺癌18例,其他16例;手术方式:肺叶切除24例,肺段或楔形切除28例,全肺切除3例。观察组中,男41例,女14例;手术切口5~15 cm,平均(9.61±1.90)cm;年龄40~62岁,平均(50.79±5.06)岁;肺癌类型:鳞癌23例,腺癌17例,其他15例;手术方式:肺叶切除23例,肺段或楔形切除27例,全肺切除5例。2组患者性别、手术切口、年龄、肺癌类型、手术方式等临床资料比较,差异均无统计学意义(P>0.05),具有可比性。本研究经我院医学研究伦理委员会审核并批准(2017-科研-16)。
1.2 纳入标准及排除标准
纳入标准:符合《新编常见恶性肿瘤诊治规范》[6]中关于肺癌的相关诊断标准,且经病理学检查确诊;术后预计生存时间≥3个月;无放疗、化疗史;营养风险筛查表[7]评分≥3分;无精神系统疾病,具备正常沟通交流能力;依从性较好,能够积极配合治疗。
排除标准:伴有手术或化疗禁忌证;伴有胃肠道疾病、血液系统疾病;合并肝癌、胃癌等其他恶性肿瘤;伴有免疫系统疾病或感染性疾病;参与本实验研究的同时参加其他研究。
1.3 方法
对照组患者给予肠内营养治疗,对其进行饮食指导、生命体征监测及抗感染等常规处理。经鼻放置肠管,保证肠管末端越过十二指肠乳头且在空肠内,经肠管匀速滴注肠内营养混悬液[纽迪希亚制药(无锡)有限公司,批号:101093786,1 kcal/mL],滴注速度:第1天70 mL/h,若患者无不适感,第2天以100 mL/h的速度进行滴注。
观察组在对照组基础上给予肠外营养治疗,主要包括葡萄糖、电解质、氨基酸、维生素长链脂肪乳及微量元素等营养液,经过深静脉导管匀速滴入肠外营养注射液[辽宁海思科制药有限公司,1 000 mL/袋],7 d后改为肠内营养治疗。2组均治疗14 d。
1.4 观察指标
1.4.1 营养指标 于治疗前、治疗14 d后的清晨采取2组患者空腹静脉血9 mL,以3 500 r/min离心10 min,取3 mL血清,采用全自动生化分析仪(深圳市新产业生物医学工程股份有限公司,BC 2200)检测2组患者血清总蛋白(total protein,TP)、白蛋白(albumin,ALB)、前白蛋白(prealbumin,PA)水平。
1.4.2 免疫球蛋白 血液采集及血清制备同1.4.1,取3 mL血清用免疫比浊法检测2组患者治疗前、治疗14 d后的血清免疫球蛋白A(immunoglobulin A,IgA)、免疫球蛋白G(immunoglobulin G, IgG)、免疫球蛋白M(immunoglobulin M,IgM)水平,试剂盒购自上海原鑫生物科技有限公司。
1.4.3 T淋巴细胞 血液采集及血清制备同1.4.1,取3 mL血清,采用流式细胞仪(重庆博奥新景医学科技有限公司,Cytonova 2040S)测定2组患者治疗前、治疗14 d后的血清CD3+、CD4+、CD4+/CD8+、CD56+水平。
1.4.4 手术切口愈合时间及并发症发生率 治疗期间观察并记录2组患者手术切口愈合时间及并发症(包括术后切口出血、切口感染等)发生率。
1.5 统计学方法

2 结果
2.1 2组患者营养指标比较
与治疗前比较,治疗14 d后2组患者血清TP水平及观察组血清ALB、PA水平均升高,差异具有统计学意义(P<0.05),且治疗14 d后观察组血清TP、ALB、PA水平均高于对照组,差异具有统计学意义(P<0.05),见表1。
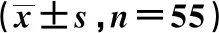
表1 2组患者营养指标比较
2.2 2组患者免疫球蛋白比较
与治疗前比较,治疗14 d观察组患者血清IgG水平升高,且观察组高于对照组,差异均具有统计学意义(P<0.05),见表2。
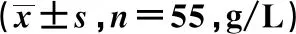
表2 2组患者免疫球蛋白比较
2.3 2组患者T淋巴细胞比较
与治疗前比较,治疗14 d观察组血清CD3+、CD4+、CD4+/CD8+、CD56+水平均升高(P<0.05),且观察组高于对照组(P<0.05),见表3。

表3 2组患者T淋巴细胞比较
2.4 2组患者手术切口愈合时间及并发症发生率比较
治疗期间,观察组手术切口愈合时间短于对照组(P<0.05);2组患者切口感染、切口出血的发生率比较,差异无统计学意义(P>0.05),见表4。
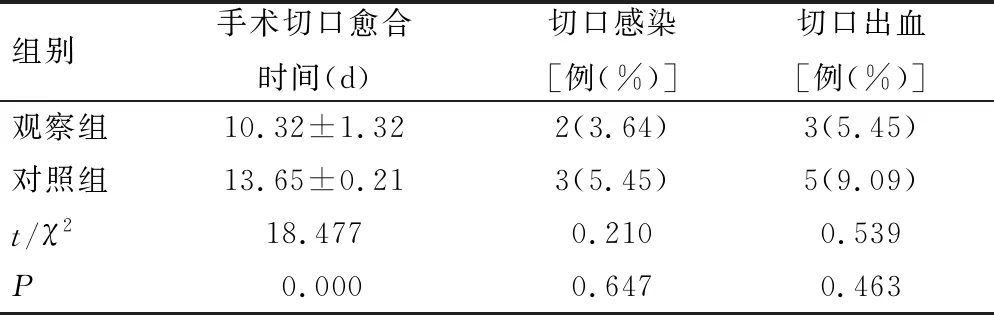
表4 2组患者手术切口愈合时间及并发症发生率比较(n=55)
3 讨论
肺癌根据组织病理学特点可分为非小细胞肺癌及小细胞肺癌,其中非小细胞肺癌占肺癌的大多数。在肺癌的进展期,癌细胞与正常的细胞争抢营养,导致患者营养不足,使患者生理机能及免疫系统受到影响[8]。目前,手术是唯一可能治愈肺癌的治疗方式,但手术会增加机体对蛋白质、脂肪等营养物质的消耗,导致肺癌患者术后营养不足,而化疗药物会导致患者出现胃肠道反应,影响营养物质的摄取,进而严重影响患者的恢复[9]。因此,营养补给对促进肺癌术后化疗患者的恢复极其重要,其中肠内营养治疗能够为患者提供所需的营养物质,但该方式营养需要经过肠道吸收,而化疗患者存在胃肠道反应,容易出现恶心、腹痛、腹胀等不良反应,影响营养支持效果[10]。因此,亟需探寻一种积极有效的治疗手段以提高对肺癌术后化疗患者的临床治疗效果。本研究将肠外营养与肠内营养联合使用,以提升肺癌术后化疗患者营养状况及免疫功能,取得了较好的效果。
由于肺癌本身、术后治疗及化疗等因素,大部分肺癌术后化疗患者存在食欲不振的现象,且部分患者化疗耐受力较差,化疗药物毒性会引起胃肠道反应,增加不良反应的发生风险,肠内营养治疗在提供营养支持的同时可促进胃肠蠕动,对营养物质的吸收更符合生理状态;而肠外营养是一种经过静脉输注营养物质的营养治疗方式,适用于肠道功能较弱、营养吸收较差的肺癌术后化疗患者,能够为其提供有效的营养支持,改善患者营养不良状况,同时提高患者免疫力,进而缩短患者手术切口愈合时间,促进患者恢复[11-12]。本研究结果显示,观察组患者手术切口愈合时间短于对照组,而2组患者切口感染、切口出血的发生率比较差异无统计学意义,进一步证明了肠外营养联合肠内营养治疗能够有效促进肺癌术后化疗患者术后恢复,且安全性好,与既往研究结果一致[13]。
肺癌患者多存在营养恶性消耗、代谢障碍的情况,且手术会导致机体发生一定程度的应激反应,增加对营养物质的消耗;此外,化疗会使患者食欲不振而引起营养不良,并且会破坏患者免疫系统,使患者免疫功能下降,甚至加重免疫抑制状态[14-16]。TP、ALB、PA作为营养相关血液学指标,能够反映机体肝合成储备功能,其水平越高,表示患者营养状况越良好;IgG、CD3+、CD4+、CD4+/CD8+、CD56+均为临床常见的免疫功能指标,其水平下降预示着肺癌术后化疗患者免疫功能损伤加重[17-18]。本研究结果显示,治疗14 d后,观察组血清TP、ALB、PA、IgG、CD3+、CD4+、CD4+/CD8+、CD56+水平均高于对照组,提示肠外营养联合肠内营养治疗能够改善肺癌术后化疗患者的营养状况,提高患者免疫功能。分析其原因可能为肠内营养通过胃肠道为肺癌术后化疗患者提供机体代谢所需的营养物质,符合人体生理,但对于伴有胃肠道反应的患者,肠内营养治疗效果不佳,而肠外营养治疗不经过患者胃肠道,将营养物质通过静脉通道进行输注,可改善患者机体营养状况,而保证营养物质的摄入是维持人体正常免疫功能的基础,营养不足会加重机体免疫功能的损伤[19-20]。
综上,肠外营养联合肠内营养治疗能够有效改善肺癌术后化疗患者的营养状况,进一步提升患者免疫功能,进而提高患者术后恢复效果。但本研究为单中心研究,且样本量较少,可能导致研究结果存在一定偏倚。临床可对肠外营养联合肠内营养在肺癌术后化疗患者中的应用进行多中心研究,以进一步提高研究结果的可靠性及准确度。