基于铂氧化铜负载多壁碳纳米管标记夹心型电化学免疫传感器
孙静波,栾业波,马世花,郑 钊,邢仪雯,张洪静
(1.烟台南山学院 工学院,山东 烟台 265713;2.烟台南山学院 化工学院,山东 烟台 265713;3.航鑫材料科技有限公司,山东 烟台 264006)
乙型肝炎病毒是常见病毒之一,具有广泛的传播性[1]。人血清中乙肝表面抗原(HBs)是一种高特异性、敏感性的(肝)癌标志物,健康人血清中HBs的质量浓度约为25 ng/mL,而肝癌患者血清中HBs的质量浓度明显升高[2]。因此,HBs的灵敏检测对乙肝的早期诊断起着重要作用[3]。目前,已有许多检测HBs的方法,包括时间分辨荧光法[4]、化学发光酶免疫分析[5]、酶联免疫吸附试验[1]和无酶电化学免疫传感器[6]。与这些方法相比,电化学免疫传感器具有检出限低、灵敏度高、操作简便、成本低的优点[7]。因此,制备一种高灵敏电化学免疫传感器用于HBs的检测非常重要。
石墨烯(GS)具有大比表面积、优良机械性能和高电导率,在纳米材料制备中已被广泛应用[8-10]。然而,其在水溶液中的分散性较差,易堆叠。为了提高石墨烯分散性,在完全还原之前将SnO2分子引入到石墨烯中,得到SnO2负载石墨烯(GS-SnO2),SnO2的存在阻断了石墨烯层间的堆叠,同时提高了分散性,增加了石墨烯的结合位点,易于负载大量金纳米颗粒[11]。金纳米颗粒能提高导电性,并具有良好电催化活性[12]。因此,金负载二氧化锡石墨烯(GS-SnO2-Au)是理想的基底材料,可通过金纳米颗粒与—NH2紧密结合固定捕获抗体(Ab1)。
多壁碳纳米管(MWCNTs)作为性能优异的载体材料,因具有较高电导率、良好化学稳定性、大比表面积、高表面/体积比、高机械强度和易于功能化的表面,在电化学分析领域中引起了广泛关注[13]。根据Pietrzak等[14]研究,利用多壁碳纳米管(MWCNTs)和离子液体构建离子选择电极用于硝酸盐的检测[15]。MWCNTs本身对H2O2具有较高催化活性。氧化铜(CuO)作为一种催化剂具有较高的活性和选择性,是目前应用最为广泛的催化剂[16]。而铂电极因具有较高催化活性,被用于过氧化氢的直接检测[17]。
本文以3种材料复合的铂氧化铜负载多壁碳纳米管(Pt@CuO-MWCNTs)作为标记物,GS-SnO2-Au为检测平台,构建了一种夹心型电化学免疫传感器,用于人血清中HBs的定量检测。设计的免疫传感器为检测HBs提供了一个可靠的检测平台,该方法具有较高的电流响应、较宽的线性范围和较低的检出限,可实现对HBs的高灵敏检测,在临床肿瘤标志物筛查、癌症诊断和愈后复发监测方面具有潜在的应用价值。
1 实验部分
1.1 试剂与仪器
HBs抗体、HBs抗原(上海领潮生物科技有限公司);牛血清白蛋白(BSA,96%~99%)、聚二甲基二烯丙基氯化铵(PDDA)购自Sigma公司;GS-SnO2(SnO2含量:50%,石墨烯:500 nm~5 μm)购自先丰纳米科技有限公司;多壁碳纳米管(直径10~20 nm,长度30 μm,纯度>95%)、四氯铂酸钾(K2PtCl4)、乙酸铜(Cu(CH3COO)2·H2O)购自阿拉丁公司。采用1/15 mol/L KH2PO4和1/15 mol/L Na2HPO4制备磷酸缓冲溶液(PBS,pH 7.4)。其他化学品均为分析纯,实验用水为超纯水。
CHI760D电化学工作站(上海辰华仪器有限公司);H-600透射电子显微镜(TEM,日本日立公司)。
1.2 GS-SnO2-Au复合材料的制备
通过一种简单的化学方法合成GS-SnO2-Au复合材料[2]:将50 mL 0.01%的HAuCl4加热至沸腾,加入0.75 mL 1%柠檬酸钠,保持沸腾15 min,冷却至室温,得到金纳米颗粒溶液。将15 mg GS-SnO2分散于20 mL 25%的PDDA溶液中,搅拌30 min,再加入60 mL金纳米颗粒溶液,继续搅拌过夜,得到GS-SnO2-Au黑色悬浮液。采用离心分离、干燥、研磨制得黑色粉末。1 mg黑色粉末经超声波处理后均匀分散于1 mL水溶液中,得到1 mg/mL GS-SnO2-Au溶液。
1.3 Pt@CuO-MWCNTs的制备
将0.5 g MWCNTs加入3.0 mol/L HNO3和2.0 mol/L H2SO4(体积比3∶1)混合溶液中,去除MWCNTs中的金属氧化物,40℃下超声3 h。经过预处理的MWCNTs在室温下冷却,用水冲洗至中性后,在室温下干燥。
将16 mg Cu(CH3COO)2·H2O溶于5 mL水中,搅拌下加入0.1 mL 25%的NH4OH溶液,并将10 mg上述预处理的MWCNTs分散于溶液中,反应17 h,离心分离并洗涤,在70℃真空条件下干燥。最终产物在350℃,N2保护下煅烧3 h得到CuO-MWCNTs复合材料。
采用化学还原法制备Pt@CuO-MWCNTs[18]:将CuO-MWCNTs复合材料分散于5 mL 5 mg/mL的K2PtCl4水溶液中。缓慢加入0.1 mol NaBH4和1 mol NaOH的混合溶液还原Pt盐。在pH 3.2盐酸溶液中,100℃冷凝回流12 h,离心分离洗涤干燥后,得到Pt@CuO-MWCNTs复合材料,35℃真空中干燥12 h。4 mg Pt@CuO-MWCNTs超声分散于1 mL水中备用。
1.4 制备免疫探针Pt@CuO-MWCNTs/Ab2
将2 mg Pt@CuO-MWCNTs加 入1 mL 10 μg/mL的Ab2溶 液中,4℃下 振荡 孵 化12 h,制 得Pt@CuO-MWCNTs/Ab2,4℃下储存备用。
1.5 免疫传感器的构建
夹心型电化学免疫传感器的组装过程如图1所示:依次用1.0、0.3、0.05 μm的Al2O3粉末抛光裸玻碳电极(GCE)。将6 μL 1 mg/mL的GS-SnO2-Au溶液滴至GCE表面并干燥。在电极表面滴加6 μL 10 μg/mL的Ab1溶液,孵化1 h。接着滴加3 μL 1%的BSA溶液至电极,孵化1 h以消除非特异性结合位点。水洗涤后,将6 μL不同浓度的HBs溶液滴至电极,孵化1 h。最后,将6 μL 2 mg/mL的Pt@CuOMWCNTs/Ab2溶液滴加在电极表面完成免疫反应。

图1 铂氧化铜负载多壁碳纳米管免疫传感器的制备Fig.1 The preparation procedures of Pt@CuO-MWCNTs immunosensor
1.6 实际样品预处理及乙肝表面抗原检测
血清样本由医院提供。通过以下步骤对人血清样品进行特殊处理:将人血清样品在4℃下静置24 h去除血细胞和其他血液沉淀物并储存于无菌管中。用PBS(pH 7.4)稀释血清样品至适当浓度,通过制备免疫传感器检测血清样本的上清液。
采用三电极系统进行电化学测量:直径4 mm的GCE为工作电极,饱和甘汞电极为参比电极,铂电极为辅助电极,通过计时电流记录电流响应,检测电压为-0.4 V,测量均在pH 7.4的PBS中进行,磁力搅拌下电流稳定后,用微量注射器向PBS中注入10 μL 5 mmol/L的H2O2溶液,记录电流变化。
2 结果与讨论
2.1 GS-SnO2-Au和Pt@CuO-MWCNTs的表征
分别对GS-SnO2和GS-SnO2-Au进行表征。通过高倍透射电镜表征图可看出SnO2纳米颗粒均匀地镶嵌在石墨烯表面,其晶格间距为0.33 nm,对应金红石相SnO2的生长方向。SnO2纳米粒子的粒径为3~5 nm,其表面带正电荷,可通过物理吸附、静电结合或电荷转移与石墨烯相互结合(图2A)。通过透射电镜图可观察到GS-SnO2的形貌呈明显的二维层状结构,金纳米颗粒大小均匀,且均匀负载在GS-SnO2表面(图2B)。

图2 GS-SnO2的高倍透射电镜(A)及GS-SnO2-Au的透射电镜图(B)Fig.2 HRTEM image of GS-SnO2(A),and TEM image of GS-SnO2-Au(B)
采用相同浓度的MWCNTs、CuO-MWCNTs和Pt@CuO-MWCNTs分别修饰GCE,并在电化学工作站上检测催化H2O2获得的计时电流。如图3A所示,CuO-MWCNTs(曲线b)的催化能力是MWCNTs(曲线a)的20倍,Pt@CuO-MWCNTs(曲线c)是CuO-MWCNTs(曲线b)的2倍,表明Pt@CuO-MWCNTs的催化活性最强。通过TEM进一步观察CuO-MWCNTs和Pt@CuO-MWCNTs的形态(图3B、C),可以观察到CuO纳米颗粒的粒径为15~20 nm,镶嵌在多壁碳纳米管内部,图3C内插图为Pt@CuO-MWCNTs的高倍透射电镜图,可观察到Pt纳米颗粒镶嵌在管壁的外表面。图4为Pt@CuO-MWCNTs的能谱图,图中可明显观察到C、O、Cu、Pt的元素峰,其中元素含量百分比分别为C(81.35%)、O(7.30%)、Cu(9.88%)、Pt(1.47%),研究结果表明,Pt和CuO已负载在MWCNTs上。

图3 MWCNTs(a),CuO-MWCNTs(b)和Pt@CuO-MWCNTs(c)的计时电流图(A);CuO-MWCNTs(B)的透射电镜图;Pt@CuO-MWCNTs的透射电镜图(C)及Pt@CuO-MWCNTs的高倍透射电镜图(D)Fig.3 Amperometric responses of MWCNTs(a),CuO-MWCNTs(b)and Pt@CuO-MWCNTs(c)(A),TEM images of CuO-MWCNTs(B)and Pt@CuO-MWCNTs(C),HRTEM image of Pt@CuO-MWCNTs(D)
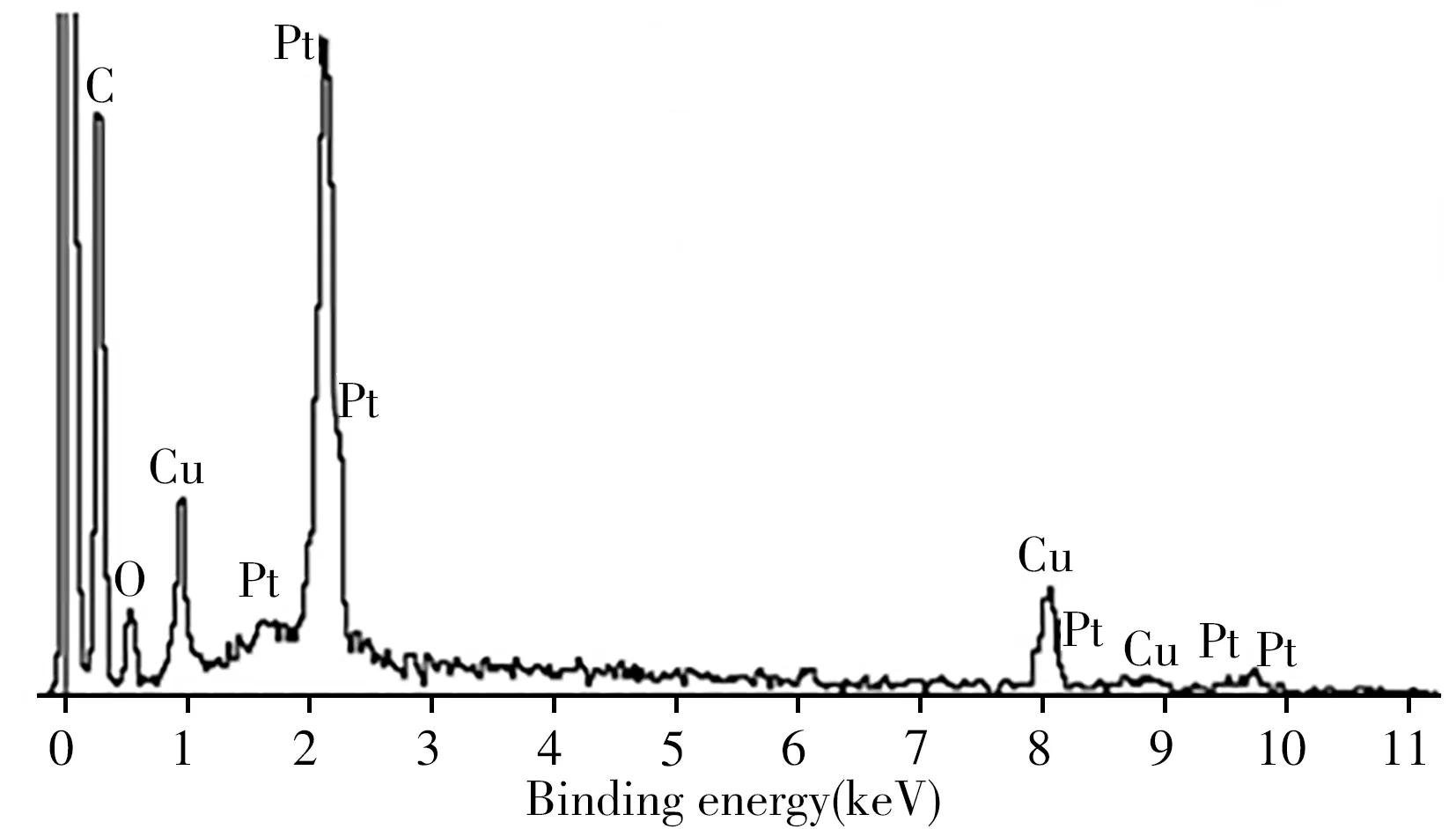
图4 Pt@CuO-MWCNTs的能谱图Fig.4 Energy spectrum of Pt@CuO-MWCNTs
2.2 免疫传感器的表征
以逐层修饰的玻碳电极作为工作电极,在5 mol/L K3[Fe(CN)6]电解液中采用循环伏安法(CV)表征了免疫传感器的组装(如图5A)。首先在GCE(曲线a)上修饰GSSnO2-Au(曲线b),电极的氧化还原峰增强,接着分别在电极表面修饰Ab1(曲线c)、BSA(曲线d)和HBs(曲线e),由于生物活性物质阻碍了电子转移,使得氧化还原峰电流逐渐下降。最后在电极表面修饰Pt@CuO-MWCNTs/Ab2(f),峰电流再次下降,表明免疫传感器已成功构建。
采用电化学阻抗谱法研究了层层修饰电极的电子转移能力,以表征电化学免疫传感器的组装过程。在0.1~105Hz记录交流阻抗谱图,高频区域为半圆,表示电子转移电阻(如图5B)。随着GS-SnO2-Au(曲线b)修饰在GCE(曲线a)上,电阻有所减少,当Ab1(曲线c)、BSA(曲线d)、HBs(曲线e)依次修饰在电极上时,由于大量生物活性物质的叠加阻碍了电子转移,电极的阻抗进一步增大。最后,在电极表面修饰Pt@CuO-MWCNTs/Ab2,Ab2进一步抑制电子转移,基于Pt@CuO-MWCNTs的良好导电性,使电极的阻抗增幅减少(曲线f),表明免疫传感器已成功构建。

图5 免疫传感器构建的循环伏安图(A)及交流阻抗图(B)Fig.5 CV curves(A)and Nyquist diagrams(B)of the immunosensor
2.3 实验条件的优化
为获得最佳的电化学检测信号,对pH值、GS-SnO2-Au及Pt@CuO-MWCNTs质量浓度进行优化。由于强酸(碱)性环境会破坏抗原和抗体的活性,配制了pH 5.0~8.0的系列PBS缓冲溶液。图6A显示,在pH 5.0~7.4范围内,电流信号逐渐上升并达到最大值,之后随pH值的增大其电流信号下降。因此实验选择最佳pH值为7.4。
如图6B所示,在0.5~1.0 mg/mL范围内,随着GS-SnO2-Au质量浓度的增加,Ab1的固载量增加,与抗原免疫结合的探针量增加,进而电流信号也随之增加。但随着GS-SnO2-Au质量浓度从1 mg/mL增加到2 mg/mL时,界面电子转移电阻增大,电流逐渐减小。因此,实验选择GS-SnO2-Au的最佳质量浓度为1 mg/mL。图6C所示,电流信号随Pt@CuO-MWCNTs质量浓度的增加而增加,直至2 mg/mL时达到最大值,当质量浓度超过2 mg/mL时,电流信号减小。因此,实验选择Pt@CuOMWCNTs的最佳质量浓度为2 mg/mL。
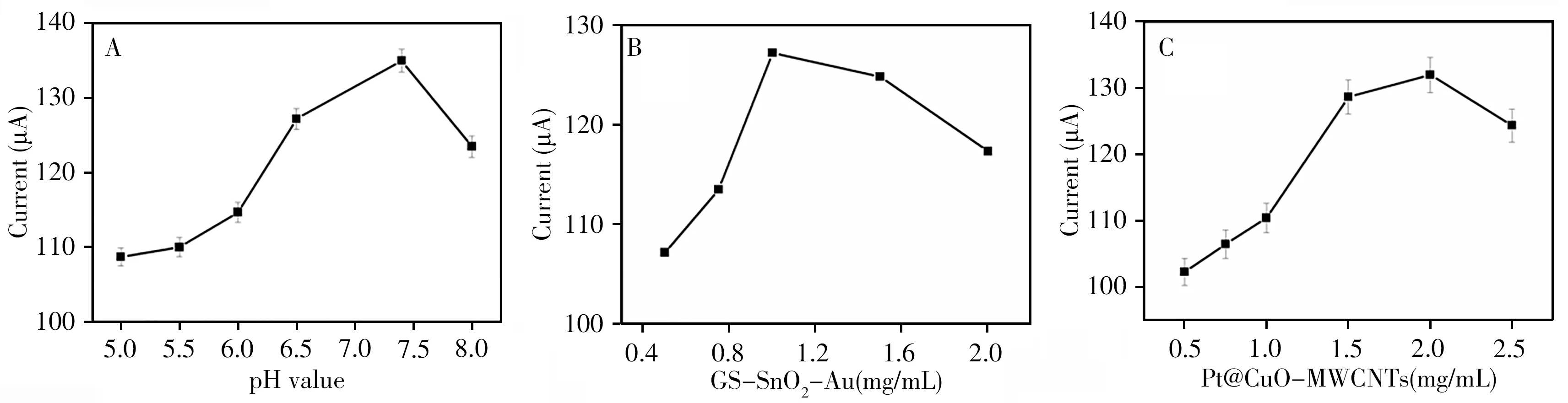
图6 pH值(A),GS-SnO2-Au(B)及Pt@CuO-MWCNTs(C)质量浓度对电流信号的影响Fig.6 Effects of pH value(A),concentration of GS-SnO2-Au(B)and Pt@CuO/MWCNTs(C)on the immunosensor error bar=5%
2.4 免疫传感器检测HBs的工作曲线
在最佳实验条件下,该电化学免疫传感器检测一系列 不 同 质 量 浓 度(0、0.001、0.01、0.1、1、50、100 ng/mL)HBs,图7为获得的计时电流曲线图。结果显示,检测HBs三次注入H2O2引起电流变化的均值(Y)与其质量浓度的对数值(X,ng/mL)呈线性关系,其标准曲线如图7插图,线性方程为Y=127.51+11.14X(r2=0.996 9),线性范围为0.001~100 ng/mL,检出限(S/N=3)为0.33 pg/mL。

图7 系列质量浓度HBs的计时电流曲线图Fig.7 Amperometric I-t current curve of HBs at different concentrations insert:calibration plot between I-t current and the logarithm values of HBs concentrations
2.5 不同方法的比较
将Pt@CuO-MWCNTs免疫传感器与其他检测HBs的免疫传感器进行对比。结果显示,Pt@CuOMWCNTs的多重放大信号作用使得该免疫传感器的检出限明显低于其它方法(见表1),可实现HBs的灵敏检测。

表1 Pt@CuO-MWCNTs免疫传感器与其他电化学传感器的对比Table 1 Comparison of Pt@CuO-MWCNTs immunosensor and the other sensors
2.6 重现性、选择性与稳定性
相同条件下平行制备5支免疫传感器,在最佳实验条件下检测1 ng/mL HBs,测得检测结果的相对标准偏差(RSD)为4.7%,说明该免疫传感器具有较好的重现性。
以癌症胚胎抗原(CEA)、鳞状细胞癌抗原(SCCA)、葡萄糖、维生素C、前列腺蛋白抗原(PSA)和BSA为干扰物,分别测定了1 ng/mL HBs溶液中加入100 ng/mL干扰物的电流信号。结果显示,干扰物引起的电流变化小于无干扰物时电流的5%,说明该免疫传感器的选择性良好。
同一组免疫传感器储存于4℃的PBS中,每隔5 d测量并记录一次电流信号。20 d后,免疫传感器的电流信号变化不大,仍能保持初始电流的95.1%,表明该免疫传感器具有良好的稳定性。
2.7 实际样品的分析
在最佳实验条件下,设计的免疫传感器采用标准加入法检测血清样品中HBs的浓度,并与酶联免疫吸附法(ELISA)进行比较(见表2)。结果表明,该方法的回收率为99.8%~100%,相对标准偏差(RSD,n=5)为1.1%~1.5%,表明该免疫传感器可用于实际样品的检测。

表2 实际样品中HBs的检测Table 2 The detection of HBs in serum sample
3 结论
本文以GS-SnO2-Au为基底,Pt@CuO-MWCNTs为标记物,构建了一种夹心型电化学免疫传感器用于HBs的灵敏检测。GS-SnO2-Au可有效固定捕获抗体,Pt@CuO-MWCNTs的协同放大催化作用提高了检测信号强度,增强了免疫传感器的灵敏度。该方法的检测线性范围宽、检出限低,且重现性、选择性及稳定性良好,具有广阔的应用前景。

