大鲵蛙病毒致病分子机制及免疫防控策略研究进展
刘 品,王文博
( 咸阳师范学院 生命科学系,陕西 咸阳 712000 )
大鲵(Andriasdavidianus),属隐鳃鲵科大鲵属,因其叫声酷似婴儿啼哭俗称“娃娃鱼”,1869年在我国西部首次被发现,为我国独有物种[1]。由于生存环境被破坏、气候变化、人为滥捕滥杀等原因,大鲵曾一度濒临灭绝。20世纪70年代国内开始大鲵的人工繁育与养殖。然而随着大鲵养殖规模扩大,营养搭配不合理以及养殖环境污染等问题频繁出现,大鲵养殖病害问题日益严重。人工养殖大鲵常见疾病包括细菌病、病毒病、寄生虫病等[1],其中,尤以病毒感染最为严重。大鲵感染病毒后发病快,死亡率高,且感染后无特效药物。目前国内报道的造成大鲵病毒性疾病的病毒只有一种,但对其命名尚未统一,有大鲵蛙病毒(Andriasdavidianusranavirus, ADRV;Chinesegiantsalamanderranavirus, CGSRV)、大鲵虹彩病毒(Andriasdavidianusiridovirus, ADIV;Giantsalamanderiridovirus, GSIV)等[2-5]。2010年,耿毅等[2]首次在甘肃陇南和陕西汉中患病大鲵内脏中观察到呈晶格状排列的病毒颗粒,分析发现该病毒主要核衣壳蛋白(MCP)基因与蛙病毒3 MCP基因同源性达96%~99%。之后,中国水产科学院长江水产研究所(以下简称水科院长江所)、中国科学院水生生物研究所(以下简称中科院水生所)和北京动植物检疫研究所等数个研究团队也相继开始关注该病毒。有学者分析全国不同养殖区域患病大鲵的10株病毒流行株的MCP基因,发现其序列相似性达99.7%~100%[6-8],进一步证实中国大鲵蛙病毒流行株属同一基因型。最终确定大鲵蛙病毒为导致大鲵出现皮肤溃疡、四肢肿胀、腐烂等病症的病原。大鲵蛙病毒隶属于虹彩病毒科蛙病毒属(Ranavirus),该属的病毒是一类能够感染多种动物的大型单分子双链DNA病毒,在鱼类、两栖类和爬行类等水生脊椎动物中均能引发流行性传染病[9-10]。近十年来,国内学者陆续开展了对大鲵蛙病毒的形态结构、理化性质、生物学特征、生活周期和致病机理等方面的研究,逐步加深了对该病毒的认识。笔者系统全面地综述了近十年来在大鲵蛙病毒的致病机理、组学研究与功能基因分析、宿主抗病毒免疫功能基因分析、分子检测和免疫防控技术等方面的研究进展,以期为大鲵病毒性疾病的防治提供参考。
1 大鲵蛙病毒感染致病的细胞基础
1.1 大鲵蛙病毒细胞培养特性

在大鲵蛙病毒感染机制方面,已开展广泛研究。2014年,Ma等[12]首次报道了大鲵蛙病毒在鲤上皮瘤细胞系中的形态发生过程。与其他病毒侵染细胞方式类似,大鲵蛙病毒感染1 h后通过膜融合方式进入细胞内,6 h后开始增殖,72 h后进入平台期;感染末期,病毒衣壳逐渐成熟并形成典型的二十面体结构,于病毒基质处聚集成假晶体阵列,最终通过出芽方式释放[12]。大鲵蛙病毒也能在大鲵脾脏细胞中增殖,但大鲵蛙病毒感染后出现细胞病变的时间与在鲤上皮瘤细胞中相比要晚,鲤上皮瘤细胞感染病毒24 h即出现细胞病变,而大鲵脾脏细胞感染后36 h才出现细胞病变[13]。随后,中科院水生所建立了大鲵的胸腺细胞系、脾细胞系和肾细胞系,并进一步比较了大鲵蛙病毒对3种细胞的侵染情况,发现大鲵胸腺细胞系对该病毒最敏感,侵染24 h即出现细胞病变,而在大鲵脾细胞系和肾细胞系中,病毒侵染36 h后才出现细胞病变[14]。雷存科等[15]比较了大鲵蛙病毒对爪蟾(Xenopus)肾细胞系、大鲵胸腺细胞系和鲤上皮瘤细胞系的敏感性,同样发现大鲵胸腺细胞系对病毒更为敏感,相比于爪蟾肾细胞系和鲤上皮瘤细胞系,病毒在大鲵胸腺细胞系中细胞病变速度要更快且明显。此外,在大鲵肌细胞中研究发现,大鲵蛙病毒感染后36 h才开始出现细胞病变[16]。说明大鲵蛙病毒对大鲵不同组织细胞敏感性存在差异。近来,有报道指出,大鲵蛙病毒能在人胚肾细胞内顺利完成其生活周期,产生具感染力的完整子代病毒,但感染后细胞出现病变时间较晚(72 h)[17]。以上研究结果表明,大鲵蛙病毒对于不同来源及不同组织源细胞敏感性存在差异,整体来看大鲵蛙病毒更易侵染大鲵胸腺细胞系。除此之外,水科院长江所开发出规模化培养大鲵肌细胞和大鲵蛙病毒的方法——Cytodex 3微载体悬浮培养系统,这将为大鲵蛙病毒疫苗的规模化生产奠定基础[16]。
1.2 大鲵蛙病毒诱导细胞凋亡的机制
为维持内环境稳定,细胞会产生由基因调控的自主、有序的死亡,其中涉及多种细胞因子和调控机制,是多细胞生物生命过程中重要的生理或病理现象,常见的有细胞凋亡、自噬等[18]。病毒可以利用这一过程产生更多的子代病毒或利于自身的释放,宿主细胞也可利用细胞凋亡和自噬过程阻止病毒的扩增和传播[19]。此外,在病毒感染过程中还存在细胞坏死性凋亡、焦亡等细胞非典型程序性死亡方式[20-21],可见病毒与宿主细胞之间的关系复杂而多样。在水产动物中,诱导靶器官的细胞死亡是蛙病毒属病毒重要的致病机制之一[22-23]。有研究指出,大鲵蛙病毒能在病灶细胞中引起细胞坏死,导致多个器官功能障碍,同时部分损伤细胞呈现出细胞凋亡的形态特点,如核浓缩、边集等。说明大鲵蛙病毒在感染细胞过程中亦可能通过诱导细胞凋亡的方式引起细胞坏死,最终导致机体器官功能受损[24-26]。为深入探究大鲵蛙病毒致病机制,Du等[27]利用超薄切片技术,在未表现症状的染毒大鲵的肝、脾和肾脏组织细胞中发现细胞内出现与自噬有关的囊泡以及凋亡小体。在培养的鲤上皮瘤细胞系中亦印证了这一点,大鲵蛙病毒侵染鲤上皮瘤细胞后,核内出现典型的染色质边集和染色质浓缩形成凋亡小体的现象,与此对应的细胞凋亡率和线粒体膜电位崩解率显著升高,表明大鲵蛙病毒可能通过内源性线粒体途径诱导鲤上皮瘤细胞凋亡[28]。但该研究并未阐明病毒通过该通路中哪些效应因子发挥促凋亡的作用。为明确大鲵蛙病毒诱导细胞凋亡的机制,Li等[29]利用大鲵肌细胞系开展了相关研究,结果显示:大鲵蛙病毒感染期间,参与细胞外源性凋亡途径的AdFas和AdTNFR1基因的表达显著上调,半胱氨酸蛋白酶8的活性显著增加,说明大鲵蛙病毒感染期间大鲵肌细胞外源凋亡途径的半胱氨酸蛋白酶级联反应被激活;另外,细胞线粒体膜电位在感染期间显著降低,并且在细胞质中可检测到细胞色素c,半胱氨酸蛋白酶9活性也显著增加,说明大鲵蛙病毒感染后也可激活线粒体依赖性的细胞内源性凋亡途径。近来,Li等[30]又明确了一个连接外源性和内源性凋亡通路的基因——Bid基因,其在大鲵蛙病毒感染的大鲵肌肉、肾脏和脾脏中的表达水平均显著升高,且在大鲵肌肉细胞系中过表达Bid基因后细胞凋亡过程明显增强,胞内大鲵蛙病毒MCP的转录水平和蛋白水平也都显著升高,揭示Bid基因在大鲵蛙病毒诱导的细胞凋亡和病毒复制中起到了积极的作用。综上可知,在大鲵中外源性和内源性促凋亡途径可能都参与了大鲵蛙病毒诱导的细胞凋亡过程。
2 大鲵蛙病毒组学研究
2.1 大鲵蛙病毒的基因组学研究
为了进一步研究蛙病毒属病毒的基因功能和感染机制,研究者运用转录组学和蛋白组学技术分析了该属病毒的基因转录和表达。目前,自鱼类、两栖动物和爬行动物中分离出的多种蛙病毒已被完全测序。比较分析蛙病毒基因组序列发现,从两栖动物中分离的蛙病毒具有高度的基因组序列共线性[5,31]。大鲵蛙病毒基因组学研究起步较晚,2013年中科院水生所率先测定了大鲵蛙病毒的全基因序列(登录号:KC865735),并根据20株完全测序的虹彩病毒26个核心蛋白基因序列构建了系统发育树(图1[5]),从进化关系上来看,大鲵蛙病毒与蛙病毒3相似性最高[5]。大鲵蛙病毒基因组全长约为106 734 kb,GC含量为55%,包含101个开放阅读框,分别编码44~1294个氨基酸的蛋白质,其中包括26个病毒核心基因、24个蛙病毒特有基因和40个未知基因[5]。与其他两栖类蛙病毒相比,大鲵蛙病毒基因组发生了显著的变异,包括片段倒置、片段插入和缺失[5]。不同蛙病毒分离株之间的片段倒置反映出病毒的高重组率,而基因组重排则会由于某些基因的破坏或添加而产生新的更具致病性的病毒株[32]。在大鲵蛙病毒中有3类与毒力相关的基因发生了变异:第1类是与病毒复制和发病机制相关的US22家族中的6R和49L基因;第2类是vIF2α基因,在大鲵蛙病毒中vIF2α的2个功能域只在C末端区域残留69和76个氨基酸,vIF2α可阻断宿主细胞双链RNA依赖的蛋白质激酶的抗病毒作用;第3类是变异的75L基因,在大鲵蛙病毒中75L同时包含完整的NLS和NES序列,而在其他几种蛙病毒的同源序列中则仅含有NES序列或不完整的NLS序列[5,33-34]。NLS对病毒核蛋白的输入和输出、病毒蛋白的合成具有重要作用[35]。研究者认为,大鲵蛙病毒的75L基因可能参与病毒蛋白的合成和转运,推测其可能是强毒性基因[5]。同一时期另外两个研究团队也对大鲵蛙病毒进行了全基因序列的测定(登录号KF512820和KF033124),测序结果与Chen等[5]测序结果基本一致[36-37]。
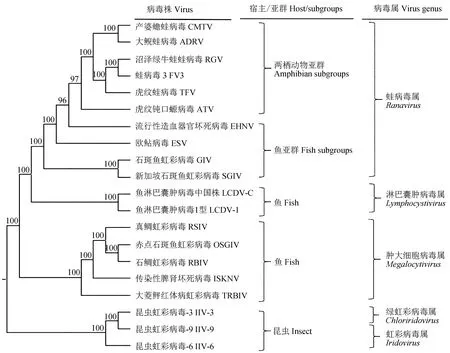
图1 20株虹彩病毒核心蛋白序列构建的系统发育树[5]Fig.1 Phylogenetic tree of core protein sequences from 20 iridoviruses[5]
2.2 大鲵蛙病毒蛋白质组学研究
病毒结构蛋白在病毒生物过程中发挥着至关重要的作用,包括病毒颗粒的结构形成、病毒与宿主的互作、病毒感染的初始步骤、病毒基因的转录和宿主转移等[38]。蛋白质组学技术可以对基因表达进行识别、分析,并鉴定蛋白质的功能及作用模式。当前,已有研究者运用一维或二维聚丙烯酰胺凝胶电泳、肽质量指纹图谱、MALDI质谱分析、液—质联用等蛋白质组学技术对包括大鲵蛙病毒在内的蛙病毒成员进行了蛋白质组学研究[36,39-40]。通过分析病毒在感染宿主细胞过程中其蛋白表达的变化,研究病毒蛋白的功能,可以加深对蛙病毒生物学过程的理解。Li等[36]首次通过液相—质谱联用技术从纯化的大鲵蛙病毒颗粒中检测到40种病毒相关病毒蛋白,其中包括15个核心病毒蛋白。为进一步分析这些蛋白,该研究团队通过反转录PCR确认了这些基因,结合药物抑制试验发现37个分时期表达蛋白,即5个立即早期基因(IE),12个延迟早期基因(E)和20个晚期基因(L),与其他虹彩病毒相比,这些基因序列比较保守,但是基因的表达时间会有些差异。此外,在大鲵蛙病毒中还发现几个与其他虹彩病毒同源的包膜蛋白(ORF002L、ORF060R和095L),这些蛋白与病毒粒子组装和病毒感染有关[36,38,41]。袁江迪等[42]通过凝胶电泳分析了正常大鲵和感染大鲵蛙病毒大鲵的血清蛋白和黏液蛋白,证实了大鲵感染大鲵蛙病毒后大鲵血清和黏液蛋白组分会出现显著不同。水生动物体表黏液和血清中蛋白作用众多,可保护机体免受病原体损伤与侵染等发挥免疫保护作用[43]。当前通过分析黏液蛋白与血清中的蛋白组分以评估机体生理生化状况或某些疾病的研究较广泛。
3 大鲵抗病毒免疫相关基因的鉴定和功能研究
3.1 大鲵感染大鲵蛙病毒后转录组测序分析
转录组测序是利用新一代测序技术进行转录组分析的技术,可以全面快速获得特定细胞或组织在某一生理状态下信使RNA、核糖体RNA、转运RNA及非编码RNA的序列信息和表达信息。目前大鲵转录组测序分析方面已开展了大量工作[44-50],其中不乏针对大鲵感染病毒后宿主的先天性免疫、体液免疫和细胞免疫应答机制等方面的转录组学研究,筛选出众多大鲵抗病毒免疫相关的信号通路与基因信息[44,46,49-50]。早在2014年,中科院水生所构建了大鲵感染大鲵蛙病毒后胸腺的cDNA文库,通过表达序列标签(EST)分析获得137个可能的免疫相关基因,重点分析了免疫球蛋白重链(IgM、IgY和IgD)、IFN诱导蛋白6(IFI6)和T细胞受体β链(TCR β)的结构特征和表达谱,为大鲵抗病毒免疫的分子机制提供了重要信息[44]。该研究首次在大鲵中发现特殊形式的IgY和IFI6基因,以及含有铰链的IgD区,这些变化之前在其他两栖动物中均未发现[44]。这种特殊形式的IgY可在不引发炎症反应的情况下中和病原体[51]。而IFI6基因属于FAM14家族,有报道指出,该家族成员可能参与病毒感染过程中线粒体介导的细胞凋亡[52]。2015年,水科院长江所采用Solexa测序和Trinity 转录组测序组装技术分析了感染大鲵蛙病毒的大鲵脾脏,发现部分差异表达基因涉及免疫反应相关的信号通路,如Toll样受体(TLR)、NACHT-LRR受体(NLR)和RIG-I样受体(RLR)介导的信号转导系统,推测病毒感染会引起大鲵脾脏中免疫相关信号通路的应答[46]。该研究还发现,感染病毒后大鲵先天免疫中补体系统相关基因表达发生变化,推测病毒感染可能引发大鲵脾脏补体系统原发性免疫缺陷[46]。近来,为了解大鲵感染不同病毒后的宿主应答的差异,Ke等[50]采用转录组测序技术比较了大鲵感染大鲵蛙病毒和沼泽绿牛蛙虹彩病毒(RGV)后其脾脏的基因表达情况,发现感染初期种间病原体(沼泽绿牛蛙虹彩病毒)的复制速度要显著快于自然病原体(大鲵蛙病毒)。说明两种病毒侵染宿主后增殖模式不同,引起的宿主免疫应答反应也不尽相同,最终两种病毒侵染结果也出现差异。综上可知,对大鲵转录组学的分析主要集中于从不同角度分析大鲵与病毒之间的互作关系,为病毒入侵大鲵的致病机制提供了重要资料。
微小RNA(miRNA)是长度约为22个核苷酸的小型非编码RNA,通过与特定的mRNA靶位点结合,导致靶标mRNA降解或翻译抑制,从而在靶基因表达中发挥至关重要的调节作用。近来有研究发现,miRNA在机体病原微生物感染后的防御过程中发挥重要作用[53]。miRNA介导的宿主—病原体相互作用的研究已成为免疫系统研究的热点。在生物或非生物胁迫下运用高通量测序技术可以识别大量已知miRNAs和特异性miRNAs[54-56]。有报道指出,病毒编码的miRNA可能参与了病毒免疫逃逸过程[56]。大鲵感染大鲵蛙病毒后其脾脏相关的miRNA表达模式会发生变化,共发现82个下调和9个上调的差异表达miRNA,它们在大鲵蛙病毒感染引起的非特异性免疫以及适应性免疫应答中发挥重要的调节作用[49]。当前,识别大鲵中与免疫相关的miRNAs并对其功能进行解析,将为深入了解大鲵抵抗大鲵蛙病毒入侵机制提供依据。
3.2 大鲵抗病毒免疫相关基因的筛选和功能分析
免疫应答是病原体相关分子模式(PAMPs)被机体细胞膜上的PAMPs识别受体(PRR)识别,引起级联反应并诱导机体分泌多种可溶性介质抵御病原感染的过程[57]。现已发现多种识别不同病毒的PRR,如TLR家族、NLR家族、RLR家族、PYHIN家族和NOD家族等[58]。目前大鲵的模式识别受体已有报道,包含能够识别病毒或者细菌的核苷酸衍生物的TLR7、半乳糖凝集素家族(Galectin)、识别各种病原体基序的细胞质螺旋酶维甲酸诱导基因Ⅰ(RIG-Ⅰ)和黑色素瘤分化相关蛋白5(MDA5)等[59-62]。Galectin参与识别并结合病原微生物表面配体,大鲵感染大鲵蛙病毒后多个组织Galectin家族基因的表达量变化显著,推测Galectin家族参与了大鲵抗病毒免疫调节[59]。RIG-Ⅰ和MDA5在结构上比较相似,且均在先天性抗病毒免疫及相关的信号通路中发挥作用[63-64]。与其他生物感染病毒后的机体反应类似,大鲵蛙病毒也能引起大鲵肾脏和脾脏的模式识别受体如TLR7、RIG-Ⅰ和MDA5的表达,但只在脾脏内的接头分子髓样细胞分化因子88(MyD88)被激活[60-62]。基于Solexa测序技术,Fan等[46]研究发现,大鲵感染病毒后脾脏有513个基因表现出差异,其中大量基因涉及TLR、NLR和RLR模式受体介导的信号通路,但是在转录水平中只有33个基因呈现出显著差异。大鲵蛙病毒如何刺激大鲵细胞内模式识别受体并引起一系列的分子事件目前尚未明确,有待进一步研究。
病毒感染机体后,模式识别受体与相应配体结合,迅速激活细胞内的接头分子,如MyD88、干扰素刺激基因(ISG)等,将信号传递到胞内,这些分子可活化核因子κB(NF-κB)和干扰素调节因子3(IRF3),进而诱导干扰素和炎性细胞因子的表达,最终激活机体的抗病毒防御机制,抑制病毒的侵染和复制[65]。NF-κB信号通路在机体的免疫应答、细胞凋亡及应激反应等过程发挥重要的调控作用[66]。目前,大鲵已有多个与病毒侵染后免疫应答相关的转录因子被克隆鉴定分析(表1)。Chen等[67]克隆并鉴定了大鲵Ⅰ型干扰素(ⅠIFN)基因。干扰素可诱导编码抗病毒蛋白的ISG的表达,它们通过JAK/STAT信号通路在宿主针对病毒和细菌感染的先天免疫应答中起主要作用[68]。感染病毒后,大鲵外周血白细胞Ⅰ IFN基因表达水平显著升高,而在大鲵肌细胞过表达Ⅰ IFN基因后,病毒载量和滴数均明显降低,Ⅰ IFN诱导型基因—抗病毒蛋白(Mx)基因的表达也显著上调[67]。Mx在脊椎动物和无脊椎动物中高度保守,是由Ⅰ IFN诱导,可在病毒感染期间与其他IFN诱发蛋白一起抵抗病毒入侵[69]。大鲵感染病毒后,其肾脏、脾脏和肌肉等组织中的Mx基因表达水平显着升高;而在大鲵肌肉细胞过表达Mx基因后再进行病毒侵染,细胞中病毒载量、基因表达量和MCP合成水平都有所降低:可见Mx在大鲵对病毒的免疫反应中也起着重要的抗病毒作用[70]。近来,大鲵上又有IRF3、白介素18(IL-18)和肿瘤坏死因子受体相关因子3(TRAF3)等免疫相关基因被相继鉴定分析[71-73]。研究证实IRF3在病毒感染后可激活IFN和ISGs的表达,病毒诱导的IRF3磷酸化后从胞质易位至核,刺激IFN-1和其他IFN诱导的基因的转录,引起细胞的抗病毒相关基因的表达[74]。感染大鲵蛙病毒后,大鲵脾脏的IRF3基因表达升高,而沉默IRF3基因后,病毒侵染造成的ISG基因表达则受到抑制[71],说明IRF3在病毒诱导的大鲵抗病毒免疫反应中发挥作用。IL-18由激活的免疫细胞产生,可与胞内接头蛋白MyD88互作并激活NF-κB和MAKP信号转导系统,诱导下游基因如TNF-α和IFN-γ等的表达,进而引发机体的免疫应答[75]。大鲵白细胞沉默IL-18基因后再感染病毒,其NF-κB和4种促炎细胞因子(IL-1β,IL-6,TNF-α和IFN-γ)的表达受到抑制;而用重组IL-18蛋白处理白细胞后,NF-κB和4种促炎细胞因子则被明显诱导,这意味着大鲵IL-18s参与触发NF-κB信号传导和促炎反应[72]。TRAF3是一种信号转导蛋白,在细胞中主要功能是连接上游受体信号和下游抗病毒信号。大鲵血液和脾脏TRAF3均能对大鲵蛙病毒的侵染作出应答,沉默大鲵吞噬细胞TRAF3基因后,可显著抑制IFN信号通路相关基因的表达;在鲤上皮瘤细胞中过表达TRAF3基因后,可激活IFN-β启动子并活化NF-κB:这表明TRAF3基因在大鲵天然抗病毒免疫中起着关键调节作用[73]。
综上所述,目前已发现多个模式识别受体及下游相关转录因子参与了大鲵感染大鲵蛙病毒后免疫应答,涉及NF-κB、MAPK、ERK和IFN等众多信号通路,但确切的分子机制仍有待进一步研究。
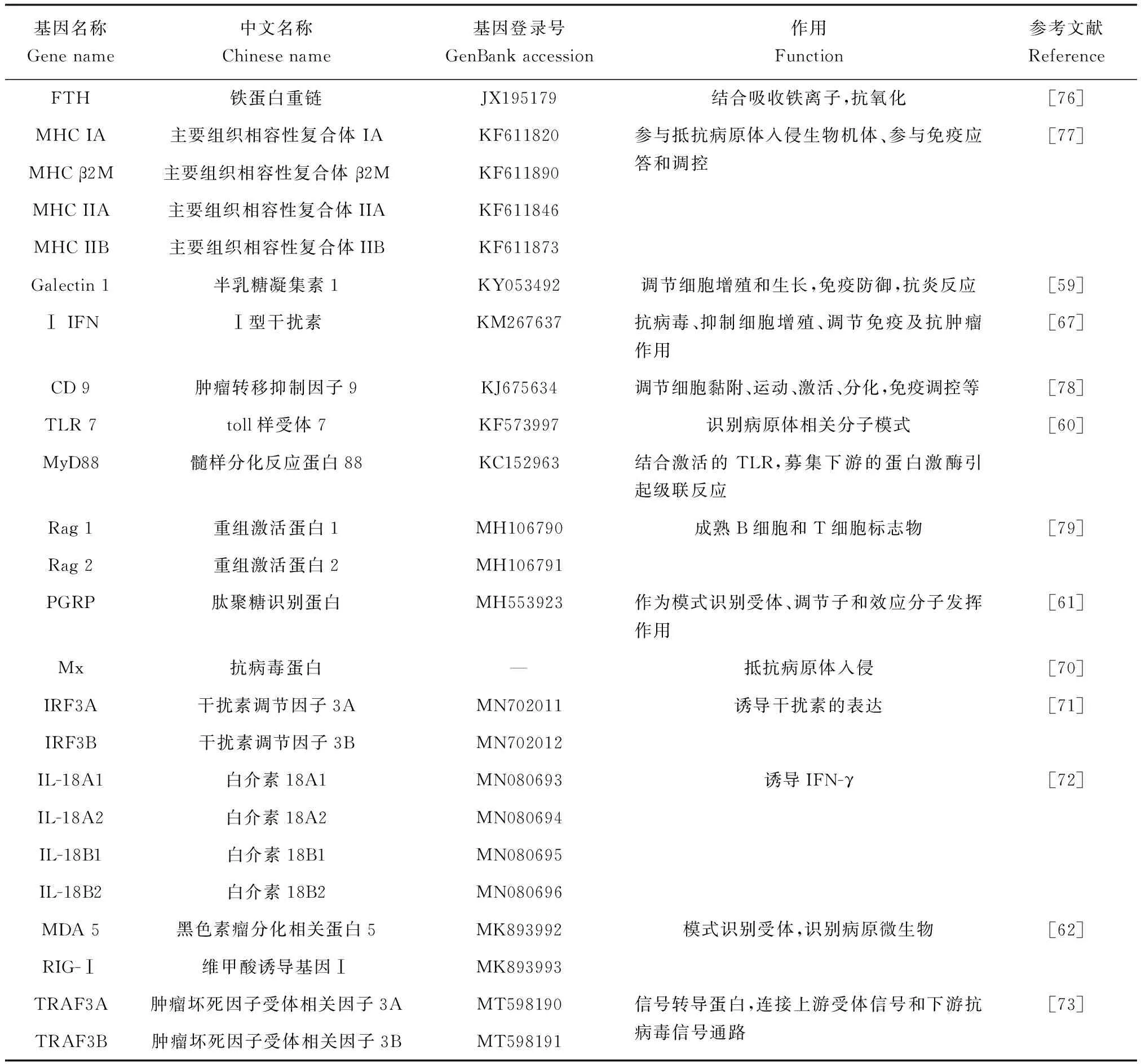
表1 大鲵免疫相关基因
4 大鲵蛙病毒免疫防控的研究
在水生动物中,免疫防控是防控传染性疾病最有效的途径之一,其中注射疫苗、口服疫苗等方式在养殖生产中应用较多[80-82]。与鱼类和其他两栖类相比,中国大鲵免疫防控等方面的研究起步较晚,尚未有针对性药物用于防控大鲵蛙病毒引起的疾病。因此,开发疫苗成为预防水生动物病毒性疾病最为有效的方法。
4.1 灭活疫苗
灭活病毒疫苗主要通过物理或化学方法,将具有感染性的病毒杀死使其失去致病力,但仍保持其抗原性。目前,应用最为普遍且安全的就是灭活疫苗。这类疫苗开发周期短且安全性较好,但该类疫苗只能诱导机体体液免疫,防护时间短并需要适当的免疫佐剂配合使用。在大鲵蛙病毒灭活疫苗研究方面,已开展了大量研究工作。2013年,孙建滨等[83]首次利用β-丙内酯和福尔马林灭活大鲵蛙病毒制作疫苗,发现两种方法制作的灭活疫苗对大鲵的免疫保护率分别为83.3%和72.2%,在注射疫苗7 d后即可检测到抗体,21 d时抗体效价分别达到1∶320和1∶287。众所周知,佐剂不在体内产生免疫记忆,但可在短时间内提高机体的免疫应答水平,进而提高机体的抗病力。大鲵蛙病毒灭活疫苗研究中,研究者也关注到免疫佐剂对疫苗的免疫效果的提高。刘文枝等[84]评估了β-丙内酯灭活大鲵蛙病毒疫苗免疫效果的同时还对两种免疫佐剂的使用效果进行研究,结果显示:该灭活疫苗在免疫早期即可诱导大鲵非特异性免疫,促进大鲵免疫应答相关基因如TLR9和MyD88表达;两种免疫佐剂铅胶和弗氏完全佐剂相对免疫保护率分别为84%和90%。另外,邓绿洲等[85]发现,黄茋多糖和ISA763A两种佐剂都能提高β-丙内酯灭活大鲵蛙病毒疫苗的免疫效应,其相对免疫保护率分别为71.43%和85.71%,大鲵免疫水平和免疫相关基因的表达水平均提高。近来,索钰杰等[86]针对β-丙内酯灭活的大鲵蛙病毒疫苗的安全性和免疫效力进行了系统性研究,进一步明确了最佳免疫方式和疫苗免疫剂量。
4.2 DNA疫苗
DNA疫苗也称核酸疫苗或基因疫苗,是利用基因工程技术将抗原基因重组到真核表达载体,而后直接注入生物体内诱导机体产生免疫应答的新型疫苗。已有研究证实,DNA疫苗对虹彩病毒科的红鲷虹彩病毒、新加坡石斑虹彩病毒和传染性脾肾坏死病毒有效,免疫保护率可分别达到71.4%、66.7%和80.0%[87-89]。曾宪辉等[90]将大鲵蛙病毒中MCP基因克隆到真核表达载体中表达,首次制作出大鲵蛙病毒的DNA疫苗,免疫大鲵后可诱导细胞免疫并产生特异性抗体,免疫保护率可达73.3%。随后,又有研究者构建了含有大鲵蛙病毒 2L(pcDNA-2L)基因和58L(pcDNA-58L)基因的DNA疫苗,但接种pcDNA-2L的大鲵相对存活率(66.7%)显著高于接种pcDNA-58L的大鲵(3.3%),在接种pcDNA-2L后14 d和21 d的大鲵体内还可检测到大鲵蛙病毒的特异性抗体[91]。DNA疫苗对病毒的免疫保护率变化较大,一方面与病毒种类有关,另一方面与选择的病毒基因有关。选做疫苗的病毒DNA片段一般都是病毒的重要结构蛋白的基因序列,这些结构蛋白作为抗原的免疫效果存在差异,相应地对机体的免疫系统的激活效果也不同,最终出现不同的保护效率。
4.3 重组疫苗
重组疫苗是通过遗传学重组机制来生产的疫苗,主要有两大类:一类是重组亚单位疫苗,通过重组DNA技术将病毒表面抗原在细菌或细胞培养物中表达,获得所需的抗原制备疫苗;一类是重组活载体疫苗,通过改变已知病毒致病基因制备疫苗,或者是将致病病毒关键基因插入到非致病微生物上制备疫苗。彩虹病毒的MCP占总多肽的40%~45%,在诱导抗病毒免疫反应中起重要作用,因此在制作疫苗时中也多以重组MCP作为抗原生产疫苗[92-93]。已有研究者分别运用两种方式制作出针对大鲵蛙病毒的重组疫苗。2015年,水科院长江所Zhou等[92]根据酵母密码子偏好性优化大鲵蛙病毒的MCP基因序列后,通过重组技术利用酵母表达了MCP,将蛋白纯化后免疫大鲵,其相对保护率可达78%。而后Zhou等[93]通过将大鲵蛙病毒的MCP基因重组到杆状病毒基因组,制成了大鲵蛙病毒的重组活载体疫苗—重组杆状病毒疫苗,将其免疫大鲵后获得84%的相对保护率。比较而言,重组疫苗安全性要高于其他种类疫苗,但易受到载体系统的影响。两种方式获得的重组疫苗对大鲵的保护率均较高,可以作为大鲵蛙病毒的候选疫苗,但仍需对疫苗的安全性与免疫效力开展系统性研究。
5 展 望
迄今为止,人们已在大鲵蛙病毒的分离与纯化、理化性质、检测技术、感染致病分子机制、基因组学、蛋白组学以及免疫防控等多方面开展了研究,对于明确大鲵蛙病毒的生物学特性、感染机制、快速准确检测与免疫防治有重要的意义。未来还需要从以下方面开展研究工作:(1)要加快研发有效抗大鲵蛙病毒药物,特别是在中草药制剂方面。当前中草药在水生动物疾病的预防与控制方面研究日益增多,已有研究证实,中草药对大鲵细菌性疾病的防护作用[94-95],并且中草药提取物还可作为免疫佐剂增强大鲵蛙病毒疫苗免疫效果[85],利用中草药及相关制剂增强大鲵免疫应答反应的研究尚少,中草药制剂的研发也应该成为大鲵蛙病毒防治研究的重要方向;(2)要加深大鲵蛙病毒功能基因方面的研究。相比于蛙病毒属的其他病毒,大鲵蛙病毒发现较晚,其基因转录与蛋白表达研究尚浅,阐明病毒基因的功能可洞悉病毒更深层次的致病机制;(3)要深化RNA干扰、基因编辑等基因工程技术在抗大鲵蛙病毒方面的应用,该类技术已广泛应用于病毒感染治疗领域,在抗大鲵蛙病毒研究方面[96-97]也取得了初步进展,基因工程技术优势突出,发展前景广阔,可为大鲵蛙病毒防治开辟新的方向;(4)继续开展病毒与宿主互作机制研究。当前,已有大量关于大鲵应答病毒感染相关基因的研究,但研究层次尚属起步,多数集中在克隆获得其核酸序列以及分析病毒感染后基因的表达变化等方面,今后还要进一步结合细胞分子生物学、基因组学、蛋白组学和生物化学等技术手段,阐明宿主对病毒侵染的代谢免疫调控机制、病毒调控与利用宿主代谢机制,深入揭示大鲵蛙病毒与宿主互作的分子机制。

