微囊藻毒素对凡纳滨对虾肝胰腺氧化损伤研究
黄兰英,张达娟,张树林,毕相东,戴 伟
( 天津农学院 水产学院,天津市水产生态及养殖重点实验室,天津 300384 )
凡纳滨对虾(Litopenaeusvannamei)因繁殖力强、成活率高、生长周期短、抗逆性强等优点,自引入我国后迅速成为重要的水产养殖种类之一。高密度集约化的池塘精养是凡纳滨对虾的普遍养殖模式,由于养殖密度高、人工饵料投入量大、养殖水体富营养化水平高等问题,常引起藻类尤其是蓝藻的异常繁殖,从而产生以微囊藻(Microcystis)、鱼腥藻(Anabaena)为主的蓝藻水华并释放微囊藻毒素(MCs)[1-2]。微囊藻毒素是微囊藻属、鱼腥藻属等蓝藻产生的次级代谢产物,通过多种途径发挥其毒性效应[3-5],对动物及人体各器官具有损害作用[6-8]。
微囊藻毒素具有上百种异构体,其中以微囊藻毒素-LR型毒性最强、分布范围最广[9]。微囊藻毒素具有嗜肝性[10-11],通过不同途径被吸收进入动物机体后主要蓄积在肝胰腺[12],而肝胰腺作为重要免疫器官,与机体免疫功能息息相关[13]。诱导氧化应激是微囊藻毒素的毒性作用机理之一[14]。研究发现,微囊藻毒素进入机体后能诱导活性氧的产生[15-16],细胞内活性氧自由基能攻击生物膜磷脂中的多不饱和脂肪酸,产生脂质过氧化反应,导致丙二醛等氧化脂质含量升高[17]及相关抗氧化酶活性变化[18]。微囊藻毒素对水生动物肝胰腺具有氧化损伤作用。隗黎丽等[19]研究草鱼(Ctenopharygodonidella)幼鱼肝脏抗氧化系统对微囊藻毒素胁迫响应时发现,超氧化物歧化酶和过氧化氢酶在高剂量微囊藻毒素诱导下活性均先升后降;鲤(Cyprinuscarpio)暴露在微囊藻毒素中,其肝细胞超氧化物歧化酶、过氧化氢酶、谷胱甘肽过氧化物酶活性显著增加[20];张口蟹(Chasmagnathusgranulatus)在注射铜绿微囊藻(M.aeruginosa)提取物7 d后,肝胰腺过氧化氢酶活性显著升高[21];银汉鱼(Odontestheshatcheri)在摄食有毒微囊藻后,其肝脏过氧化氢酶、谷胱甘肽硫转移酶活性及丙二醛含量增加[22]。此外,微囊藻毒素对Corydoraspaleatus[23]、斑马鱼(Daniorerio)[24]等鱼类肝脏的抗氧化酶活性均具有诱导作用。Gonçalves-Soares等[25]报道,凡纳滨对虾经微囊藻毒素注射处理后,体内过氧化氢酶活性和相应的基因表达量呈现上升趋势;陈妍妍[26]发现,微囊藻毒素亚慢性染毒凡纳滨对虾后,超氧化物歧化酶、谷胱甘肽过氧化物酶基因表达水平随微囊藻毒素浓度升高而显著上调。大量研究表明,微囊藻毒素能诱导机体产生过氧化反应,提高抗氧化酶活性以抵抗氧化应激作用。微囊藻毒素对水生动物免疫酶活性影响的研究主要集中在微囊藻毒素对鱼类抗氧化系统影响方面,在微囊藻毒素对凡纳滨对虾氧化损伤及抗氧化系统影响方面的研究较少。笔者以微囊藻毒素对凡纳滨对虾直接进行血窦注射,检测其肝胰腺超氧化物歧化酶、谷胱甘肽过氧化物酶和过氧化氢酶活性及丙二醛含量变化,探究微囊藻毒素对凡纳滨对虾肝胰腺氧化损伤和相关免疫酶活性的影响,研究氧化损伤及免疫酶活性变化趋势,为微囊藻毒素对凡纳滨对虾中毒机理的研究提供参考。
1 材料与方法
1.1 试验材料
凡纳滨对虾购于天津市滨海新区海通江洋水产养殖专业合作社,体长(13.0±0.5) cm,体质量(16.0±1.0) g,实验室暂养7 d,日投喂1次,试验前24 h停止投喂。试验用水为曝气24 h后的自来水,用海水晶调配盐度至7~8,水温(22±1) ℃,溶解氧7~8 mg/L,pH 8.0~8.5。暂养结束后随机挑选规格一致、健康有活力的凡纳滨对虾作为试验用虾。
微囊藻毒素标准品(MC-LR)购于伊普瑞斯科技有限公司,纯度≥95%。
1.2 试验方法
1.2.1 试验设计与样品采集
试验设1个处理组(注射微囊藻毒素)和1个对照组(注射磷酸缓冲液)。每组设3个平行,每个平行中分别投放凡纳滨对虾30尾。注射后0、2、4、8、16、24、48、72 h时分别自各平行中随机挑取凡纳滨对虾3尾,迅速解剖取出肝胰腺后液氮保存,测定肝胰腺总蛋白及丙二醛含量及超氧化物歧化酶、过氧化氢酶和谷胱甘肽过氧化物酶活性,并记录各个时间点凡纳滨对虾死亡情况。
1.2.2 微囊藻毒素注射
微囊藻毒素标准品用磷酸缓冲液溶解,根据预试验结果,本试验中微囊藻毒素的注射浓度为3.52×10-4mmol/kg(相当于微囊藻密度2.6×105个/L[27]),注射体积为20 μL。对照组注射等量磷酸缓冲盐溶液,注射部位为凡纳滨对虾腹部第二对游泳足中央的血窦处。
1.2.3 样品制备与指标检测
将凡纳滨对虾肝胰腺于液氮中研磨并准确称质量,按虾m(肝胰腺)∶V(生理盐水)=1 g∶9 mL加入质量分数0.86%的冷生理盐水,制备成10%组织匀浆,并以3500 r/min(离心半径13.5 cm)离心10 min,取上清液待测。使用南京建成生物工程研究所试剂盒测定丙二醛含量及超氧化物歧化酶、过氧化氢酶和谷胱甘肽过氧化物酶活性,其测定严格按照相关方法完成。
1.3 统计分析
所有数据均以平均值±标准误表示,数据分析以SPSS 26.0进行。先进行方差齐性检验,随后进行单因素方差分析检测结果的显著性水平,再进行HSD多重比较。P<0.05代表差异显著。
2 结 果
2.1 微囊藻毒素注射后凡纳滨对虾死亡情况
注射后对照组凡纳滨对虾活力正常,无死亡情况;试验组凡纳滨对虾在注射后72 h内沉于或侧倒于缸底,并出现死亡。注射微囊藻毒素8 h后凡纳滨对虾出现死亡,72 h凡纳滨对虾死亡率达13.33%(图1)。
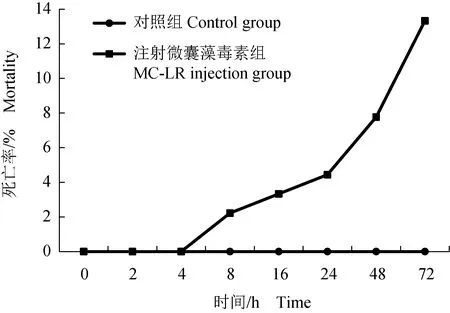
图1 微囊藻毒素注射凡纳滨对虾后死亡率Fig.1 Mortality of Pacific white shrimp L. vannameiexposed to microcystins (MC-LR) injection
2.2 微囊藻毒素对凡纳滨对虾肝胰腺氧化损伤的影响
注射微囊藻毒素后,凡纳滨对虾肝胰腺丙二醛含量呈逐渐升高的趋势(图2)。注射微囊藻毒素8 h后,丙二醛含量显著高于对照组(P<0.05),在72 h达到最大值(4.02±0.02) nmol/mg。

图2 微囊藻毒素对凡纳滨对虾肝胰腺丙二醛含量的影响Fig.2 Effect of MC-LR on malondialdehyde content in hepatopancreas of Pacific white shrimp L. vannamei不同字母表示各处理组不同时间段上差异显著(P<0.05);下同.Different letters indicate that there are significant differences in each treatment group in different time periods (P<0.05). et sequentia.
2.3 微囊藻毒素对凡纳滨对虾抗氧化酶的影响
微囊藻毒素对凡纳滨对虾肝胰腺超氧化物歧化酶活性有显著影响。注射微囊藻毒素2 h内超氧化物歧化酶活性显著上升,并达到最大值(16.88±0.14) U/mg,比对照组增加了36.71%(P<0.05)(图3a)。
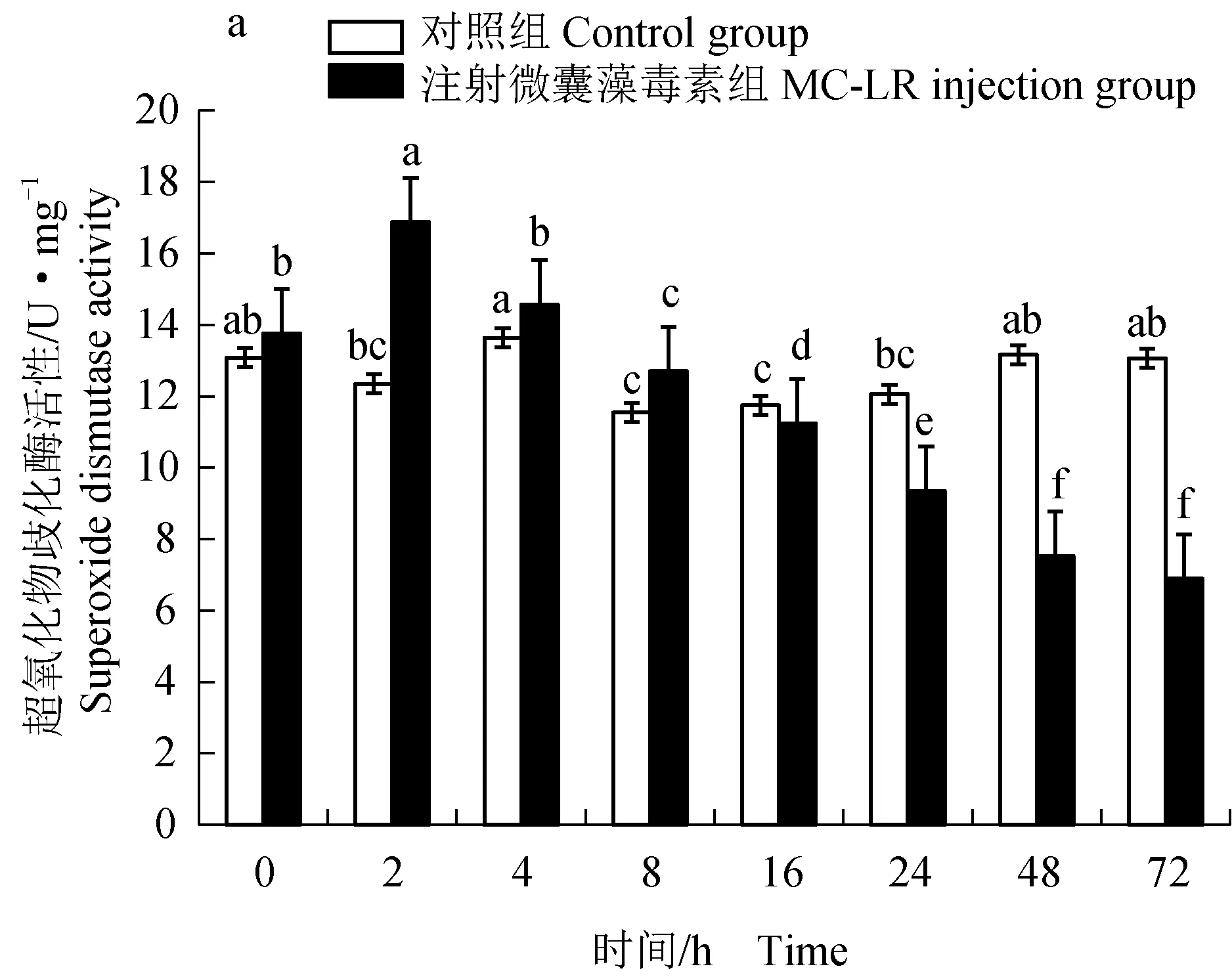
图3 微囊藻毒素对凡纳滨对虾肝胰腺超氧化物歧化酶、谷胱甘肽过氧化物酶及过氧化氢酶活性的影响Fig.3 Effect of MC-LR on activities of superoxide dismutase, glutathione peroxidase and catalase in hepatopancreas of Pacific white shrimp L. vannamei
2 h后,试验组超氧化物歧化酶活性逐渐降低,至72 h仅为(6.89±0.06) U/mg(P<0.05)。谷胱甘肽过氧化物酶活性变化呈先升后降的趋势。凡纳滨对虾在注射微囊藻毒素8 h内,谷胱甘肽过氧化物酶活性逐渐升高,在8 h达到最大值(273.12±2.39) U/mg,显著高于对照组(P<0.05),随后逐渐降低,16 h开始显著低于对照组,72 h达到最低值(121.85±1.69) U/mg(P<0.05)(图3b)。注射微囊藻毒素4 h内,凡纳滨对虾肝胰腺过氧化氢酶活性明显升高,并在4 h达到最大值,显著高于对照组(P<0.05)(图3c)。4 h后过氧化氢酶活性逐渐降低,并在24 h后显著低于对照组,72 h达到最低值(P<0.05)。
3 讨 论
3.1 微囊藻毒素对凡纳滨对虾肝胰腺氧化损伤的影响
微囊藻毒素是微囊藻属、鱼腥藻属等藻类产生的有毒代谢产物,常见于淡水养殖池塘。其主要以肝脏为靶器官[28],破坏水生动物肝细胞结构、引起肝细胞变形,导致肝功能失调[29],并具有时间—浓度双重效应[30]。微囊藻毒素通过细胞膜上有机阴离子转运多肽进入动物细胞内后[31],诱导产生过量的活性氧,持续产生的活性氧攻击多不饱和脂肪酸并使其氧化,产生醛、醇、酮和环氧化物等,其中丙二醛是膜脂质过氧化反应的主要产物之一,丙二醛可攻击动物体内核酸、蛋白质及细胞膜系统中的不饱和脂肪酸等,诱发多种病理损伤,危害动物机体健康[32]。其含量高低可以衡量机体的抗氧化状态,同时也间接反映细胞损伤水平。本试验结果表明,在注射微囊藻毒素8 h后,凡纳滨对虾肝胰腺丙二醛含量显著升高且持续上升(P<0.05),梁花蕾[33]在鲫(Carassiusauratus)饲料中添加蓝藻粉后,鲫肝脏丙二醛含量显著升高,与本试验结果相同。这表明微囊藻毒素进入凡纳滨对虾机体后,机体活性氧的产生与清除平衡被打破,细胞膜多不饱和脂肪酸的双键遭到破坏,从而脂质过氧化造成丙二醛含量升高。
3.2 微囊藻毒素对凡纳滨对虾抗氧化酶的影响

过氧化氢酶是酶促抗氧化反应的主要成员,它能迅速分解过氧化氢,避免其与超氧阴离子自由基生成羟基自由基[37]。本试验中,凡纳滨对虾在注射微囊藻毒素4 h内,过氧化氢酶活性显著升高(P<0.05),而超氧化物歧化酶最高活性出现在2 h,主要原因是超氧化物歧化酶转化超氧阴离子自由基生成大量过氧化氢,过氧化氢含量升高导致机体过氧化氢酶活性增加以清除过量过氧化氢。4 h后过氧化氢酶活性逐渐降低并在16 h后逐渐低于对照组,可能与微囊藻毒素造成细胞内活性氧含量过高有关,当细胞内过氧化氢浓度超过过氧化氢酶清除能力时,过氧化氢酶的构象遭到破坏,活性逐渐降低。此外,活性氧攻击细胞膜上的多不饱和脂肪酸,破坏细胞膜结构,而过氧化氢酶作为与细胞膜相关的酶[38],其活性下降可能与细胞膜受到损伤有关。试验16 h后超氧化物歧化酶和过氧化氢酶活性逐渐低于对照组,表明凡纳滨对虾抗氧化酶系统受到严重损伤。16 h开始超氧化物歧化酶活性低于对照组可能与过氧化氢酶活性下降有关,因为过氧化氢能造成超氧化物歧化酶蛋白氨基酸残基发生氧化[39]。超氧化物歧化酶将超氧阴离子自由基歧化为过氧化氢,过氧化氢酶可以将过氧化氢转化为水和氧气,当过氧化氢酶活性下降时,过氧化氢含量升高,超氧化物歧化酶受到过氧化氢攻击,导致酶活性下降。
谷胱甘肽过氧化物酶是以谷胱甘肽为底物,将过氧化氢和有机氢过氧化物还原为无害物质的活性酶[40]。本试验在注射微囊藻毒素后,谷胱甘肽过氧化物酶活性在8 h内逐渐升高,表明机体过氧化氢及有机氢过氧化物含量升高,诱导机体谷胱甘肽过氧化物酶活性增加。16 h后谷胱甘肽过氧化物酶活性低于对照组,可能的原因是前期有机氢过氧化物大量还原消耗过量谷胱甘肽。由于微囊藻毒素能加快谷胱甘肽的消耗并抑制其从头合成[41],导致谷胱甘肽过氧化物酶酶促反应底物浓度降低。因此谷胱甘肽浓度降低可能是造成谷胱甘肽过氧化物酶活性下降的原因之一。超氧化物歧化酶、过氧化氢酶及谷胱甘肽过氧化物酶都是机体抗氧化系统必不可少的抗氧化酶,在清除活性氧、维护细胞氧化还原平衡及阻止或修复氧化损伤过程中发挥重要作用[34]。
4 结 论
注射微囊藻毒素后,凡纳滨对虾肝胰腺丙二醛含量逐渐升高,表明脂质过氧化反应逐渐增强,微囊藻毒素可以造成对虾肝胰腺出现氧化应激。超氧化物歧化酶、过氧化氢酶及谷胱甘肽过氧化物酶活性均为先升后降,表明微囊藻毒素抑制凡纳滨对虾肝胰腺抗氧化酶活性,对肝胰腺造成严重的氧化损伤。

