面向骨科植入应用的可降解锌基材料研究进展
孙 疆,石章智,李亚庚,李相民,李危石*,王鲁宁*
(1 北京大学第三医院 骨科,北京 100191;2 骨与关节精准医学工程研究中心,北京 100191;3脊柱疾病研究北京市重点实验室,北京 100191;4 北京科技大学 材料科学与工程学院北京材料基因工程高精尖创新中心,北京 100083)
近年来,锌(Zn)作为一种新型医用可降解金属,受到材料学和医学界广泛关注。Zn是人体第二大必需微量元素,参与300多种酶的活动,与锌指蛋白相关的基因占人类基因组的3%,表明Zn在人体多种生理功能中发挥着重要作用[1]。例如在不同细胞水平上的直接信号传导功能;在伤口愈合、大脑发育和细胞膜稳定性等广泛的细胞和生化过程中,作为酶辅因子、蛋白质的结构成分和转录调节因子发挥着关键作用;作为抗氧化剂稳定DNA和细胞膜;改善内皮完整性并防止动脉粥样硬化[2]。Zn2+通过促进成骨细胞和软骨细胞分化,抑制破骨细胞分化和活化等方式,在骨生长中发挥积极作用[3]。Zn的降解速率介于Mg和Fe之间,降解过程不存在类似Mg的明显析氢反应,不会产生因降解气体累积引发的组织肿胀,降解产生的Zn2+还具有一定的抑菌作用。因此,可降解医用锌基材料制成的骨科内植物,与传统永久金属内植物相比,感染及慢性炎症的风险下降、无需二次手术取出,还有望发挥促成骨、促进腱骨愈合等疗效,加速患者康复。
目前,可降解医用锌基植入器件适合工业化生产的制备加工路径主要为:铸造→塑性成形→减材制造→后处理(此非必须)→成品。Zn的熔点约为419 ℃,远低于Mg和Fe的熔点,且熔融态Zn的化学活性远低于Mg,与Al类似,可在空气中熔炼,因此,可降解医用锌基材料的铸造较易实现。铸态可降解医用锌合金普遍具有拉伸脆性,断后伸长率<5%,但是却具有较好的压缩塑性,普遍可以承受>30%的压缩变形[4]。因此,铸造后的第1次塑性成形通常为压力加工,以充分发挥材料的压缩塑性,通过动态再结晶等机制消除拉伸脆性,提高材料的成形性,为后续多种形式的加工打下良好基础。理想情况下,塑性成形过程中材料的体积不变。而实际生产中,涉及去除表面氧化皮和去头尾等减材过程。塑性成形之后的减材制造,包括激光切割、机加工等,将得到植入器件毛坯或者直接得到成品。以北京科技大学和山东百多安公司等单位联合开发的Zn-Cu合金冠脉支架为例,其制备加工流程为:铸造→1道次挤压→多道次拉拔成毛细管→激光切割成支架毛坯→后处理→成品[5]。再以北京科技大学和北京大学第三医院联合开发的高强Zn-Mn-Mg合金界面螺钉为例,其制备加工流程为:铸造→1道次挤压→机加工→成品[6]。
目前已对多种可降解医用锌基材料骨科植入物进行了动物体内评估,锌合金冠脉支架和界面螺钉都没有使用纯Zn制造,这是因为纯Zn的强度低,抗拉强度一般小于150 MPa,硬度一般<40HV,因此在植入过程与骨道的摩擦磨损中或植入后6个月内均面临较大的结构失效风险,难以发挥预期疗效。合金化是提高纯锌强度的有效方法,部分合金化元素还能显著提高纯锌的塑性,例如Mn和Li[4,7-8]。基于Zn及其合金的多种骨科内植物如图1[6,9-12]所示。本文将以纯锌及其合金化元素为脉络,重点对面向骨科领域应用的可降解医用锌基材料的制备加工、组织结构、毒理学、生物相容性、力学性能和腐蚀行为等进行回顾总结,旨在帮助相关研究人员以材料学和医学的双重视角实现可降解医用Zn基材料及器件的优化和创新设计。
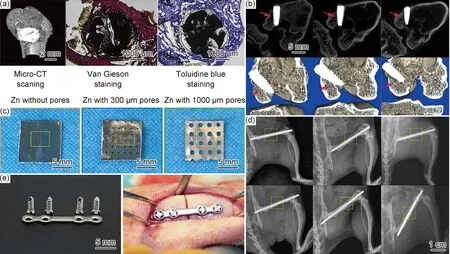
图1 基于Zn及其合金的多种骨科内植物
1 Zn的生理功能以及纯Zn材料
纯Zn在体外实验中可能表现出一定细胞毒性。多种细胞(L929,MC3T3-E1等)在纯Zn浸提液中或纯Zn表面直接培养,均被检测出不同程度的活力降低[13-15]。也有文献报道纯Zn螺钉术后出现周围骨整合延迟[9]。上述关于纯Zn不一致的报道,可能是由体内外环境以及体内不同部位或生理状态下,纯Zn的降解行为变化和降解产物变化引起的。Zn2+在体内的生理作用具有明显的浓度依赖性,例如暴露于较低的Zn2+浓度(186.2 μmol/L),MC3T3-E1细胞表现出较高的增殖率和健康的形态;而较高的Zn2+浓度(367.7 μmol/L)会严重损害这种细胞的活力和形态[16-17]。表1[3,14,18-20]列举了不同种类细胞对微环境中Zn2+的耐受情况,研究人员应当根据不同内植物植入体内环境中的细胞种类,调整Zn基材料降解过程中Zn2+的析出速率。

表1 不同种类细胞对微环境中Zn2+的耐受情况
此外,体外不同检测方法及浸提标准也可能造成浸提液中Zn2+浓度的较大差异。
Zn在体内降解的主要反应及产物如下:
Zn→ Zn2++ 2e-
(1)
O2+ 2H2O + 4e-→ 4OH-
(2)
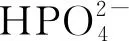
Zn2++2OH-→Zn(OH)2
(3)
Zn2++2OH-→ZnO+H2O
(4)
→Zn3(PO4)2+4H2O
(5)
对植入兔股骨干中的纯Zn钉棒长达6个月的观察发现,纯Zn降解速率均匀,无明显炎症反应[21]。在骨/植入物界面形成了新生骨组织,并发现对大肠杆菌(E.coli)和金黄色葡萄球菌(S.aureus)具有较强的抗菌活性。在另一项植入大鼠股骨髓腔8周的实验中,纯Zn表现出良好的生物相容性,无骨溶解、畸形或脱位迹象,Micro-CT结果显示新骨形成并与植入物直接接触。纯Zn植入物在体内降解发生点蚀,可以观察到局部积累的降解产物[19]。大部分Zn基材料在体内外降解过程中仅会引发局部环境pH值的轻度上升,例如在成骨诱导培养基中浸泡72 h后,纯Zn组溶液的pH值为8.5,而纯Mg组则升至10.4[20]。目前认为适合成骨细胞增殖分化的pH区间为8.0~8.5。体内环境下,氧分压、体液组分和循环状况等局部微环境因素会显著影响Zn基材料的降解。例如,当Zn基材料植入血管后,局部血液循环将大大减少OH-的积累,在材料表面形成均匀致密的Zn3(PO4)2腐蚀层;当Zn基材料植入骨组织时,植入物周围是一种静态/循环混合环境,植入物/骨界面会形成混入Zn(OH)2和ZnO的Zn3(PO4)2腐蚀层[22]。
除了已提及的强度和硬度低,纯Zn作为骨科植入物还存在以下问题:(1)杨氏模量约为97 GPa,高于人类皮质骨的杨氏模量(10~30 GPa)[4,23],因此,大体积的纯Zn植入物可能引发应力屏蔽效应,对骨组织新生和改建产生负面影响;(2)降解速率有待调控,例如植入大鼠股骨髁2个月后,纯Zn钉棒的体积损失仅为1.7%,直径为5 mm的纯Zn钉棒在骨环境下完全降解可能需要十多年时间[24]。
综上,纯Zn与理想骨科内植物的性能要求尚有差距(图2)。通过化学成分、组织结构调控和表面工程等方法,可以改变纯Zn的生物学特性、降解行为、力学性能和临床易用性,使医用可降解Zn基材料更接近理想骨科内植物的要求。
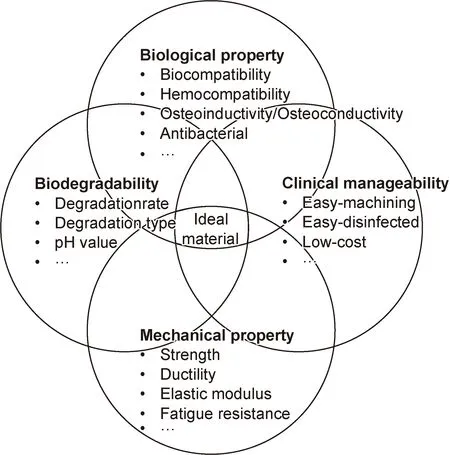
图2 骨科内植物材料的需要考虑的性能要求
2 医用可降解Zn合金
总体而言,Zn基材料骨科植入物在各种动物模型中表现出了良好的生物相容性(见表2[6,9-12,24-27],表中合金未注明的均为质量分数)。目前医用可降解Zn合金的研究涉及的合金元素主要有人体必需的常量元素Mg,Ca,Sr,微量元素Cu,Mn以及Ag和Li等。Al因在体内有诱发阿尔茨海默病的风险,不推荐作为内植物材料的成分。
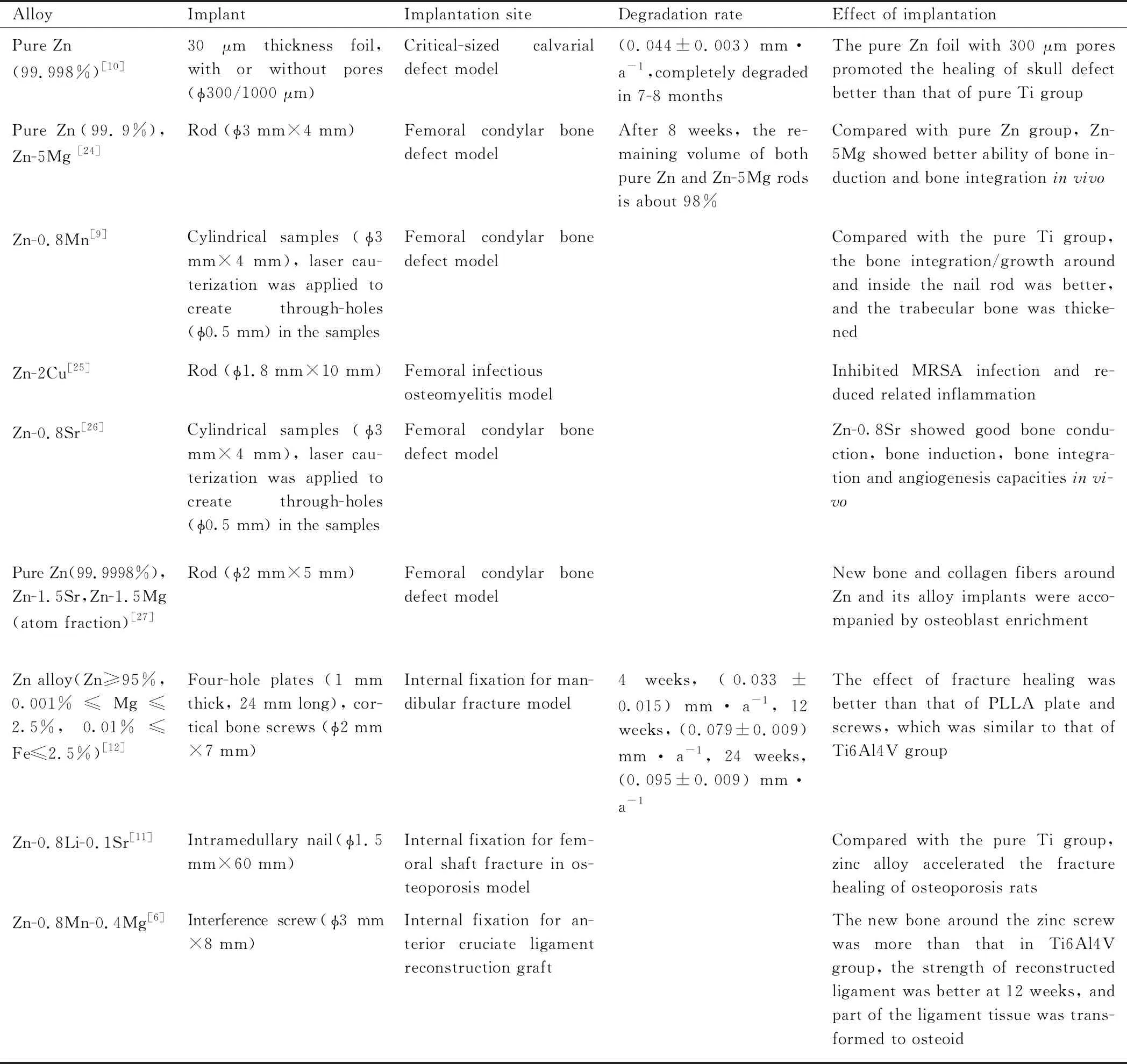
表2 Zn及其合金在骨科领域的体内植入研究
2.1 Zn-Mg合金
在可降解金属中,镁的生物相容性良好,弹性模量较低(约为45 GPa),并且降解产生的Mg2+可以通过支配骨膜的感觉神经纤维末梢释放降钙素基因相关肽(CGRP),加速骨髓间充质干细胞(BMSCs)募集黏附,上调BMP-2和VEGF的表达以及抑制NF-κB通路活性等方式,有效促进新生骨形成[28-31]。这些特性使得Mg基材料成为目前得到最广泛研究和关注的医用可降解金属材料[32]。自1900年Payr[33]首次将Mg板应用于关节置换术以来,研究人员围绕Mg基材料制成的接骨板、螺钉和髓内钉等器件进行了大量体内外实验研究,探索它们作为骨科内固定物及组织再生修复支架的临床应用潜能。因此,在Zn中加入Mg是一种容易想到的材料改性策略。
含Mg的Zn基材料会在降解过程早期集中释放Mg2+,从而与Zn2+协同实现促成骨、抑菌等多项生物学功能。微环境中Zn2+和Mg2+的共存能够促进两者流入BMSCs,并且能够抑制细胞内Zn2+的外流,从而有效激活Runx2的转录以及ALP和OCN的表达,诱导BMSC的成骨分化[34]。Murni等[20]研究了Zn-3Mg合金浸提液对人成骨细胞系(NHOst细胞)的影响,发现该合金在细胞活力和诱发炎性反应方面的表现与纯Zn差别不大,而细胞早期PGE2表达明显升高,说明修复骨损伤的潜力提升。Zn08Mn04Mg韧带修复骨钉在生理盐水中降解,前20天内释放的Mg2+量达到Zn2+量的52%(质量分数,下同),而合金成分中Mg含量仅为Zn的1.2%[6]。这种早期集中释放产生的多种成骨离子协同效应,是促使肌腱骨化从而提高腱骨愈合速度和强度的重要原因[6]。Mg2+的早期集中释放还可以避免Zn2+过度释放造成的毒性或骨整合延迟。大量的体外细胞相容性和血液相容性研究已经证明,多种Zn-Mg合金(Mg含量为0.05%~4%)都具有良好的生物相容性[19-31,35-37]。
绝大多数Zn-Mg合金的体内植入表现良好。Li等[13]证实,在小鼠股骨中植入直径0.7 mm、长度5 mm的Zn-1Mg合金钉棒没有引发局部或全身的毒性反应,且相较于空白对照组,促进了植入区域周围新骨的形成。另一项大鼠股骨内植入的组织学结果显示,Zn-5Mg合金与新生骨质在多个位置直接接触,骨结合面积明显增加,而纯Zn钉棒周围则出现了骨整合延迟[24]。热挤压Zn-0.05Mg合金在新西兰兔骨组织内表现出良好的成骨诱导性,同时针对大肠杆菌及金黄色葡萄球菌均具有良好的抑菌活性(>99%)[9]。Zn-Mg合金在骨组织内的降解主要分为3个阶段,与骨组织愈合的阶段相对应[24]:(1)酸性pH(5.2~6.9)的血肿、缺氧以及炎性细胞浸润期,降解产物主要以Zn2+和Mg2+为主;(2)pH接近中性(≈7.4)的低氧、软骨痂及纤维组织修复期,以ZnO,Mg(OH)2为主的腐蚀产物开始形成并与体液中的高浓度Cl-(150 mmol-1)形成可溶性氯化物。ZnO更稳定,大量Mg2+在周围愈伤组织中形成浓度梯度;(3)碱性pH(7.4~8)的高氧、坚硬的骨痂和新生血管生成期,整体降解速率降低,pH值上升诱发材料周围钙磷沉积,在新形成的骨骼周围产生一个低Zn含量的结晶磷酸钙区域,其化学成分与骨骼相似,最终被破骨细胞重新吸收,诱导成骨细胞形成新骨[38]。总体而言,与纯Zn相比,Zn-Mg合金的降解会进一步促进新生骨的形成及矿化。
Mg还是一种能够显著强化Zn的元素,但是单独加入时会导致室温老化。热挤压态Zn-0.08Mg合金的屈服强度(YS)、抗拉强度(UTS)和伸长率(EL)达到250 MPa,266 MPa和30%;但放置仅9天后,YS升至452 MPa,EL降至13%;放置1年后,YS降至383 MPa,EL仅为4%[39]。目前,Mg强化Zn的规律、机理及其引发室温老化的原因尚不明确。在Zn-Mg合金中加入Cu或Mn可以消除室温老化[40]。
在体外腐蚀速率方面,Mostaed等[41]发现挤压态Zn-xMg(x=0.15%~3%,)系列合金在Mg含量增加到1%之前,腐蚀速率随着Mg含量增加而增加;当Mg含量超过1%后,腐蚀速率随着Mg含量增加反而降低。然而,Kubasek等[42]的研究却发现Zn-xMg (x=1%~3%)系列合金的腐蚀速率几乎没有差别。从电偶腐蚀角度,Mg含量提高会增加Mg2Zn11相的体积分数,形成更多的微电偶加快腐蚀。但是,Mg2Zn11中Mg2+的早期集中释放可能形成了某种具有保护性的富Mg腐蚀产物,这尚待进一步研究揭示。
2.2 Zn-Mn合金
Mn是人体必需微量元素,主要作为辅酶参与多种基本生命过程,包括但不限于能量代谢、新骨形成、自由基清除和神经递质合成[43]。Mn可以通过影响整合素活性来调节细胞与细胞外基质之间的相互作用,进而影响细胞增殖、黏附和扩散。骨组织中适量的Mn有益于碱性磷酸酶(ALP)和骨形态发生蛋白(BMP)的表达、骨胶原重建与沉积、骨量维持和血管新生(胰岛素样作用)[44]。Mn元素可以大幅度提高Zn合金的塑性,从而提高其成形性。Zn-0.8Mn合金经过大应变退火成形后[45],因为晶粒细化和拉伸测试中发生动态再结晶等对塑性的提升作用,EL从热轧态的46%提升至94%,部分样品的EL超过100%[8]。Jia课题组[18]研究了Zn-xMn(x=0.1%~0.8%)系列合金的体内外生物学表现,发现Zn-0.8Mn合金相较于纯Zn,对MC3T3-E1细胞的增殖、形态以及成骨相关基因表达的提升最为显著。大鼠股骨髁的植入实验结果表明,Zn-0.8Mn合金组不同时间点的新生骨量、骨小梁厚度和材料内部骨长入情况均优于对照纯Ti组,进一步肯定了Zn-0.8Mn合金在体内环境的成骨诱导能力。
Sun等[46]发现固溶热处理是调控Zn-Mn合金性能易行而有效的手段。将轧态Zn-0.8Mn合金在380 ℃保温45 h,MnZn13第二相完全固溶,合金的硬度从54HV升至70HV,电化学腐蚀速率从145 μm/a降至95 μm/a,对小鼠成纤维细胞(L929)的毒性显著降低,细胞增殖效率由小于8%飙升至超过100%[46]。不过,这种对细胞增殖效率的影响随细胞种类而异,对于大鼠间充质干细胞(rBMSCs),固溶热处理的影响没有统计学显著性。
2.3 Zn-Li合金
Li是能够显著强化Zn的合金元素。Li等[47]揭示了铸态Zn-xLi(x=0.1%~1.4%)系列合金的组织形成规律。当Li含量低于0.44%时,Zn-Li合金熔体在凝固过程中先析出Zn相(即一次Zn相),再发生共晶反应析出β-ZnLi4,形成Zn晶界上分布β-ZnLi4的微观组织。而当Li含量高于0.44%时,Zn-Li合金熔体在凝固过程中先析出β-ZnLi4相,再发生共晶反应形成Zn+β-ZnLi4共晶组织,随着温度进一步降低,初生β-ZnLi4中析出片条状Zn相(即二次Zn相),形成β-ZnLi4/Zn片层组织。因此,过共晶Zn-Li合金形成了全片层组织,即β-ZnLi4/Zn片层组织之间分布着Zn+β-ZnLi4共晶片层。β-ZnLi4是硬而脆的金属间化合物,热轧过共晶Zn-Li合金很脆。为了解决这个问题,北京科技大学研发了热-温轧制成形法[48],在保持高强度的前提下,显著提高了过共晶Zn-Li合金的塑性。热-温轧制Zn-0.5Li合金具有多级组织,除了上述全片层组织,还在共晶Zn相中析出了纳米β-ZnLi4网络,因此,软的Zn相中析出β-ZnLi4得到强化,硬的β-ZnLi4相中析出Zn得到塑化,使得构成合金的双相同时发生强塑化,合金的YS,UTS和EL分别达到246 MPa,395 MPa和46%[49]。热-温轧制Zn-0.8Li合金的YS,UTS和EL分别达到261 MPa,401 MPa和81%,且组织中有平均直径为4 nm的球状β-Li2Zn3析出强化相[7]。
Zn-Li合金的性能可以通过合金化进一步调控。例如向Zn-0.8Li合金中添加Mg元素可获得UTS为647 MPa的Zn-0.8Li-0.4Mg合金[51]。研究证实Li可以通过激活经典Wnt通路来改善小鼠骨量并促进新生骨形成[52]。在新西兰兔体内的植入实验证明Zn-0.8Li-0.1Sr合金具有良好的生物相容性并对于骨质疏松骨折疗效明确,作为骨质疏松承重部位内固定物材料具有较好的临床应用前景[11]。
2.4 Zn-Cu合金
作为人体健康必需的营养元素,Cu的缺乏可导致葡萄糖和胆固醇代谢、心脏电生理以及神经免疫系统异常[53]。Zn中加入Cu合金,可提高抗蠕变性、强度和硬度[54]。Zn-Cu合金中的第二相为CuZn4,可以固溶进Zn基体,然后时效析出形成片状纳米析出相[55]。Tang等[56]制备了挤压态Zn-xCu(x=1%~4%)系列合金,发现随Cu含量升高,合金的强度及塑性也提高,Zn-4Cu的YS,UTS和EL分别为227 MPa,271 MPa和51%;这些Zn-Cu合金在SBF溶液中的浸泡腐蚀速率均高于纯Zn。Li等[57]在体外评价了铸态和轧态Zn-xCu(x=1~4)系列合金作为颅额面部骨折手术植入物材料的潜力。轧态纯Zn的YS,UTS和EL分别为85 MPa,151 MPa和42%,而轧态Zn-4Cu合金的对应值分别为327 MPa,393 MPa和39%,在保持高塑性的基础上显著提升了强度。
在骨科手术中,植入物和骨组织之间的界面是一个免疫缺陷性纤维化炎症区(宿主免疫抑制和抗感染能力降低的区域),细菌可轻易黏附、定植并引起感染。一般来说,植入物感染的机制是游离细菌接触并黏附在材料表面,形成难以去除的细菌生物膜[58]。只要植入物存在,感染风险就存在。因此,Cu在骨科领域的特殊价值是其广谱抗菌特性,可以同时抑制细菌黏附和生物膜的形成。目前可以通过离子注入和合金化等方法将Cu加入钛、不锈钢和Mg合金中,从而赋予传统骨科和口腔内植物较强的杀菌性能[59-62]。Zn-Cu合金是可生物降解的抗菌植入物,有可能从源头上预防细菌感染。Wen团队[63]开发了Zn-1Cu-0.1Ti合金,并在体外利用抑菌圈法证实了该合金对金黄色葡萄球菌的抗菌活性。然而,局部组织内或人体中过量的Cu具有细胞毒性,并有诱发诸如阿尔茨海默病和威尔逊病等神经系统退行性疾病的风险。目前研究显示,Zn-xCu(x=0.5~4)系列合金在体外对成骨前体细胞以及成纤维细胞的毒性与纯Zn相当,添加Cu没有降低生物相容性[25,63-64]。尽管如此,在临床应用前,仍需要更多细胞种类及体内植入数据来为Cu的添加量提供参考标准。
Zn-Cu合金中添加Mg可以提高对部分细胞的相容性[65]。Zn,Zn-3Cu和Zn-3Cu-0.1Mg合金的未稀释浸提液对人内皮源性细胞有毒性;而Zn-3Cu-0.5Mg和Zn-3Cu-1Mg在相同条件下无细胞毒性。随着Mg含量增加,铸态和挤压态Zn-3Cu合金中的晶粒尺寸减小,微观组织更均匀。Qu等[25]建立了大鼠股骨骨髓炎模型,Zn-2Cu合金治疗组对耐甲氧西林金黄色葡萄球菌(MRSA)显示出显著的抗菌活性,并减少了炎症毒性副作用和感染相关的骨丢失。此外,研究发现添加Cu2+的聚DL-乳酸支架可以通过上调ST-2骨髓基质细胞的VEGF分泌,促进骨质再生过程中的血管生成[66]。目前尚需更多的体内植入实验揭示Zn-Cu合金对骨组织愈合及改建的影响。
2.5 Zn-Ag合金
与Cu类似,Ag也因其多种化学状态下优良的抗菌性能而长期应用于生物医学领域。渗透进细菌细胞内的Ag2+或微粒可以使细菌DNA双螺旋分子凝聚皱缩并失去复制能力,导致细菌死亡[67]。然而,人体免疫系统对游离Ag纳米颗粒(Ag-NPs)的毒性作用非常敏感,尤其是在高浓度下[68-69]。由于其体积小、流动性高,Ag-NPs可进入哺乳动物细胞并破坏细胞器功能[70-71]。因此,对含有Ag元素的合金材料,应注意控制Ag合金元素的占比并避免突释效应。在体外测试中,Zn-xAg(x=1~6)合金显示出良好的抗菌性能,没有观察到对小鼠成骨细胞的细胞相容性发生恶化[72]。Li等[73]也指出添加Ag不会增大Zn合金对L929细胞和人类原发性骨肉瘤细胞(Saos-2)的细胞毒性,Zn-4Ag合金还展现出了优秀的抗格氏链球菌(S.gordonii)活性。
Ag元素对Zn有强化作用,挤压态Zn-4Ag合金的YS,UTS和EL分别为157 MPa,261 MPa和37%[73]。Mostaed等[74]制备了挤压态Zn-4Ag-0.6Mn合金,UTS和EL分别为302 MPa和35%,说明Mn的添加能够在保持Zn-Ag合金塑性的基础上显著提高其强度。Zn-Ag合金的体外降解速率在电化学和浸泡实验中较纯Zn稍快。有研究显示,HUVEC细胞在Zn-0.8Ag合金表面的黏附性要弱于Zn-Mg/Ca/Sr/Fe等二元Zn合金[75]。Yang课题组[14]报道Zn-2Ag合金在大鼠股骨内呈现广泛的局部腐蚀,腐蚀坑深入基体超过50 μm,材料与骨质间存在较厚的纤维组织中间层,并且新生骨组织显示出破碎的特征,这表明该合金作为内植物在腐蚀模式及骨整合能力方面不如其他Zn合金。
2.6 其他Zn合金
在Zn中加入Fe,Ca和Sr等,共同点是在合金熔体凝固过程中会形成粗大的金属间化合物,对合金塑性造成不利影响[4]。Zn-Fe合金中的主要第二相是底心单斜结构的FeZn13,它易形成{110}生长孪晶,在锌合金熔体中也以{110}面为择优生长界面,因此,可形成箭头状FeZn13颗粒[76]。Zn-Ca合金中的主要第二相是面心立方结构的CaZn13,择优生长方向为〈111〉和〈010〉,易形成长度超过40 μm的粗大枝晶,难以固溶入Zn基体,也不易通过塑性变形完全破碎[77]。细化金属间化合物第二相是这些合金的共同需求。目前已发展出稀土微合金化法和循环水冷凝固法等显著细化了FeZn13和(Fe, Mn)Zn13,达到了提高合金强度和降解均匀性的效果[78-79]。Li等[13]将Zn-1x(x=Mg,Ca,Sr)系列合金钉棒植入小鼠股骨远端,8周后发现Zn-1Mg,Zn-1Ca和Zn-1Sr合金的新生骨厚度分别为188,233 μm和364 μm,明显高于对照假手术组的26 μm。未来的研究中,在骨代谢中起重要或有益作用的元素可被视为潜在的合金元素(表3[14,80]),如Fe,B和Se等,同时起到调控Zn合金降解的目的,以开发新的医用可降解Zn合金体系。
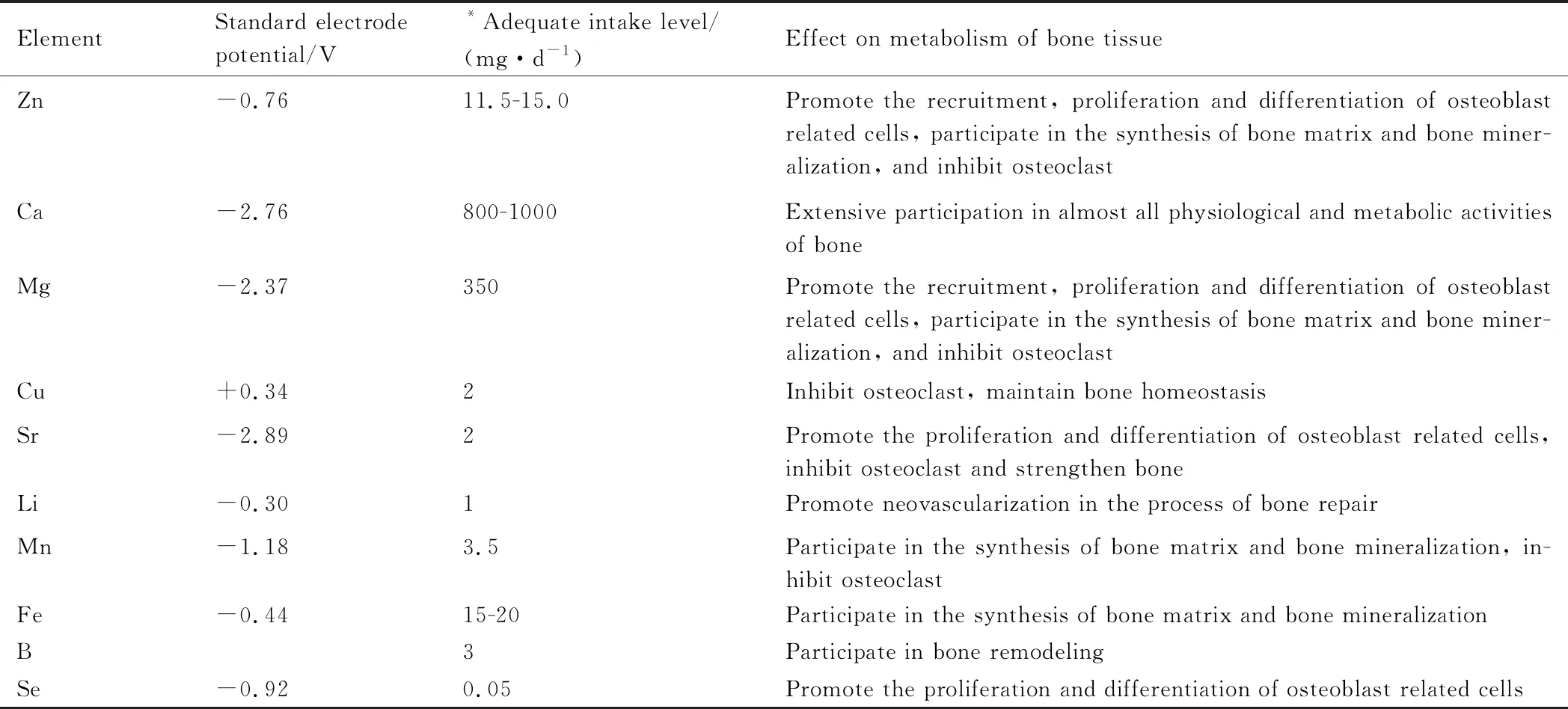
表3 参与人体骨质代谢的潜在合金元素[14,80]
3 增材制造多孔Zn基材料
钛和钽等惰性金属骨替代支架可通过增材制造技术制备加工,使其具有匹配天然骨组织的力学性能、内联通的多孔结构以及适宜的孔径和孔隙率,其较大的生物功能化表面积和渗透性已被证实对于骨传导、骨诱导及骨整合具有积极作用[81]。针对Zn基材料而言,增材制造还能够调控支架的降解速率,进一步满足不同患者的个体化需求。选择性激光熔化技术(SLM),因其高温度、无刚性支撑和高尺寸精度等优势,目前被认为是最适于加工医用可降解金属植入物的增材制造技术[82]。然而,Zn低熔点、低沸点及高反应性的特点,使得其在打印过程中蒸发现象十分明显[41]。反应室内的金属蒸汽会引发激光的能量衰减及散射,导致熔融不足及匙孔形成。另一方面,熔融状态下的Zn具有较高的流动性及润湿性,很容易与周边粉末发生毛细作用,造成大量粉末附着在熔池中,影响加工器件的表面质量,同时造成小梁直径与整体孔隙率偏离设定值[83]。
针对上述问题,Wen等[84]优化了成形腔内的气体循环系统,减少了Zn蒸气在反应室内聚集,一定程度上减少了匙孔及熔融不足等缺陷。Li等[85]通过SLM制备了金刚石单元结构多孔Zn支架,梁径441 μm,孔径为550 μm,孔隙率62%的圆柱状多孔Zn支架的YS为11 MPa,弹性模量(E)为786 MPa(松质骨YS=0.2~80 MPa,E=10~2000 MPa)。该支架在体外静态和流动的改良SBF溶液(r-SBF)中浸泡28天,分别损失了3.6%和7.8%的体积。多孔Zn在r-SBF中的腐蚀产物包含Zn,O,C,P,Ca,Na,Mg,S,N,Cl元素。随着浸泡时间延长,Ca,O和P的含量增加,而Zn的含量减少。浸泡后,样品的YS及E均有不同程度提高,这可能要归因于硬度5倍于增材制造Zn基体的腐蚀产物[86]。该团队后续在三种不同结构(小梁直径300,400 μm和200~400 μm梯度变化)的锌合金支架上也观察到了类似的腐蚀产物强化作用,同时证实多孔结构的改变对降解行为也有显著影响(三组间降解速率最大差异达到150%)。Qin等[83]为了强化多孔Zn的力学强度,将纯Zn粉与WE43粉混合,制备了Zn-xWE43(x=0~8)多孔支架,结果表明快速冷却和WE43的加入引发的晶粒细化共同导致了多孔Zn强度的提升。与块状材料类似,随着WE43含量的增加,更多的Zn+Mg2Zn11共晶析出,提高了抗拉强度,但降低了伸长率;而脆性MgZn2相的形成对强度及塑性均会产生不利影响。Zn-5 WE43多孔支架的YS由纯Zn的23 MPa提高到73 MPa,E则由950 MPa提高到2480 MPa[83]。目前针对多孔Zn的生物学研究较少,增材制造多孔锌的表面对于MG-63细胞的细胞相容性较好,细胞对于支架不同区域的黏附并没有表现出明显的选择性。
增材制造Zn基材料的研究尚处于起步阶段,仍需优化制粉及打印工艺,进一步提高成品成分及结构的可控性,以匹配个体化定制植入物高精度的需求。在材料选择、结构设计及后处理方面,在参考传统金属经验的前提下,也需要考虑Zn合金可降解的特性。在保证优良的生物相容性及促成骨能力的前提下,实现随着损伤修复进程,将力学负载由支架逐渐转移至新生骨组织。
4 结束语
目前诸多实验结果均表明可降解金属具有很好的临床应用前景。Mg-Y-RE-Zr和Mg-Ca-Zn合金制成的骨螺钉已分别于2013年和2015年获得欧盟CE认证和韩国食品药品监督管理局(KFDA)的批准;2020年,空军军医大学口腔医院完成了国际上首例可降解锌合金(湖南华耀百奥医疗)颌面骨折内固定手术;用于自体骨移植或骨折固定的高纯Mg螺钉也已正在国内投入临床实验。
(1)力学性能
对于应用于骨科领域的Zn基材料,相较于纯Zn,强度是首先要提升的性能。在已报道的合金元素中,Mn对合金延展性最为有利,Mg和Li具有最好的强化效果,而Cu实现了强化和增韧效果的平衡。但是目前文献中广泛引用的针对骨科植入物材料的力学性能标准,即YS>230 MPa,UTS>300 MPa,EL>15%~18%,稍显严苛过时。临床上诸多力学性能低于此标准的材料,如PLLA,PEEK等也被证实能够满足植入需要。因此,根据不同手术应用场景的实际需要,制定与之匹配的材料性能标准(如屈服强度、抗拉强度、伸长率、抗疲劳性能、降解速率、降解模式等),应当是下一步医工交叉合作需要解决的问题。
(2)降解行为
由于实验方法和浸泡液的差异,不同报道的实验结果之间不易直接比较,导致合金元素对锌合金降解速率的影响尚无成体系自洽的结论。在降解模式方面,均匀腐蚀要优于局部腐蚀。尤其是应用于承重部位,局部腐蚀可能会导致植入物提前失效。
(3)生物学效应
作为医用材料,保证Zn基材料的生物安全性尤为重要。与力学性能标准类似,当前的生物材料细胞毒性评估标准(即ISO 10993-15)中的浸提液制备标准,即1.25 cm2/mL并不适用于可降解金属。按此标准制备衡量,在100%浸提液浓度下表现出较高细胞毒性的Zn合金,在体内往往仍表现出较好的植入效果,并未观察到局部骨质溶解及炎性反应等副作用。组织微环境内Zn2+,Mg2+和Sr2+等在成骨诱导和生物相容性等方面具有协同作用的离子,在适宜的浓度区间内共存,可以改善植入物的生物学表现。
除合金化外,应用增材制造技术、制备ZrO2纳米镀膜和磷酸Zn涂层等方法也被用于优化Zn基材料的弹性模量和细胞黏附性。Zn被誉为“21世纪的钙元素”,随着对Zn基材料降解和生物效应等方面认识的深入,通过进一步性能改良并制定相关国家/行业标准,Zn基材料将实现广泛的临床应用,解决传统惰性材料的局限性,造福广大患者。

