一种基于野田村病毒的递送功能性siRNA表达系统构建
马立婷,田忠慧,李 杨
(复旦大学 生命科学学院,上海 200438)
1998年Fire等[1]首次在秀丽隐杆线虫中发现RNA干扰(RNA interference,RNAi)现象,他们发现向线虫体内注入双链RNA(double-stranded RNA,dsRNA)可以抑制同源基因的表达。这种现象发生在转录之后,所以RNAi又被称为转录后基因沉默现象[2]。经过多年的研究,科学家陆续在植物、昆虫、真菌以及哺乳动物中发现RNAi现象[3-11]。RNA酶Ⅲ家族成员Dicer蛋白切割dsRNA,产生具有3’端2 nt悬挂末端的21~23 nt小干扰RNA(small interfering RNA,siRNA),双链siRNA解链后进入RNA诱导的沉默复合物(RNA-Induced Silencing C omplex,RISC)的核心蛋白Argonaute(AGO)蛋白,介导对同源mRNA的切割作用[12]。然而,研究发现向哺乳动物细胞导入dsRNA时,较长的dsRNA会激活干扰素反应,还可能会抑制非特异性基因的表达,产生脱靶效应[13-15]。
2001年,Elbashir等[16]首次揭露体外合成的siRNA可以在人源293T细胞和He La细胞中诱导基因沉默。同年Caplen等[17]发现siRNA能够直接在哺乳动物细胞中介导RNAi作用,而不会引发脱靶效应。这些研究成果证明21~25 nt的siRNA是哺乳动物RNAi的重要中间效应因子,因此开发出高效的siRNA递送系统是促进RNAi技术发展的关键。
随着siRNA递送系统不断发展,如何将siRNA安全高效地导入靶细胞依然是该项技术应用的关键[18-19]。病毒载体具有感染效率高、感染对象广泛等优点,因此常作为核酸运载工具介导体内或者体外基因沉默[20-22]。常用的病毒载体类型包括逆转录病毒、腺病毒、腺相关病毒、慢病毒。逆转录病毒具有宿主范围广泛、持续表达外源基因、转染效率高等优势,但是它不能感染非分裂的细胞,且转移基因片段的容量较小[23];腺病毒宿主范围广,表达效率高,但是存在很大的免疫原性问题,注射到机体后很快会被免疫系统识别并清除[24];腺相关病毒介导的外源基因可以持续稳定表达,但是病毒包装容量小,且纯化和给药方式仍需改进[25];慢病毒能够感染分裂细胞及非分裂细胞,转移基因片段的容量较大,但是存在生物安全性和包装效率低等问题[26]。DNA病毒在复制过程中能够将外源基因随机整合到宿主的基因组内,存在引起癌变的风险[26],相比之下RNA病毒风险较小[27],这使得RNA病毒载体在应用上具有更大的潜力。
野田村病毒(Nodamura Virus,No V)是Nodaviridae家族的成员,其基因组由两条正链RNA组成:RNA1编码病毒RNA依赖的RNA聚合酶(RNA-dependent RNA Polymerase,Rd RP)的重要催化亚基蛋白A,RNA2编码衣壳蛋白前体。在病毒复制过程中,RNA1可以转录出亚基因组RNA3,其编码非结构蛋白B1和B2[28]。No V能够感染库蚊、乳鼠、猪等动物,是目前同属病毒中唯一在自然状态下既能感染昆虫又能感染哺乳动物的病毒[29-31]。No V基因组结构简单,易于进行反向遗传学操作,感染的宿主范围广,现已作为良好的病毒工具被广泛应用于各种研究[32-35]。
研究表明No V感染鼠源BHK-21细胞时不引起细胞病变[36-37],向BHK-21细胞中转染RNA1和RNA2即可获得No V病毒粒子[35,38]。前期实验证明当向乳鼠腹腔注射野生型No V时,乳鼠在5天后全部死亡,而注射B2缺陷型野田村病毒(No V(ΔB2))后,乳鼠一直保持健康状态,而且No V(ΔB2)感染的BHK-21细胞和乳鼠中可以检测到大量病毒来源的siRNAs(virus-derived siRNAs,vsiRNAs),这些vsiRNAs可以结合AGO蛋白切割同源病毒基因,从而使No V(ΔB2)被快速清除[39-40]。基于前期实验结果,本实验旨在以No V(ΔB2)作为病毒载体,携带目的基因片段,产生靶向目的基因的siRNA从而抑制其表达。
本研究以EGFP为靶基因,结合病毒基因组的大小,考虑到病毒包装容量等因素,因此选择EGFP的部分基因片段作为尝试,将EGFP基因5'端不包含起始密码子的214 bp片段(E214)作为目的基因片段包装入病毒载体中,从而构建出以No V(ΔB2)为载体的siRNA递送系统,并通过深度测序证明该系统能在哺乳动物体内产生靶向EGFP的siRNA。
1 材料与方法
1.1 材料
1.1.1 细胞
本研究使用的细胞BHK-No V_B2,BHK-Ebola_VP35由本实验室保存,使用高糖DMEM培养基培养,添加10%胎牛血清(FBS)及1%的青霉素-链霉素双抗,于5%CO2,37℃培养箱培养。
1.1.2 试剂
实验中所用抗体均由本实验室保存,大肠杆菌E.coliTrans5α感受态细胞购自Trangene公司,Ifnar1/2双缺陷型C57BL/6鼠(AG6)由中国科学院上海巴斯德研究所冷启彬教授馈赠,高保真PCR聚合酶,反转录试剂,荧光定量试剂,同源重组试剂均购自南京诺唯赞生物科技有限公司;TransIT®-mRNA Transfection Kit购于Mirus公司;Vaccinia Capping System,NheⅠ-HF酶购于New England Biolabs公司。
1.2 方法
1.2.1 p MT-RNA1-E214及p MT-RNA1(ΔB2)-E214重组载体的构建
No V(ΔB2)是通过将RNA1的P2745、P2754、P2757三处进行点突变得到的B2蛋白表达缺陷型病毒,其突变位点不影响重组载体构建。将E214基因片段构建至RNA1的序列末端(图1)。
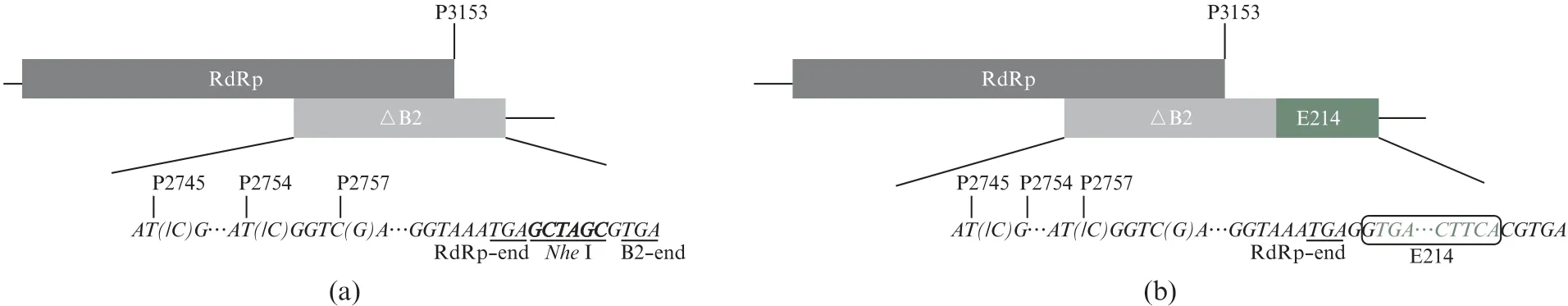
图1 重组质粒构建Fig.1 Construction of recombinant plasmid
通过PCR法在p MT-RNA1和p MT-RNA1(ΔB2)的序列末端引入NheⅠ酶切位点(图1(a),引物序列见表1中p MT-No V_RNA1-NheⅠ-F和p MT-No V_RNA1-NheⅠ-R);通过PCR法扩增得到E214片段(图1(b),引物序列见表1中EGFP-F和EGFP-R);将NheⅠ酶切线性化的载体与E214片段同源重组构建出p MT-RNA1-E214及p MT-RNA1(ΔB2)-E214重组质粒。

表1 PCR引物Tab.1 Primers for PCR
1.2.2 体外转录获得RNA1-E214、RNA1(ΔB2)-E214以及RNA2
通过PCR法,以p MT-RNA1-E214,p MT-RNA1(ΔB2)-E214,p MT-RNA2为模板,扩增得到含有T7启动子序列的DNA片段T7-RNA1-E214,T7-RNA1(ΔB2)-E214,T7-RNA2(引物序列见表1中T7-No V_RNA1-F和T7-No V_RNA1-R;T7-No V_RNA2-F和T7-No V_RNA2-R),以上述DNA片段为体外转录模板,使用Invitrogen公司的MEGAscript®Kit进行体外转录和纯化(方法见产品说明书),使用New England Bio Labs公司的Vaccinia Capping System对体外转录得到的RNA进行加帽(方法见产品说明书)得到重组病毒的基因组RNA:RNA1-E214,RNA1(ΔB2)-E214以及RNA2。
1.2.3 RNA转染
提前18~24 h铺细胞于六孔板,实验方法见试剂(TransIT®-m RNA Transfection Kit)说明书。
1.2.4 反转录和荧光定量PCR检测病毒核酸水平
使用TRIzol法提取样品总RNA,取1μg RNA使用Vazyme公司的HiScript®Ⅲ1st Strand cDNA Synthesis Kit进行反转录得到cDNA,将cDNA稀释并使用ChamQ Universal SYBR qPCR Master Mix进行qPCR检测,使用基因特异性引物进行扩增,以Actin基因作为内参,引物序列见表2。
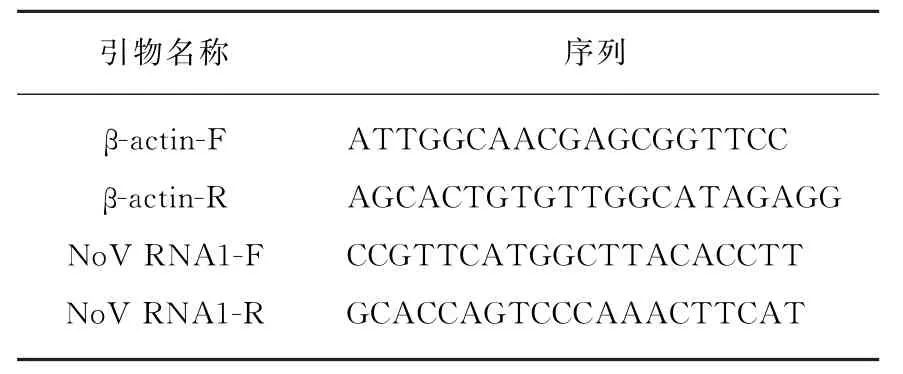
表2 荧光定量引物Tab.2 Primers for fluorescent quantitative
1.2.5 Western blot
用SDS-聚丙烯酰胺凝胶电泳检测相关蛋白表达,转膜,封闭,加入一抗,二抗,结束后加入显影液,用Bio-Rad凝胶成像系统进行显影。
1.2.6 在BHK-No V_B2细胞,BHK-Ebola_VP35细胞中包装重组病毒
(1) 向细胞转染1μg RNA1-E214/RNA1(ΔB2)-E214和2μg RNA2,转染8 h后补加3 m L完全培养基,置于30℃,5%CO2培养箱中培养。4 d后收样,样品记为第1代。
(2)Western blot检测第1代样品中Rd RP,Capsid,B2蛋白表达情况。
(3) 将第1代样品提取的总RNA再次转染细胞进行病毒包装,4 d后收样,样品记为第2代。
(4) 重复RNA提取和转染,直到Western blot检测到明显的Rd RP,Capsid,B2蛋白表达为止。
(5) 对相应代数的总RNA样品进行RT-PCR,通过设计B2-E214上下游附近引物对E214片段进行检测(序列见表1中No V_B2-E214-F和No V_B2-E214-R),TA克隆测序验证重组序列。
1.2.7 小鼠感染重组病毒,方法及剂量参考前期实验结果[35]
(1) 收集含包装好的重组病毒的细胞培养液,冻融3次,12 000g离心10 min取上清病毒液。
(2) 通过腹腔注射,将50μL病毒液(含7×106拷贝的No V RNA1)的注射到7日龄AG6乳鼠中。
(3) 观察小鼠状态,取后腿肌肉组织,TRIzol法提取RNA和蛋白质。
(4)Western blot检测病毒蛋白表达情况;RT-qPCR对病毒基因组进行定量,引物序列见表2;RTPCR检测E214重组情况。
2 结果与分析
2.1 构建重组质粒
用限制性内切酶NheⅠ酶切质粒p MT-RNA1和p MT-RNA1(ΔB2),并通过琼脂糖凝胶电泳鉴定酶切产物(图2(a)),PCR扩增产物E214(图2(b))。通过将上述DNA片段进行同源重组得到质粒p MTNo V_RNA1-E214,p MT-No V_RNA1(ΔB2)-E214质粒。重组质粒经测序确认正确。
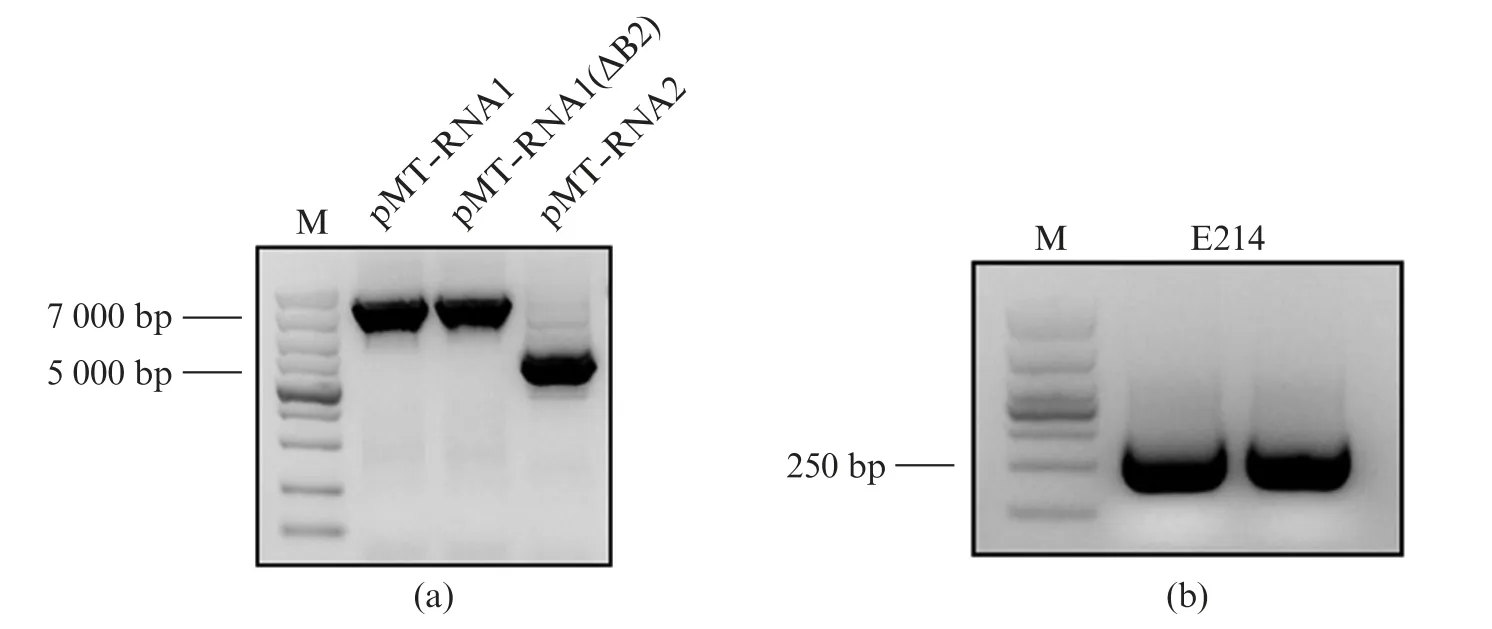
图2 重组片段鉴定Fig.2 Identification of recombinant fragments
2.2 体外转录NoV基因组
p MT-No V_RNA1-E214,p MT-No V_RNA1(ΔB2)-E214,p MT-No V_RNA2经过PCR、体外转录、RNA纯化、加帽修饰、RNA纯化得到基因组RNA1-E214,RNA1(ΔB2)-E214以及RNA2。经琼脂糖凝胶电泳(图3)检测,转录出的RNA在每一个过程中均保持完整未降解。
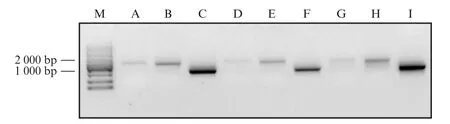
图3 体外转录产物鉴定Fig.3 Identification of in-vitro transcripts
2.3 BHK-NoV_B2细胞拯救重组病毒及AG6乳鼠感染实验
将体外转录加帽后得到的RNA1(ΔB2)-E214和RNA2,RNA1-E214和RNA2共转染到稳定表达No V-B2蛋白的BHK细胞系(BHK-No V_B2细胞)中,进行两轮扩增得到重组病毒(No V(ΔB2)-E214-FB2和No V-E214-FB2),均检测到了No V的RdRp,Capsid蛋白,以及细胞稳定表达的B2蛋白,拯救RNA1-E214和RNA2的细胞中还检测到了B2-E214融合蛋白(图4)。上述实验结果表明在BHK-No V_B2细胞中成功拯救重组病毒。
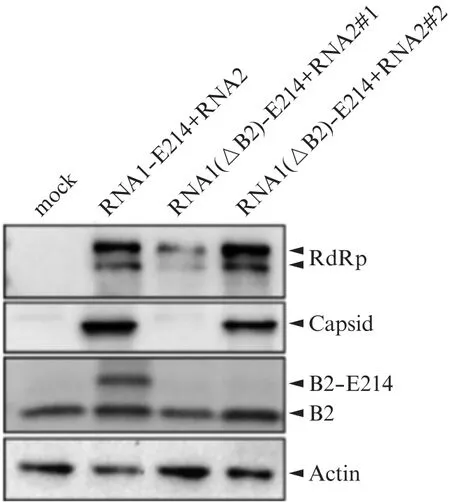
图4 在BHK-No V_B2细胞中拯救No V(ΔB2)-E214-FB2和No V-E214-FB2Fig.4 Rescue of No V(ΔB2)-E214-FB2 and No V-E214-FB2 in BHK-No V_B2 cells Western blot检测NoV的RdRp,Capsid,B2蛋白表达情况.
将BHK-No V_B2细胞第2轮拯救出的No V(ΔB2)-E214-FB2培养上清液腹腔注射到AG6鼠中,两只鼠均第4天死亡,在其后腿肌肉组织中检测到Rd Rp,Capsid蛋白,但同时还检测出No V(ΔB2)-E214-FB2无法表达的B2蛋白(图5(a)),这些野生型B2可能来自于细胞源的B2 mRNA和重组病毒发生了重组所致。同样将BHK-No V_B2细胞第2轮拯救出的No V-E214-FB2培养上清液腹腔注射到AG6鼠中,分别在第2天和第5天取样,第2天检测到微弱的B2-E214表达;第5天检测到RdRp,Capsid以及B2-E214重组蛋白,同时检测到缺失了E214片段的B2蛋白(图5(b))。
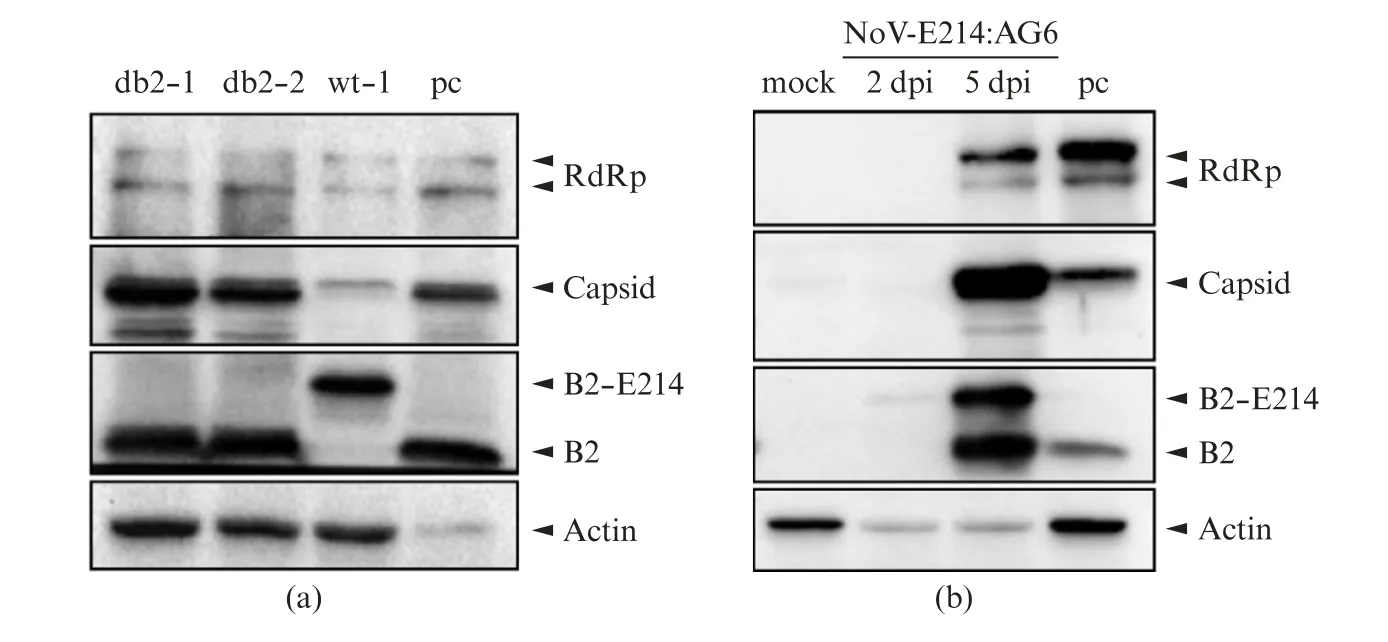
图5 AG6乳鼠注射BHK-No V_B2细胞来源重组病毒的蛋白水平Fig.5 Protein level of AG6 suckling mice injected with recombinant virus from BHK-No V_B2 cell
2.4 BHK-Ebola_VP35细胞拯救NoV(ΔB2)-E214-FVP35及AG6乳鼠感染实验
为了防止病毒通过重组细胞来源的B2 m RNA而恢复成野生型病毒,我们将RNA1(ΔB2)-E214和RNA2转染到稳定表达Ebola_VP35蛋白的BHK细胞系(BHK-Ebola_VP35)中,做两个重复组(#1和#2),直到第3轮扩增之后才检测到Rd Rp,Capsid蛋白,并且没有检测到B2蛋白(图6,见第632页)。将第3轮扩增No V(ΔB2)-E214-FVP35的BHK-Ebola_VP35细胞培养上清液腹腔注射到7日龄AG6乳鼠中,分别于第2,3,5,6,7天取乳鼠后腿肌肉样本,然后对后腿肌肉组织中No V基因组RNA1进行荧光定量检测,结果显示乳鼠在接毒后第2天后有较高的病毒积累量,第3,5,6,7天检测到的病毒积累量较低(图7,见第632页)。因为该重组病毒为B2缺陷型病毒,当去除病毒的抑制蛋白B2时,小鼠体内的抗病毒RNAi系统会将病毒逐步清除,因此后续病毒积累量较低。
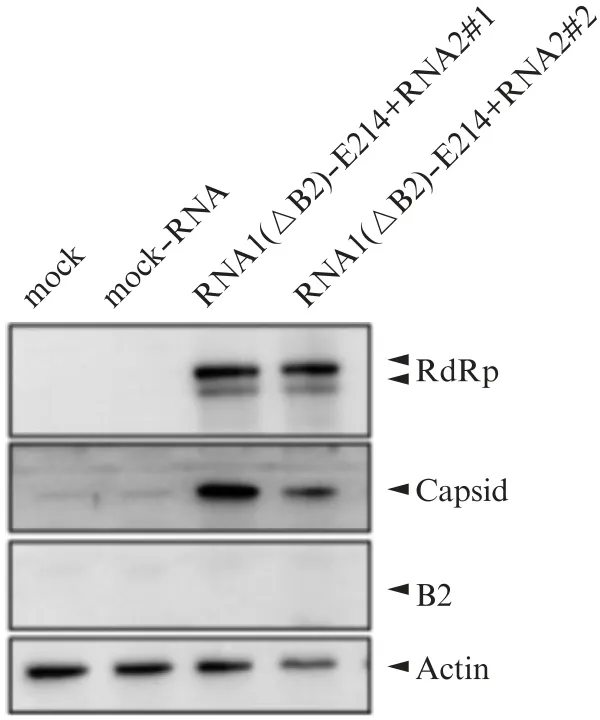
图6 在BHK-Ebola_VP35细胞中拯救No V(ΔB2)-E214-FVP35Fig.6 Rescue of No V(ΔB2)-E214-FVP35 in BHK-Ebola_VP35 cells Western blot检测No V的RdRp,Capsid,B2蛋白表达情况。
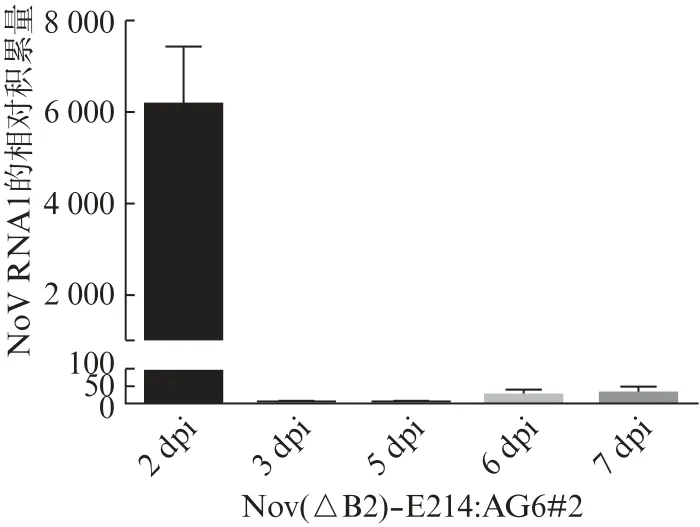
图7 AG6鼠注射No V(ΔB2)-E214-FVP35(BHKEbola_VP35细胞来源)的荧光定量结果Fig.7 RT-qPCR results of AG6 suckling mice injected with No V(ΔB2)-E214-FVP35
2.5 感染NoV(ΔB2)-E214-FVP35 AG6乳鼠肌肉组织的vsiRNAs特征
前面实验结果已经确定了重组病毒的病毒感染情况,我们对感染重组病毒No V(ΔB2)-E214-FVP35第2天的乳鼠肌肉组织样品进行小RNAs深度测序。经生物信息学分析,后腿肌肉样品的总siRNA分布符合标准特征(图8(a),见第632页),vsiRNA具有22 nt长度富集且正负链来源的vsiRNAs的数量接近(图8(b)),将21~23 nt的vsiRNA匹配到病毒基因组后,我们发现E214片段可以产生vsiRNA(图8(c)),经分析靶向EGFP的vsiRNA占总21~23 nt vsiRNA的15.19%。以上结果表明,重组病毒No V(ΔB2)-E214-FVP35感染乳鼠能够检测到vsiRNA,且含有匹配到外源E214片段的vsiRNA。
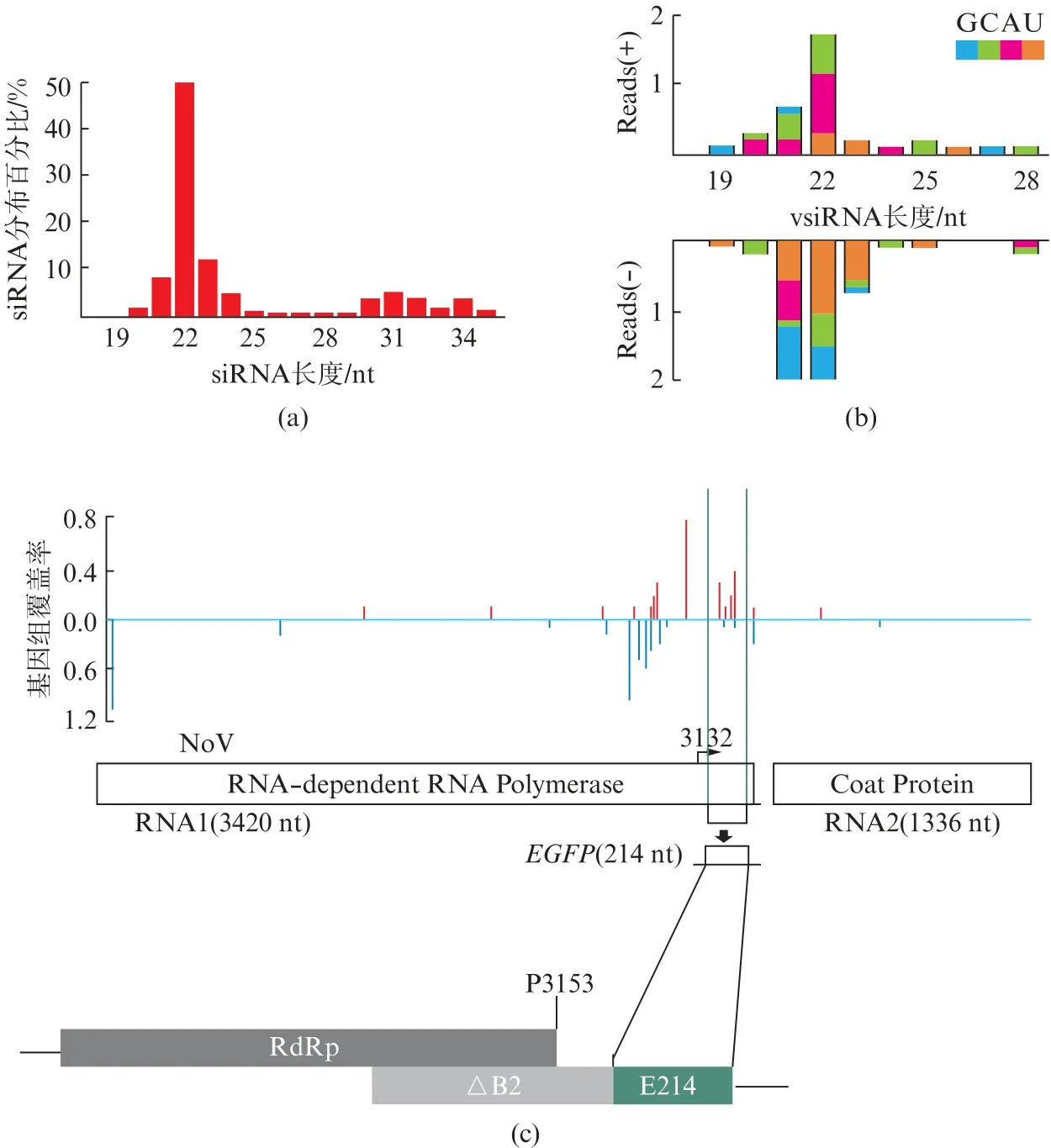
图8 感染No V(ΔB2)-E214-FVP35的AG6乳鼠后腿组织中sRNAs的特征Fig.8 Characteristics of sRNAs in hind leg tissue of AG6 suckling mice infected with No V(ΔB2)-E214-FVP35
2.6 检测重组病毒NoV(ΔB2)-E214和NoV-E214的重组片段完整性
在E214基因片段的上下游设计引物,对细胞和乳鼠组织样品进行RT-PCR,选取PCR产物进行TA克隆,判断E214重组情况。经琼脂糖凝胶电泳检测,BHK-NoV_B2细胞拯救的重组病毒NoV-E214-FB2第1代和第2代均含有完整的E214片段(图9(a),泳道6~7),感染对应病毒的AG6乳鼠,第2天的样品含有完整的E214片段(图9(b),泳道1),但是第5天出现了不同程度的缺失(图9(b),泳道2)。BHK-Ebola_VP35细胞拯救的No V(ΔB2)-E214-FVP35重组病毒在细胞水平未出现片段缺失(图9(a),泳道3~5),AG6乳鼠仅在接毒后第2天检测到E214片段(图9(b),泳道3),第3~7天均未检测到明显片段(图9(b),泳道4~7)。我们将上述出现片段缺失的样品(图9(b)中的泳道1,2对应的样品)进行TA克隆后测序,发现片段缺失的区域集中在E214片段以及插入位点的上游(图9(c))。感染小鼠组织中检测到NoV重组病毒在插入位点附近产生的缺失现象可能是病毒具有某种自我修复机制,控制着病毒的结构和基因组的长度。

图9 重组病毒No V(ΔB2)-E214-FVP35和No V-E214-FB2的重组片段完整性的检测Fig.9 Detection of the integrity of No V(ΔB2)-E214-FVP35 and No V-E214-FB2
3 讨论
目前RNAi逐渐发展为一项成熟的基因沉默技术,在植物、昆虫中能产生序列特异性的RNAi抑制现象[1,11],然而在哺乳动物中dsRNA虽然能诱发RNAi,但是它还能通过启动干扰素、蛋白激酶R等途径非特异性关闭蛋白表达甚至导致细胞凋亡[41-43]。2001年Elbashir等[16]通过直接转染siRNA成功抑制目的基因的表达,自此siRNA成为哺乳动物中应用最广泛的RNAi效应物。目前常用的病毒载体包装操作复杂且存在潜在的致癌风险,现有的siRNA递送技术仍然不够成熟。
野田村病毒属的病毒基因组简单且感染宿主类型多样,被广泛用于病毒相关的研究,其中具有代表性的是Flock House Virus(FHV),FHV可以作为载体在植物、昆虫等细胞中表达外源基因:Dasgupta等[44-45]成功以FHV基因组为载体,在果蝇细胞和成年蚊子中表达GFP,证明了基于FHV的载体在蚊子和其他昆虫中表达外源基因的潜力,Taning等[46]发现在FHV基因组中插入外源序列可在受感染的细胞中产生特异性的RNAi效应。由于FHV不能感染哺乳动物,而No V是同属病毒中唯一能够感染哺乳动物的病毒[30],因此我们选用No V作为siRNA递送系统的病毒载体。前期结果表明No V(ΔB2)病毒感染新生乳鼠时,在乳鼠体内可以产生大量的vsiRNAs,这些vsiRNAs进入AGO蛋白,可以特异性抑制同源病毒复制[35,40]。目前重组外源基因的No V拯救实验还未见报道,本研究构建了以No V、No V(ΔB2)为载体的新型siRNA呈递系统,在BHK-No V_B2和BHK-Ebola_VP35细胞中成功拯救出重组病毒No VE214和No V(ΔB2)-E214,且重组病毒能够有效感染AG6乳鼠;在感染No V(ΔB2)-E214-FVP35的AG6乳鼠肌肉组织中可以检测到匹配到外源E214片段上的vsiRNA,证明该系统具有特异性抑制目的基因表达的良好潜力。
在我们初期的实验中,从稳定表达B2抑制子的细胞中成功拯救出No V-E214-FB2和No V(ΔB2)-E214-FB2重组病毒,但是在感染乳鼠后都能检测到野生型的B2蛋白,这些野生型B2可能来自于细胞源的B2 m RNA和重组病毒发生了重组所致,这种恢复突变往往会对后续试验造成影响。该现象可以通过表达异源的抑制子蛋白得到改善。确实,当我们在稳定表达异源抑制子蛋白VP35蛋白的细胞中拯救No V(ΔB2)-E214-FVP35重组病毒成功后,没有检测出野生型的B2蛋白,说明异源抑制子的拯救系统是合理可行的。野生型病毒中插入异源RNA片段,会对病毒本身的一些基因组二级结构或者功能造成某些影响,病毒会在复制过程中进行一定的自我修复。我们的实验结果也证实了这一点,从感染小鼠组织中可以检测到重组的No V病毒在插入位点附近产生了一定的缺失现象,这种缺失会影响到插入外源片段的完整性,从而造成产生目的siRNA的丰度变低。那么在野生型No V病毒中插入异源片段的大小和位置都需要进行大量的尝试,最终找到一些最优的插入位点和适合的插入长度范围,最大程度提高外源siRNA的递送能力。另外,No V病毒本身的一些生物学特征也需要进一步了解,比如病毒特异性感染的组织,感染效率等,这些都会影响到递送载体的靶向性和效率。

