聚乳酸-羟基乙酸共聚物纳米粒载中药抗肿瘤成分的研究进展
黄华婷,蔡梦如,付 京,刘 晶,孙铭忆,游龙泰,郎晓雪,胡雪凌,王开心,倪 健*,董晓旭*
聚乳酸-羟基乙酸共聚物纳米粒载中药抗肿瘤成分的研究进展
黄华婷1,蔡梦如1,付 京2,刘 晶1,孙铭忆1,游龙泰1,郎晓雪1,胡雪凌1,王开心1,倪 健1*,董晓旭1*
1. 北京中医药大学中药学院,北京 102488 2. 首都医科大学附属北京中医医院,北京市中医药研究所,北京 100010
聚乳酸-羟基乙酸共聚物(poly lactic-co-glycolic acid,PLGA)是由乳酸和羟基乙酸单体按所需比例聚合而成的有机材料,具有可生物降解性和良好的生物相容性、结构可修饰性、释药速度可控等优点,被广泛用于药物递送领域。随着对活性物质研究的深入,中药抗肿瘤成分被证实具有高效、低毒的优势,成为肿瘤治疗领域的研究热点。近年来,通过乳化溶剂挥发法、复乳法、沉淀法、透析法成功将中药抗肿瘤成分负载在PLGA纳米粒中,应用于改善药物的性质、靶向递药系统、免疫佐剂等领域。综述PLGA纳米粒载中药抗肿瘤成分的制备和应用进展,以期为中药抗肿瘤成分的新型递药系统研究提供参考。
聚乳酸-羟基乙酸共聚物;中药;抗肿瘤;制备方法;靶向递药;免疫佐剂
据文献报道,2022年我国恶性肿瘤的新发病人数将近482万,死亡人数约为321万,发病率和死亡率均居世界之首[1]。临床常用的治疗手段主要包括药物治疗(化学治疗、内分泌治疗、免疫治疗)、放疗和手术切除等。药物治疗是目前临床治疗肿瘤最常用的方法,但由于其缺乏特异性、副作用大、容易产生耐药,往往导致疗效不理想[2]。放疗是通过电离辐射破坏细胞的DNA来消除癌细胞,同时也会杀伤正常细胞[3]。手术切除作为一种局部治疗手段,残留的癌细胞往往引起癌症复发[3]。中医药是中华民族的传统瑰宝,在肿瘤治疗中具有独特优势,其注重“整体观念”和“标本兼治”,目标是在杀灭肿瘤细胞的同时提高机体免疫力,防止肿瘤复发。近年来,中药活性成分成为了肿瘤领域研究的热点,其作用机制得到了更全面、更深入地研究。以紫杉醇为例,其通过抑制肿瘤细胞增殖、侵袭与转移,促进稳定微管结构,抑制肿瘤细胞血管生成,诱导肿瘤细胞周期阻滞、凋亡和自噬,调节免疫等多种机制发挥抗肿瘤作用,涉及磷脂酰肌醇-3-羟激酶(phosphatidylinositol-3-hydroxykinase,PI3K)/蛋白激酶B(protein kinase B,Akt)、丝裂原活化蛋白激酶(mitogen activated protein kinases,MAPK)、细胞外信号调节激酶(extracellular signal-regulated kinase,ERK)、氨基末端激酶(jun kinase,JNK)、p38、核因子-κB(nuclear factor-κB,NF-κB)、Toll样受体4(Toll-like receptor 4,TLR4)/髓样分化因子88(myeloid differentiation factor 88,MyD88)、Janus激酶2(Janus kinase 2,JAK2)/信号转导和转录激活因子3(signal transducer and activator of transcription 3,STAT3)等多种信号通路[4-5]。与传统的药物治疗相比,中药抗肿瘤成分具有多靶点、多途径、多层次、不良反应小、逆转耐药等特点,能提高抗肿瘤疗效并减少不良反应的发生。
然而,中药活性成分性质通常存在一定局限性,如溶解度差、性质不稳定、治疗窗狭窄、半衰期短、靶向性差等,严重限制了其临床应用。聚乳酸-羟基乙酸共聚物(poly lactic-co-glycolic acid,PLGA)由乳酸和羟基乙酸单体按所需比例聚合而成,是一种被美国食品药品监督管理局(FDA)批准的高分子纳米材料[6],结构见图1。与其他传统的纳米材料相比,PLGA具有良好的生物可降解性、生物相容性、无毒性、成囊成膜性、缓释性和可修饰性等特点,已被广泛用作抗肿瘤药物的载体[7]。PLGA是一种脂溶性的载体,不溶于水,溶于醋酸乙酯、二氯甲烷、四氢呋喃、六氟异丙醇、氯仿、苯甲醇、丙酮等有机溶剂,其释药速度主要由聚合物的降解速率控制,取决于聚合物的相对分子质量和聚合比。目前常见的聚合比有50∶50、65∶35、75∶25、85∶15,相对分子质量通常在5000~150 000,其中50∶50的聚合比在体内的自然降解速度最快[8]。因此,通过调整PLGA的聚合比和相对分子质量,控制药物不同程度地缓慢释放,可以满足不同的释药速率需求。基于PLGA结构的可修饰性,学者们对其进行结构修饰或功能化修饰,以扩展PLGA的应用范围。如用亲水性的聚乙二醇(polyethylene glycol,PEG)修饰亲脂性的PLGA,形成双亲性嵌段共聚物(PEG-PLGA),提高了PLGA的水溶性并实现长循环[9];在PLGA表面修饰靶头、敏感基团等,实现药物的肿瘤靶向性[10-11]。

图1 PLGA的化学结构
PLGA已被成功用于装载脂溶性、水溶性的中药抗肿瘤成分,涉及的剂型包括胶束[12]、纳米粒[13]、微球[14]、凝胶[15]等,克服了中药活性成分的自身局限性。PLGA通过物理包埋或化学偶联的方式负载各类药物,化学偶联主要取决于药物分子能否与PLGA上的羟基、羧基基团形成某种稳定化学键。目前,PLGA以化学偶联负载中药抗肿瘤成分的报道较少,学者们主要通过乳化溶剂挥发法[16]、复乳法[17]、纳米沉淀法[18]、透析法(dialysis method)[19]等制备PLGA纳米粒,实现对药物的物理包埋。近年来,PLGA纳米粒载中药抗肿瘤成分的应用取得了一定的进展,在改善药物性质、靶向系统、免疫佐剂等领域均有较多的文献报道。本文将对PLGA纳米粒载中药抗肿瘤成分的制备方法和应用进行综述,以期为开发更高效的中药抗肿瘤成分递送系统提供参考。
1 PLGA载中药抗肿瘤成分的制备方法
1.1 乳化溶剂挥发法(emulsion-solvent evaporation method)
乳化溶剂挥发法是将水相和有机相通过超声乳化或搅拌等方法制备成乳剂,再将有机相挥干,使分散相包裹药物析出形成纳米粒。乳化溶剂挥发法具有制备简单、可重复性强等优点,是目前制备PLGA纳米粒最常用的方法,尤其适合用于负载紫杉醇[16]、姜黄素[20]、胡桃醌[21]等疏水性中药抗肿瘤成分。乳剂的制备包括水相、有机相和乳化剂,常用的有机相有二氯甲烷、氯仿等。聚乙烯醇(polyvinyl alcohol,PVA)、泊洛沙姆188、血清白蛋白是较常使用的乳化剂。有研究表明,超声功率、超声时间、投药比、乳化剂的种类和用量、有机相种类、油水比例、PLGA相对分子质量和聚合比等因素均有可能影响纳米粒的粒径、载药量和包封率[22-24]。
1.2 复乳法(double emusion method)
复乳法是在传统乳化溶剂挥发法的基础上改进的一种方法,用于改善水溶性药物在PLGA纳米粒中载药量、包封率低等问题,主要用于装载中药多糖、皂苷类等活性成分。复乳法需要经过2次乳化,第1次是将溶有水溶性抗肿瘤成分的内水相逐滴加到溶有PLGA的油相中,通过超声制备水包油型初乳(O/W);第2次是将初乳逐滴加到含有稳定剂的外水相中,超声得到稳定的水包油包水型复乳(W/O/W),最后将有机溶剂挥干即可。研究表明,通过复乳法已经成功将桑枝多糖[17]、猴头菌多糖[25]、氧化苦参碱[26]等水溶性单体成分负载在PLGA中,纳米粒粒径多为0~200 nm,包封率跟药物本身的理化性质密切相关,如猴头菌多糖包封率高达90.86%,而氧化苦参碱的包封率仅为44.8%。此外,学者们通过复乳法成功将复方总黄酮[27]、野菊花总黄酮[28]等有效部位负载在PLGA中,但相对来说粒径较大。复乳法通过2次乳化作用,为实现不同溶解性药物的共载提供了条件。Zhang等[29]将丹酚酸B和丹参酮IIA分散在油相中,将三七总皂苷分散在水相中,通过复乳法构建了负载丹参-三七复方多组分纳米粒。Wang等[30]以两亲性共聚物聚乙二醇单甲醚(monomethoxy poly ethylene glycol,mPEG)-PLGA为载体,通过改良的复乳法制备共载水溶性阿霉素和脂溶性紫杉醇的纳米粒,其粒径约为243 nm。
1.3 沉淀法(nanoprecipitation method)
纳米沉淀法具有操作简单、避免含氯溶剂和细胞超声破碎机的使用、减少对人体的伤害和环境污染的优点,但重复性较差。该法制备步骤是先将PLGA和药物共同溶于与水相溶的有机溶剂,比如丙酮,然后在搅拌下将此溶液逐滴加到含有表面活性剂的水相中,最后挥干有机溶剂即可得到纳米粒。此法的制备原理是当有机相与水相混合时,产生界面张力,通过溶剂的挥发降低界面张力,促使药物和PLGA逐渐向界面移动并发生沉淀,最终形成纳米粒。纳米沉淀法虽然不是主流的方法,但已有文献报道将此法成功应用于装载不同溶解性的中药抗肿瘤成分。商云霞等[18]采用纳米沉淀法制备负载水溶性的三七皂苷R1纳米粒,制得的纳米粒形态良好、分散均匀,粒径在150 nm左右,具有适宜的包封率和载药量。Alshamsan等[31]比较通过纳米沉淀法、乳化溶剂挥发法、复乳法制备的葫芦素I纳米粒,发现粒径相似,载药量具有较大差异,分别是(12.20±2.37)%、(0.37±0.07)%、(0.99±0.08)%,说明纳米沉淀法能更有效地将葫芦素I负载在PLGA中。
1.4 透析法
透析法适用于装载脂溶性的中药抗肿瘤成分。透析法制备纳米粒包括3个步骤[19]:首先是缔合,透析开始时外水相进入透析袋内,聚合物分子不断聚合,将脂溶性药物包裹,形成无规则的聚合物颗粒;其次是壳核球形纳米粒的形成,随着透析袋的水量增加,聚合物大颗粒分裂成小颗粒;最后是纳米粒的固化,随着透析袋内水量的不断增大,纳米粒分子间距减小,由溶胀状态变成固化状态,将药物紧紧的包裹在PLGA纳米粒内。此法所制备的纳米粒相对均匀、粒径较小,王岩等[32]制备的共同装载吴茱萸碱和Fe3O4的纳米粒以单个球形粒子形式分散,粒径小于100 nm。此外,许浩云等[19]采用改良透析法成功制备羟基喜树碱单甲氧基聚乙二醇(methoxy-polyethylene glycol,MePEG)-PLGA纳米粒。
除了上述常用的方法外,PLGA纳米粒的制备方法还包括盐析法[33]、薄膜水化法[34]、高压匀质法[35]等。近年来,不同方法在PLGA负载中药活性成分中的应用见表1。不同的制备方法对溶解性不同的药物包载效率不同,简单来说,负载的前提是“相似相溶”原理,故可以通过药物性质选择合适的制备方法,在此基础上对具体制备工艺参数进行优化,以提高药物的包载效率。然而,PLGA纳米粒载中药抗肿瘤成分也遇到了一系列亟需解决的问题:(1)载药量较低,通常在15%以内,给药时往往需要较大的剂量;(2)制备过程中使用有机溶剂以及纳米粒中残留有机溶剂,均会对人体产生毒副作用;(3)在大规模生产中需要保证方法的重现性和制剂的贮藏稳定性。
2 PLGA载中药抗肿瘤成分的应用
2.1 在改善药物性质中的应用
与化疗药物相比,中药活性成分具有多层次、多靶点、多途径、不良反应小的优势,但因其水溶性低、性质不稳定、治疗窗狭窄、释药速度不理想等,导致体内药物疗效不理想,限制了其开发和利用。基于PLGA良好的载体性能,科学家们通过物理包埋方式将其负载各类中药活性成分,以改善其药物性质。
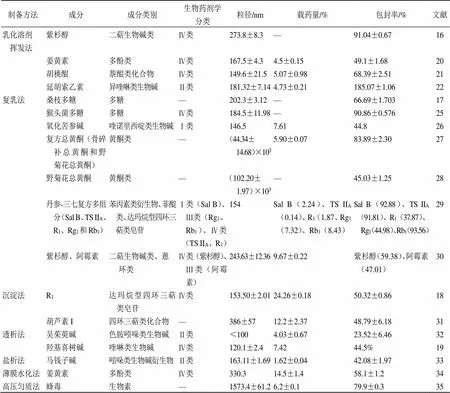
表1 不同方法在PLGA负载中药活性成分中的应用
Sal B-丹酚酸B TS IIA-丹参酮IIAR1-三七皂苷R1Rg1-人参皂苷Rg1Rb1-人参皂苷Rb1—表示无相关参考来源
Sal B-salvianolic acid B TS IIA-tanshinone IIAR1-notoginseng saponin R1Rg1-ginsenoside Rg1Rb1-ginsenoside Rb1—no reference source is available
低溶解性直接限制了许多疏水性中药抗肿瘤成分的开发和利用,因此改善药物的溶解性是实现高效抗肿瘤的第1步。姜黄素是从姜科植物姜黄提取分离得到的黄色多酚类物质,已被证实对多种恶性肿瘤具有显著的抑制作用。然而由于姜黄素水溶性差(水中溶解度仅为11 μg/L)、药物生物利用度低,给药后难以达到预期的疗效。Xie等[36]利用改良的乳化溶剂挥发法将姜黄素包封在PLGA中,其水溶性是游离姜黄素的640倍,其相对生物利用度提高了5.6倍。葫芦素B是葫芦科植物中的主要抗肿瘤成分,临床上主要用于治疗原发性肝癌和肝炎。然而葫芦素B在结构上属于四环三萜类化合物,在水中的溶解度只有0.155 μg/mL。方宁[37]通过乳化溶剂挥发法制备葫芦素B纳米粒,有效改善了葫芦素B的溶解度。良好的结构稳定性是药物发挥疗效的关键,在非作用部位过早地降解失活是肿瘤治疗失败的主要原因。内酯环结构是羟基喜树碱及其衍生物的发挥抗肿瘤作用的主要官能团,在生理pH值条件下容易开环而失活。Shenderova等[38]通过乳化溶剂挥发法将10-羟基喜树碱包裹在PLGA中,并评价内酯环的稳定性。结果表明,在模拟生理环境条件下(pH 7.4,=37 ℃),将近80%的10-羟基喜树碱裸药在2 h内发生内酯环开环,而PLGA微球中超过95%的10-羟基喜树碱在2个月内保持其活性内酯形式。由此推测PLGA将药物包封在核内,使其对外界环境的敏感性减低,从而提高稳定性。以上研究证明,PLGA能改善药物的溶解度和稳定性,提高其生物利用度,这为疏水性和结构不稳定性中药抗肿瘤成分的研究与开发提供了新的思路。
部分有毒中药活性成分由于治疗窗狭窄,容易引起毒性反应,使其在临床上的应用受到了极大限制。对于毒性药物而言,传统制剂无法控制药物的释放速度,往往导致毒性反应的发生,因此缓释制剂受到了广泛关注。马钱子碱是剧毒性中药马钱子的主要活性成分,具有显著的抗肿瘤、镇痛、抗炎等药理作用。管庆霞等[33]采用沉淀法成功制备马钱子碱纳米粒,该纳米粒具有良好的缓释作用,释药速度符合Higuchi方程。雷公藤甲素是从大毒中药雷公藤中分离得到的高效抗肿瘤成分,是目前抗肿瘤领域研究的热点。车坷科等[39]用乳化溶剂挥发法制备雷公藤甲素PLGA微球,并对其体外释放进行考察。研究表明,雷公藤甲素PLGA微球能够实现缓慢释放,在第10 d时,总累积释放率达到62.14%。Zeng等[40]制备去甲斑蝥素PLGA纳米粒,释放结果显示,该纳米粒在最初时间存在突释效应,之后缓慢持续释放去甲斑蝥素10 d以上。毒性实验表明,游离去甲斑蝥素的半数致死量为(25.4±1.9)mg/kg,而去甲斑蝥素纳米粒为(66.7±3.9)mg/kg,说明后者具有更高的耐受性。此外,进一步研究显示,去甲斑蝥素纳米粒对肝癌模型和肺癌模型小鼠表现出更高的抑瘤率。这结果有力地说明了通过将去甲斑蝥素负载在PLGA纳米粒中,达到了减毒增效的目的。通常来说,药物从PLGA载体释放需要经过2个阶段,首先靠近载体表面的药物溶解释放,其次随着载体骨架的溶蚀,负载在空腔内部的药物逐步释放,这2个阶段不断进行,最终实现药物的持续缓慢释放。但包埋在载体中的部分药物由于扩散路径极短以及在制备过程中载体外表面可能会吸附游离药物而存在突释效应。上述研究表明,将有毒中药负载在PLGA中控制其释药速度,是减小药物毒性反应的策略之一。
现代药理研究表明,中药多糖具有显著的抗肿瘤活性,且对机体无不良反应[41]。然而中药多糖易溶于水,在体内代谢迅速,难以维持有效浓度。山药多糖是山药的活性成分之一,已被证实具有抗肿瘤、免疫调节、降血糖等作用。Luo等[42]将山药多糖包裹在PLGA纳米粒中有效减缓了山药多糖的释放,在48 h的累积释放量为53.41%。Gu等[43]通过复乳法成功制备当归多糖PLGA纳米粒,与游离当归多糖相比,该纳米粒在体外可显著增强淋巴细胞的增殖能力,提高CD4+/CD8+T细胞比率。此外,PLGA亦为水溶性皂苷类中药抗肿瘤成分的递送提供了选择。商云霞等[18]通过沉淀法将三七皂苷R1包裹在PEG-PLGA中制成缓释制剂,减缓三七皂苷R1的释放速率。上述研究得出,PLGA递药系统的出现,改善了水溶性中药抗肿瘤成分半衰期短、作用范围不集中、生物利用度低的缺陷,促进其在肿瘤领域的研究和应用。
2.2 在靶向递药系统中的应用
靶向给药系统(targeting drug systems,TDS)是指利用载体将药物通过局部或全身血液循环而浓集于特定靶组织、靶器官、靶细胞的给药系统,旨在提高抗肿瘤疗效的同时减少对正常组织的损伤[44]。基于PLGA的靶向策略主要包括被动靶向、主动靶向、物理化学靶向(pH响应型、氧化还原型、离子响应型、磁响应型、温度敏感型、光照响应型)、基因递送和仿生修饰等。
2.2.1 被动靶向递药系统 被动靶向制剂又称自然靶向制剂,载体上不含有特异性作用的配体,通过正常的生理过程将药物传递至靶部位,从而实现靶向性。粒径大小影响制剂对不同部位的靶向性,通常粒径小于7 μm的微球可被肝、脾中的单核巨噬细胞摄取;7~10 μm以及粒径更大的微球通常会被肺部的最小毛细血管床机械性截留,从而使药物浓集于肺;200~400 nm的纳米粒集中于肝后迅速被清除,小于10 nm的纳米粒则缓慢集于骨髓。因此,控制PLGA纳米粒的粒径在10~200 nm,由于其增强的实体肿瘤渗透性和滞留效应而被动靶向至肿瘤组织[45]。岳武恒等[21]采用乳化溶剂挥发法制备胡桃醌PLGA纳米粒,其平均粒径为(149.6±21.5)nm,具有良好的缓释特性。体外细胞摄取和体内活体成像实验均表明PLGA纳米粒相较于裸药具有良好的穿透和靶向性能,且由于纳米粒缓释特点,药物可从PLGA中缓慢释放于肿瘤组织,提高抗肿瘤效率。刘丹等[46]构建粒径为118.4 nm的马钱子碱mPEG-PLGA纳米粒,该纳米粒对肝癌HepG2细胞具有较强的主动摄取能力和抗增殖活性。
2.2.2 主动靶向递药系统 在PLGA结构表面修饰靶向配体即可实现主动靶向。基于叶酸受体在正常细胞中低表达,但在大部分肿瘤细胞中高表达的特点,学者们将叶酸修饰在PLGA表面实现了主动靶向。李新健等[47]通过乳化溶剂挥发法制备载紫杉醇的叶酸靶向纳米胶束(PTX@FA-PLGA-NMs),并进行体外抗肿瘤评价。在宫颈癌HeLa细胞摄取实验中,负载RHB荧光剂的PTX@FA-PLGA-NMs纳米胶束在细胞内的荧光强度明显强于无叶酸修饰的纳米胶束。该结果表明叶酸修饰的纳米胶束具有主动靶向功能,能够大量聚集在肿瘤细胞内。利用多肽的主动靶向功能,将多肽与PLGA聚合物偶联是实现药物靶向性的重要策略之一。李学娟等[10]首先通过硫醇化法合成穿膜肽[c(CRGDKGPDC),iRGD]-PEG-PLGA,然后用纳米沉淀法制备姜黄素靶向纳米粒(iRGD-PEG-PLGA/Cur-Np)。细胞摄取实验和裸鼠活体成像均表明经过iRGD修饰的姜黄素纳米粒具有较好的穿透性和靶向性,使姜黄素更好地富集于肿瘤细胞的细胞核周围。Fan等[48]将B6多肽偶联到负载姜黄素的PEG-PLGA纳米粒表面,提高了纳米粒的血脑屏障渗透性,减少APPswe/PS1dE9双转基因()小鼠海马区β-淀粉样蛋白的形成和抑制Tau蛋白的过度磷酸化,为阿尔茨海默病的治疗提供潜在备选药物。在纳米粒的表面修饰抗体或核酸适体,通过与靶细胞表面的受体特异性结合,从而实现靶向治疗。Zhou等[49]将CD206抗体偶联到载Fe3O4的PLGA纳米表面,实现了对M2型巨噬细胞的靶向性,并通过释放负载的Fe3O4促进M2型细胞向M1型极化,进而抑制肿瘤的生长。庞丽莹等[50]将CD133核酸适体偶联至紫杉醇PEG-PLGA纳米粒,促进紫杉醇纳米载体靶向递送至CD133+肺癌干细胞,显示出杀伤作用。Li等[51]用转铁蛋白对甘草酸和PLGA共同组成的载体系统表面进行修饰,提高了胡椒碱对肿瘤细胞的靶向效率。甘草次酸是从甘草中分离得到的五环三萜类化合物,已被证实具有高效、特异的肝靶向功能。Pan等[52]将甘草次酸修饰到负载青蒿内酯(artemisinin,ART)的PEG-PLGA纳米粒表面,通过甘草次酸与肝癌细胞高表达的蛋白激酶C-α受体结合,从而实现ART药物的肝脏靶向递送。乳糖酸可以与肝细胞特异性表达的去唾液酸糖蛋白受体结合,是一种靶向肝癌的特异性配基。Song等[53]用经PEG和乳糖酸改良后的壳聚糖对As2O3-PLGA纳米粒进行修饰,提高了纳米粒抗肝癌效率并减少了不良反应。自组装涂层修饰是一种制备简单、可用于多种用途的载体修饰手段,具有一定的应用前景。Sun等[54]将姜黄素PLGA纳米粒浸泡在2%的真菌疏水蛋白(hydrophobic protein,HPB)水溶液中,制得HPB包被的姜黄素PLGA纳米粒,该纳米粒比未经HPB涂层修饰的纳米粒具有更强的体内外抗肿瘤活性,但表现出一定的不良反应。分析其原因:一方面,HPB涂层的存在提高了肿瘤细胞对纳米粒的摄取,增强其抗肿瘤活性;另一方面,由于某些调理素在HPB涂层上集聚吸附,导致纳米粒通过网状内皮系统(reticuloendothelial system,RES)在肝、脾等器官中过度累积,从而表现出毒性。上述研究表明,PLGA的可修饰性是实现主动靶向的关键,理论上只要找到肿瘤细胞高表达的受体配体,就能实现药物的主动靶向递送。
2.2.3 物理化学靶向递药系统 物理化学靶向制剂是应用物理化学方法将药物输送到特定部位发挥疗效的递药系统,刺激因子包括pH、氧化还原反应、离子、磁力、温度、光照等。相比正常组织(pH 7.4),肿瘤组织由于代谢快、局部缺氧而呈现微酸环境(pH 4.5~5.5)。因此开发在酸性环境下能够快速释放药物的pH敏感型纳米粒对提高抗肿瘤效率具有重要意义。Xu等[55]利用碳酸氢铵合成pH敏感型的黄芪多糖PLGA纳米粒,该纳米粒在酸型环境中释放药物的速率比酸不敏感的黄芪多糖纳米粒的释放速率更快。研究表明,肿瘤细胞中谷胱甘肽(glutathione,GSH)的含量比正常组织或细胞外液高100~1000倍[56],这种极端的浓度差使氧化还原响应系统应运而生。氧化还原敏感化学键的引入是开发氧化还原响应系统的关键,常用的有二硫键、二硒键、单硫键、单硒键等。其中,二硫键具有易构建、稳定性好、灵敏度高的特点,应用最为广泛。Fang等[11]以二硫键为连接器连接聚乙二醇维生素E琥珀酸酯(-α-tocopheryl polyethylene glycol succinate,TPGS)和PLGA(TPGS-S−S-PLGA),同时将靶向肽APDTKTQ缀合到泊洛沙姆188(pluronic F68,F68)上(F68−APDTKTQ),通过TPGS-S−S-PLGA和F68−APDTKTQ自组装形成具有还原性响应与靶向双功能的混合胶束(TSP/FP),然后采用透析法将冬凌草甲素(oridonin,ORI)负载在TSP/FP内(ORI-TSP/FP)。实验结果显示,ORI-TSP/FP纳米粒在含有20 μmol/L二硫苏糖醇(,-dithiothreitol,DTT,还原能力与GSH类似)的介质中保持稳定,而当DTT浓度增大到10 nmol/L时则发生破裂,提示该混合胶束具有显著的还原响应能力。此外,细胞实验表明,靶向肽APDTKTQ的引入进一步提高了ORI-TSP/FP混合胶束的抗肿瘤效率。这种多级联合的靶向策略为实现抗肿瘤药物更精准、更高效地递送提供了新的思路。Cui等[57]构建具有磁靶向和转铁蛋白受体靶向的共载紫杉醇和姜黄素PLGA纳米粒,其在脑胶质瘤细胞中的摄取率增加了10倍以上,脑内递送率提高了至少5倍。纳米粒的荷电性质会影响细胞的摄取效率,通常来说,带正电荷的纳米粒更容易与带负电荷的细胞膜产生静电作用,从而增加细胞摄取药物的机会。裸PLGA纳米粒由于末端羧基的存在而带负电荷,因此对其进行离子修饰的靶向策略颇具潜力。Meng等[58]分别对防己碱甲素PLGA纳米粒进行阳离子和阴离子修饰,结果表明肺癌A549细胞对阳离子修饰的纳米粒具有更高的摄取率。另外,唐涛等[59]制备的壳聚糖修饰的丹皮酚PEG-PLGA纳米粒也体现了这一策略。
磁性靶向制剂是指利用体外磁响应导向至靶部位的制剂,也是目前研究的热点。Wang等[60]用乳化溶剂挥发法将汉防己甲素和Fe3O4磁性纳米粒子共同装载到PLGA中,制备具有磁靶向性的纳米粒。该纳米粒在外加恒磁场的作用下,实现药物的定向递送,增强抗肿瘤作用。Fe3O4除了磁靶向作用,还具有优异的磁热效应。顾加雨等[61]通过溶剂挥发法制备Fe3O4/PLGA微球,该微球在外加交变磁场作用600 s后,最高温度可达55.6 ℃,超过杀灭肿瘤细胞的临界温度42 ℃。
温度敏感型制剂通常是利用室温-体温变化实现溶液-凝胶的转变,有助于药物缓慢释放,延长药物的作用时间,常见于抗肿瘤制剂和眼部用药。Xu等[62]制备了共同负载紫杉醇和替莫唑胺的mPEG-PLGA温敏型凝胶,该温敏型凝胶对胶质瘤细胞的生长抑制率和凋亡率明显高于没有温度敏感特性的制剂。李林芝等[63]开发姜黄素PLGA温敏原位凝胶,其在兔眼房水中的生物利用度是姜黄素混悬液的2.71倍。此外,光疗在肿瘤领域也展现出良好的应用前景。Liu等[64]以吲哚青绿为光敏剂和紫杉醇共载在PLGA纳米粒中,该纳米粒在808 nm激光照射下可引发紫杉醇在肿瘤部位的急剧释放,同时达到光热治疗所需要的温度,实现高效的化疗-光疗联合抗肿瘤。
近年来,基因递送和仿生修饰为肿瘤治疗注入了新的活力。基因递送利用PLGA将外源DNA导入病灶并进行基因修改以达到治疗的目的。仿生修饰则是指将不同细胞膜包被于PLGA纳米粒表面,伪装成内源性物质,延长体循环时间,增强同源靶向能力。Xu等[65]通过用HeLa细胞膜修饰共载小干扰RNA(siRNA)和紫杉醇的PLGA纳米粒,开发了一种仿生双给药系统(Si/PNPs@HeLa)。细胞实验表明,仿生修饰提高了纳米粒的免疫逃逸能力和同源靶向能力,细胞摄取率提高了近3倍。进一步体内研究发现,该纳米粒对HeLa荷瘤小鼠有良好的协同抗肿瘤作用,肿瘤体积抑制率高达83.6%,且对主要脏器无不良反应。Si/PNPs@HeLa作为一种高效的仿生双药给药系统,为发挥多模式的精准抗癌效应提供了思路。PLGA载中药抗肿瘤成分在靶向递药系统中的应用见表2。
2.3 在免疫佐剂的应用
免疫佐剂(immunoadjuvant)简称佐剂(adjuvant),是一种本身无免疫原性的免疫增强剂。与抗原同时或先于抗原注入机体,能非特异性地改变或增强机体对抗原的特异性免疫应答,提高疫苗的免疫效果。研究表明中药多糖尤其是来源于补益类中药的多糖,能够增强单核巨噬细胞的吞噬功能、促进淋巴细胞增殖和转化、诱导相关细胞因子分泌、促进抗体生成等免疫增强作用[42-43,55,66-68]。表3列举了近年来PLGA纳米粒载中药多糖在增强免疫中的实例。相较于传统的免疫佐剂,中药多糖具有来源广泛、安全性好、效果明显、成本低等优点,表现出良好的应用前景。
Gu等[69]采用复乳法将免疫增强剂当归多糖(polysaccharide,ASP)和模型蛋白抗原卵白蛋白(ovalbumin,OVA)包裹到PLGA纳米粒中,构建了一种新型的疫苗递送系统(ASP-PLGA/OVA),并对其免疫应答进行评价。实验结果表明,ASP-PLGA/OVA纳米粒在4 ℃下保持稳定超过30 d,并持续缓慢释放OVA。与OVA组、ASP-OVA组和PLGA/OVA组比较,ASP-PLGA/OVA纳米粒组显著促进淋巴细胞增殖,提高CD4+/CD8+T细胞比率,诱导辅助性T细胞(T helper cell,Th)1/Th2混合免疫应答,并上调Th相关细胞因子水平,表明ASP-PLGA/OVA纳米粒在体内可激发强烈而持续的细胞免疫和体液免疫。这一研究提示中药多糖作为免疫佐剂与抗原共载于PLGA中,是一种有效、安全的疫苗递送系统,可用于预防感染性疾病和癌症。然而未经修饰的PLGA纳米粒带负电荷,降低细胞对纳米粒的摄取率,这一定程度上限制了佐剂的活性。为了解决上述问题,Gu等[70]用阳离子聚合物聚乙烯亚胺(polyethylenimine,PEI)修饰ASP-PLGA纳米粒,制备了一种带正电荷的给药系统(ASP-PLGA-PEI),以带有荧光的OVA为模型抗原吸附在纳米粒表面,考察巨噬细胞对抗原的摄取能力。结果显示,ASP-PLGA-PEI纳米粒更容易吸附抗原,并增加巨噬细胞对抗原的摄取和内化。为了进一步研究ASP-PLGA-PEI纳米粒在体内的佐剂活性,将PCV2抗原吸附在纳米粒表面接种于小鼠体内,结果显示,ASP-PLGA-PEI-PCV2组的免疫球蛋白G(immunoglobulin G,IgG)水平显著提高,提示ASP-PLGA-PEI是一种优良的PCV2疫苗佐剂,具有诱导高效免疫应答的潜力。上述研究证明,抗原可以通过与中药多糖共同包封在PLGA中或者吸附在纳米粒表面,实现抗原和佐剂的共递送,为疫苗的临床应用设计提供了依据。具体见图2。
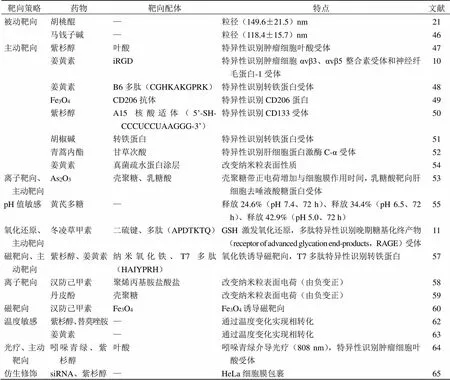
表2 PLGA载中药抗肿瘤成分在靶向递药系统中的应用
3 结语与展望
近年来,恶性肿瘤的发病率和死亡率越来越高,成为危害人类健康的主要疾病之一。随着分离技术和药理学科地不断发展,越来越多的中药单体成分被证实具有显著的抗肿瘤作用。然而许多中药抗肿瘤成分由于溶解性低、稳定性差、半衰期短等自身局限性限制了其开发和利用。基于PLGA优良的载体性能,学者们通过乳化溶剂挥发法、复乳法、沉淀法、透析法等方法实现对不同溶解性的中药抗肿瘤成分的物理包埋,有效改善药物在体内的性质。然而,疏水性强的裸PLGA纳米粒通常存在几个缺点:(1)与蛋白发生不可逆吸附(“蛋白质电晕”现象);(2)在体内容易被内质网系统识别和摄取,导致体循环短;(3)对细胞的黏附性差,对细胞膜的渗透性低;(4)靶向性低,容易对正常细胞产生毒副作用。因此,通过控制纳米粒的粒径大小,对纳米粒表面电荷、亲水性/疏水性进行改造,将特殊靶头、敏感基团装配到纳米粒中,以及用不同细胞膜仿生修饰PLGA,赋予载药纳米粒靶向性,提高抗肿瘤效率并减少毒副作用。
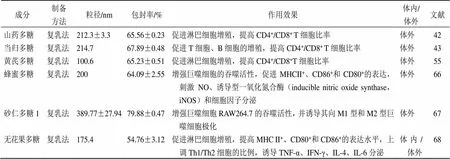
表3 PLGA载中药多糖在增强免疫中的实例
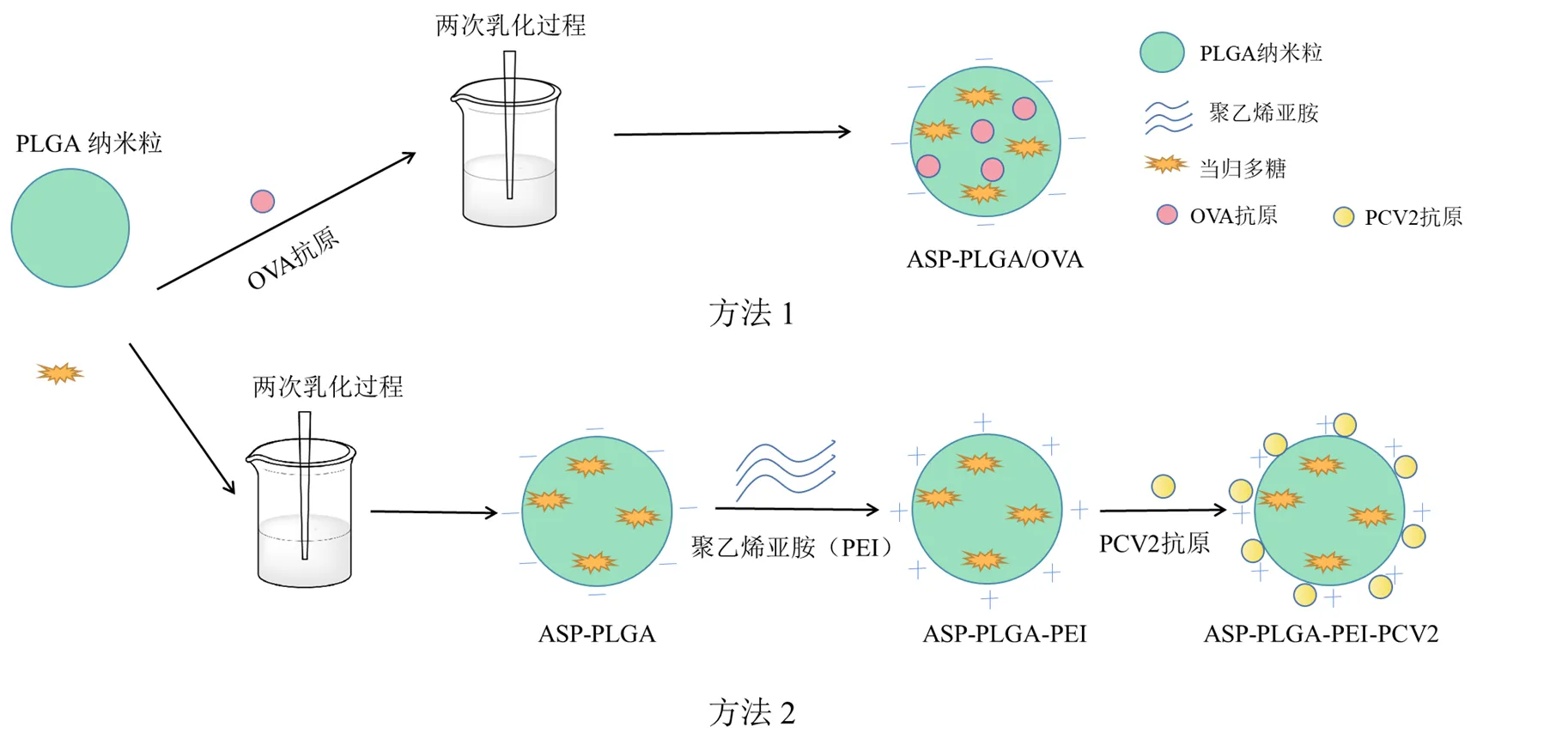
图2 疫苗纳米颗粒的2种制备方法示意图[69-70]
PLGA载中药多糖在免疫佐剂的应用逐渐引起科学家的关注,但相关研究不够全面,体内评价和机制研究实验尚待开展。此外,《皇帝内经》云:“正气存内,邪不可干”。免疫系统与中医的“正气”具有很强的一致性,而人体免疫力下降是癌症发生和发展的主要因素[71]。中药多糖具有显著的免疫增强作用,对肿瘤的预防和治疗具有独特优势。一方面,可以阻止“邪气”对人体的侵犯预防肿瘤的发生;另一方面,通过提高机体功能促进预后而防止肿瘤复发。因此,基于中药多糖的免疫治疗及其联合治疗在抗肿瘤领域极具潜力。
PLGA作为新型有机载体,在体内最终被降解成二氧化碳和水并排出体外,为把中药制成新剂型应用于肿瘤领域提供了选择。目前,基于PLGA纳米粒的中药抗肿瘤研究大多局限于中药单体成分,这与中医传统用药理论的融入尚有欠缺。中药有效部位一定程度上保留了中药多成分的特点,以及不同成分之间固有的配伍属性,利用PLGA递送中药有效部位,有助于中药制剂对肿瘤网络系统进行多方面抑制。肿瘤是一种及其复杂的疾病,其发病机制涉及多种信号通路。联合治疗通过整合多种信号通路、多种作用机制、多个靶点、多种治疗方法克服了传统单一治疗的局限性,实现抗肿瘤的最大疗效。目前,基于PLGA载体在中药抗肿瘤成分的联合治疗已经取得了一定的进展,如中药与化疗的联合[30,72-74]、中药和光疗的联合[75-76]、中药和基因治疗的联合[65]、多种中药活性成分的联合[57,77-78]等。与传统的单一治疗相比,肿瘤联合治疗具有逆转多药耐药、提高抗肿瘤效率、减少不良反应、增强预后效果的优势,展现出良好的应用前景。另外,在我国传统医学中素有“以毒攻毒”的辨证法则,善用毒性药物治疗疑难杂症。对于部分毒性中药,不能仅仅看到其毒性作用,更应挖掘其在治疗肿瘤中的潜力和优势。因此,以中医药传统理论为基础,结合现代新剂型和新技术,实现中国传统医学与现代科学技术的高度融合,将是未来中药用于抗恶性肿瘤的主要研究方向。
利益冲突 所有作者均声明不存在利益冲突
[1] Xia C F, Dong X S, Li H,. Cancer statistics in China and United States, 2022: Profiles, trends, and determinants [J].(), 2022, 135(5): 584-590.
[2] Wei Q Y, He K M, Chen J L,. Phytofabrication of nanoparticles as novel drugs for anticancer applications [J]., 2019, 24(23): 4246.
[3] Shen S Y, Liu M, Li T,. Recent progress in nanomedicine-based combination cancer therapy using a site-specific co-delivery strategy [J]., 2017, 5(8): 1367-1381.
[4] 冯巧惠, 李琼, 贺延苓, 等. 紫杉醇对卵巢癌、乳腺癌、宫颈癌的抗癌功效及生物分子机制研究进展 [J]. 药物生物技术, 2020, 27(3): 278-280.
[5] Zhu L Y, Chen L Q. Progress in research on paclitaxel and tumor immunotherapy [J]., 2019, 24: 40.
[6] Kapoor D N, Bhatia A, Kaur R,. PLGA: A unique polymer for drug delivery [J]., 2015, 6(1): 41-58.
[7] Sadat Tabatabaei Mirakabad F, Nejati-Koshki K, Akbarzadeh A,. PLGA-based nanoparticles as cancer drug delivery systems [J]., 2014, 15(2): 517-535.
[8] Mir M, Ahmed N, Rehman A U. Recent applications of PLGA based nanostructures in drug delivery [J]., 2017, 159: 217-231.
[9] 汪家鼎, 吴青思, 冯佳星, 等. PLGA与PLGA-PEG复合纳米粒的初筛及长循环研究 [J]. 华西药学杂志, 2022, 37(2): 134-137.
[10] 李学娟, 张雪梅, 王蒙, 等. 肿瘤穿透肽修饰的载姜黄素PLGA纳米粒的制备及肿瘤靶向性评价 [J]. 中国新药杂志, 2016, 25(6): 692-698.
[11] Fang X B, Xu Y Q, Chan H F,. A redox-sensitive and RAGE-targeting nanocarrier for hepatocellular carcinoma therapy [J]., 2016, 13(11): 3613-3625.
[12] Zhang J M, Li Y B, Gao W,. Andrographolide-loaded PLGA-PEG-PLGA micelles to improve its bioavailability and anticancer efficacy [J]., 2014, 11(9): 1367-1380.
[13] Zhang S Z, Liu J W, Ge B J,. Enhanced antitumor activity in A431 cells via encapsulation of 20()-ginsenoside Rg3in PLGA nanoparticles [J]., 2017, 43(10): 1734-1741.
[14] Xiong B Y, Chen Y X, Liu Y,. Artesunate-loaded porous PLGA microsphere as a pulmonary delivery system for the treatment of non-small cell lung cancer [J]., 2021, 206: 111937.
[15] Xu Y Y, Shen M, Sun Y,. Polymer nanocomposites based thermo-sensitive gel for paclitaxel and temozolomide co-delivery to glioblastoma cells [J]., 2015, 15(12): 9777-9787.
[16] Bacanlı M, Özgür E M, Erdoğan H,. Evaluation of cytotoxic and genotoxic effects of paclitaxel-loaded PLGA nanoparticles in neuroblastoma cells [J]., 2021, 154: 112323.
[17] Feng Z A, Jiao L N, Wu Z Y,. A novel nanomedicine ameliorates acute inflammatory bowel disease by regulating macrophages and T-cells [J]., 2021, 18(9): 3484-3495.
[18] 商云霞, 王亚茹, 唐逢雨, 等. 转铁蛋白修饰的负载三七皂苷R1的PEG-PLGA纳米粒制备及其体外释药评价 [J]. 上海中医药大学学报, 2021, 35(3): 71-78.
[19] 许浩云, 谢黎崖, 常迪, 等. 改良透析法制备MePEG-PLGA-羟基喜树碱共聚物纳米粒 [J]. 中国现代应用药学, 2016, 33(6): 746-751.
[20] 朱迪冰, 赵海燕, 何建丹, 等. 姜黄素PLGA纳米颗粒的制备及表征 [J]. 亚太传统医药, 2020, 16(3): 46-49.
[21] 岳武恒, 梅瑞, 蔡娟, 等. 胡桃醌-PLGA纳米粒制备及对A375恶黑细胞的体外抗肿瘤作用 [J]. 中国实验方剂学杂志, 2019, 25(4): 87-93.
[22] 尹元元, 耿燕娜, 范明松. Box-Behnken设计-效应面法优化延胡索乙素聚乳酸-羟基乙酸共聚物纳米粒处方和体外释药行为研究 [J]. 中草药, 2021, 52(22): 6806-6815.
[23] 魏永鸽, 黄贺梅, 齐园圃, 等. Box-Behnken设计-效应面法优化吴茱萸碱-羟基乙酸共聚物纳米粒处方及体外释药研究 [J]. 中国医院药学杂志, 2021, 41(23): 2416-2422.
[24] 王俊, 刘哲鹏. 紫杉醇PLGA纳米粒的处方优化与评价 [J]. 肿瘤药学, 2021, 11(1): 52-57.
[25] Ren Z, Qin T, Liu X P,. Optimization ofpolysaccharide-loaded poly (lactic-co-glycolicacid) nanoparticles by RSM and its absorption in Caco-2 cell monolayers [J]., 2018, 118(Pt A): 932-937.
[26] 郑智武, 陈岳祥, 陈伟忠, 等. 磁性聚乳酸-羟基乙酸氧化苦参碱纳米粒的制备及其特性 [J]. 生物医学工程与临床, 2012, 16(3): 213-217.
[27] 陈楠楠, 马宁, 车鸿泽, 等. 复方总黄酮聚乳酸-羟基乙酸共聚物微囊的制备及体外释药特性 [J]. 吉林大学学报: 医学版, 2017, 43(3): 593-599.
[28] 卢晴, 车鸿泽, 陈楠楠, 等. 野菊花总黄酮-PLGA缓释微球的制备及其工艺优化 [J]. 吉林大学学报: 医学版, 2016, 42(3): 617-621.
[29] Zhang X, Chen G, Wen L,. Novel multiple agents loaded PLGA nanoparticles for brain delivery via inner ear administration:andevaluation [J]., 2013, 48(4/5): 595-603.
[30] Wang H, Zhao Y, Wu Y,. Enhanced anti-tumor efficacy by co-delivery of doxorubicin and paclitaxel with amphiphilic methoxy PEG-PLGA copolymer nanoparticles [J]., 2011, 32(32): 8281-8290.
[31] Alshamsan A. Nanoprecipitation is more efficient than emulsion solvent evaporation method to encapsulate cucurbitacin I in PLGA nanoparticles [J]., 2014, 22(3): 219-222.
[32] 王岩, 王笑英, 吕言云, 等. 共同装载吴茱萸碱和Fe3O4纳米粒子的磁性药物载体的制备 [J]. 高等学校化学学报, 2013, 34(12): 2866-2870.
[33] 管庆霞, 夏昭睿, 王艳宏, 等. 包载马钱子碱聚乳酸-羟基乙酸共聚物纳米粒处方工艺优化及其特性研究 [J]. 中草药, 2021, 52(4): 951-961.
[34] 胡慧中, 郑晓君, 胡巧红. 姜黄素-甘草次酸-PEI-PLGA纳米粒的制备及工艺优化 [J]. 山东医药, 2015, 55(16): 8-11.
[35] Park M H, Jun H S, Jeon J W,. Preparation and characterization of bee venom-loaded PLGA particles for sustained release [J]., 2018, 23(9): 857-864.
[36] Xie X X, Tao Q, Zou Y N,. PLGA nanoparticles improve the oral bioavailability of curcumin in rats: Characterizations and mechanisms [J]., 2011, 59(17): 9280-9289.
[37] 方宁. 葫芦素B-聚乳酸-羟基乙酸共聚物载药纳米粒的构建与药效学评价 [J]. 药物评价研究, 2019, 42(8): 1557-1562.
[38] Shenderova A, Burke T G, Schwendeman S P. Stabilization of 10-hydroxycamptothecin in poly(lactide-co-glycolide) microsphere delivery vehicles [J]., 1997, 14(10): 1406-1414.
[39] 车坷科, 王丽娟, 张如超, 等. 关节腔注射用雷公藤甲素PLGA微球的制备与体外释放研究 [J]. 中国新药杂志, 2016, 25(23): 2745-2749.
[40] Zeng Q B, Sun M. Poly(lactide-co-glycolide) nanoparticles as carriers for norcantharidin [J]., 2009, 29(3): 708-713.
[41] 周艾玲, 王段珩, 岳晓蕾, 等. 中药多糖抗肿瘤作用研究进展[J]. 中国实验方剂学杂志, 2022, 28(16): 236-246.
[42] Luo L, Zheng S S, Huang Y F,. Preparation and characterization of Chinese yam polysaccharide PLGA nanoparticles and their immunological activity [J]., 2016, 511(1): 140-150.
[43] Gu P F, Xu S W, Zhou S Z,. Optimization ofpolysaccharide-loaded poly (lactic-co-glycolicacid) nanoparticles by RSM and its immunological activity[J]., 2018, 107(Pt A): 222-229.
[44] Gao Y, Xie J J, Chen H J,. Nanotechnology-based intelligent drug design for cancer metastasis treatment [J]., 2014, 32(4): 761-777.
[45] 陆彬. 靶向制剂的研究进展 [J]. 中国药师, 1998, 1(1): 20-22.
[46] 刘丹, 于佳. 马钱子碱mPEG-PLGA纳米粒的构建与体外抗肿瘤细胞活性研究 [J]. 沈阳药科大学学报, 2021, 38(11): 1133-1138.
[47] 李新健, 游云, 张琼玲, 等. 载紫杉醇的叶酸靶向PTX@FA-PLGA-NMs纳米胶束的制备及其体外抗宫颈癌HeLa细胞作用的研究 [J]. 中国中药杂志, 2021, 46(10): 2481-2488.
[48] Fan S N, Zheng Y Q, Liu X,. Curcumin-loaded PLGA-PEG nanoparticles conjugated with B6 peptide for potential use in Alzheimer’s disease [J]., 2018, 25(1): 1091-1102.
[49] Zhou Y, Que K T, Tang H M,. Anti-CD206 antibody-conjugated Fe3O4-based PLGA nanoparticles selectively promote tumor-associated macrophages to polarize to the pro-inflammatory subtype [J]., 2020, 20(6): 298.
[50] 庞丽莹, 黄小龙, 朱玲玲, 等. 偶联CD133核酸适体的载紫杉醇PLGA-PEG纳米载体靶向清除CD133阳性肺癌干细胞 [J]. 南方医科大学学报, 2022, 42(1): 26-35.
[51] Li S, Guo J S, Tian Z H,. Piperine-loaded glycyrrhizic acid- and PLGA-based nanoparticles modified with transferrin for antitumor [J]., 2021, 22(7): 239.
[52] Pan X W, Liu S R, Ju L P,. Preparation, evaluation, andcytotoxicity studies of artesunate-loaded glycyrrhetinic acid decorated PEG-PLGA nanoparticles [J]., 2020, 46(11): 1889-1897.
[53] Song X L, Wang J, Xu Y,. Surface-modified PLGA nanoparticles with PEG/LA-chitosan for targeted delivery of arsenic trioxide for liver cancer treatment: Inhibition effects enhanced and side effects reduced [J]., 2019, 180: 110-117.
[54] Sun L, Xu H, Xu J H,. Enhanced antitumor efficacy of curcumin-loaded PLGA nanoparticles coated with unique fungal hydrophobin [J]., 2020, 21(5): 171.
[55] Xu S W, Wusiman A, Liu Z G,. pH-responsivepolysaccharides-loaded poly(lactic-co-glycolic acid) nanoparticles and theirimmunogenicity [J]., 2019, 125: 865-875.
[56] Chen F Q, Zhang J M, He Y,. Glycyrrhetinic acid-decorated and reduction-sensitive micelles to enhance the bioavailability and anti-hepatocellular carcinoma efficacy of tanshinone IIA[J]., 2016, 4(1): 167-182.
[57] Cui Y N, Zhang M, Zeng F,. Dual-targeting magnetic PLGA nanoparticles for codelivery of paclitaxel and curcumin for brain tumor therapy [J]., 2016, 8(47): 32159-32169.
[58] Meng R, Li K, Chen Z,. Multilayer Coating of Tetrandrine-loaded PLGA nanoparticles: Effect of surface charges on cellular uptake rate and drug release profile [J]., 2016, 36(1): 14-20.
[59] 唐涛, 臧巧真, 龙凯花, 等. 壳聚糖修饰的丹皮酚PEG-PLGA纳米粒的制备及其体外释药性能考察 [J]. 中国实验方剂学杂志, 2016, 22(6): 8-11.
[60] Wang K P, Hu H P, Zhang Q,. Synthesis, purification, and anticancer effect of magnetic Fe3O4-loaded poly (lactic-co-glycolic) nanoparticles of the natural drug tetrandrine [J]., 2019, 36(4): 356-370.
[61] 顾加雨, 张超, 史乐乐, 等. 磁性多孔PLGA微球制备及其功能化研究 [J]. 中国生物医学工程学报, 2022, 41(1): 124-128.
[62] Xu Y Y, Shen M, Sun Y,. Polymer nanocomposites based thermo-sensitive gel for paclitaxel and temozolomide co-delivery to glioblastoma cells [J]., 2015, 15(12): 9777-9787.
[63] 李林芝, 刘梅, 常颖. 姜黄素-PLGA纳米粒温敏原位凝胶的制备及其在兔眼房水中的药动学研究 [J]. 中国药房, 2018, 29(5): 640-643.
[64] Liu F Q, Chen Y L, Li Y Z,. Folate-receptor-targeted laser-activable poly(lactide-co-glycolic acid) nanoparticles loaded with paclitaxel/indocyanine green for photoacoustic/ultrasound imaging and chemo/ photothermal therapy [J]., 2018, 13: 5139-5158.
[65] Xu C, Liu W, Hu Y,. Bioinspired tumor-homing nanoplatform for co-delivery of paclitaxel and siRNA-E7 to HPV-related cervical malignancies for synergistic therapy [J]., 2020, 10(7): 3325-3339.
[66] Wusiman A, He J, Zhu T Y,. Macrophage immunomodulatory activity of the cationic polymer modified PLGA nanoparticles encapsulating Alhagi honey polysaccharide [J]., 2019, 134: 730-739.
[67] Zhou R G, Teng L, Zhu Y J,. Preparation ofpolysaccharides 1-PLGA nanoparticle and its immune enhancement ability on RAW264.7 cells [J]., 2021, 99: 108053.
[68] Zhang Z Q, Li D, Ma X,. Carboxylated nanodiamond-mediated NH 2-PLGA nanoparticle-encapsulated fig polysaccharides for strongly enhanced immune responsesand[J]., 2020, 165(Pt A): 1331-1345.
[69] Gu P F, Liu Z G, Sun Y Q,.polysaccharide encapsulated into PLGA nanoparticles as a vaccine delivery and adjuvant system for ovalbumin to promote immune responses [J]., 2019, 554: 72-80.
[70] Gu P F, Wusiman A, Wang S Y,. Polyethylenimine-coated PLGA nanoparticles-encapsulatedpolysaccharide as an adjuvant to enhance immune responses [J]., 2019, 223: 115128.
[71] 黄薇, 杨永, 王笑民. 中医“伏邪”理论与恶性肿瘤的辨证施治 [J]. 中医肿瘤学杂志, 2019(1): 12-17.
[72] Borah A, Pillai S C, Rochani A K,. GANT61 and curcumin-loaded PLGA nanoparticles for GLI1 and PI3K/Akt-mediated inhibition in breast adenocarcinoma [J]., 2020, 31(18): 185102.
[73] Caban-Toktas S, Sahin A, Lule S,. Combination of Paclitaxel and R-flurbiprofen loaded PLGA nanoparticles suppresses glioblastoma growth on systemic administration [J]., 2020, 578: 119076.
[74] Khan I, Joshi G, Nakhate K T,. Nano-co-delivery of berberine and anticancer drug using PLGA nanoparticles: Exploration of better anticancer activity andkinetics [J]., 2019, 36(10): 149.
[75] Peng T T, Huang Y, Feng X Q,. TPGS/hyaluronic acid dual-functionalized PLGA nanoparticles delivered through dissolving microneedles for markedly improved chemo-photothermal combined therapy of superficial tumor [J]., 2021, 11(10): 3297-3309.
[76] Chen S N, Liu Y J, Zhu S Y,. Dual-mode imaging and therapeutic effects of drug-loaded phase-transition nanoparticles combined with near-infrared laser and low-intensity ultrasound on ovarian cancer [J]., 2018, 25(1): 1683-1693.
[77] Pillai S C, Borah A, Le M N T,. Co-delivery of curcumin and bioperine via PLGA nanoparticles to prevent atherosclerotic foam cell formation [J]., 2021, 13(9): 1420.
[78] Wang S W, Jiang H, Wang J,. Superioranticancer effect of biomimetic paclitaxel and triptolide co-delivery system in gastric cancer [J]., 2021, 35(4): 327-338.
Research progress on antitumor components in traditional Chinese medicine loaded with PLGA nanoparticles
HUANG Hua-ting1, CAI Meng-ru1, FU Jing2, LIU Jing1, SUN Ming-yi1, YOU Long-tai1, LANG Xiao-xue1, HU Xue-ling1, WANG Kai-xin1, NI Jian1, DONG Xiao-xu1
1. School of Chinese Material Medica, Beijing University of Chinese Medicine, Beijing 102488, China 2. Beijing Hospital of Traditional Chinese Medicine, Capital Medical University, Beijing Institute of Chinese Medicine, Beijing 100010, Chinia
Polylactic co-glycolic acid (PLGA), an organic polymer material, is composed of lactic acid and glycolicacid in the required proportion. It has the advantages of biodegradability, good biocompatibility, structural modification and controllable drug release speed, which has been widely used in the field of drug delivery. With the in-depth study of the active substances, the antitumor components in traditional Chinese medicine have been proven to have the advantages of high efficiency and low toxicity, which has become a research hotspot in the field of tumor therapy. In recent years, the antitumor components in traditional Chinese medicine have been successfully loaded into PLGA nanoparticles through emulsion-solvent evaporation method, double emusion method, nanoprecipitation method and dialysis method, which have been applied to improve the properties of drug, targeting system, immune adjuvant and other fields. The preparation and application of PLGA nanoparticles loaded antitumor components in traditional Chinese medicine in recent years are reviewed in this paper, hoping to provide references for the research of new drug delivery system of antitumor components of traditional Chinese medicine.
PLGA; traditional Chinese medicine; antitumor activity; preparation methods; targeted drug delivery; immune adjuvant
R283
A
0253 - 2670(2022)22 - 7295 - 12
10.7501/j.issn.0253-2670.2022.22.034
2022-06-23
中央高校基本科研业务费专项资金资助(2022-JYB-XJSJJ015)
黄华婷,女,在读硕士研究生,从事中药新剂型与新技术的研究。E-mail: hht09091829@163.com
倪 健,男,博士,教授,博士生导师,从事中药新剂型与新技术的研究。E-mail: njtcm@263.net
董晓旭,男,博士,讲师,从事中药新剂型与新技术的研究。E-mail: dxiaoxv@163.com
[责任编辑 潘明佳]

