Box-Behnken设计-效应面法优化岩黄连碱纳米结构脂质载体处方工艺及体外药效评价
苏晓丹,麦琬婷,钟华帅,曾勇珠,陆建媚,覃裕翠,黄秋洁,叶 勇, 3*
·药剂与工艺·
Box-Behnken设计-效应面法优化岩黄连碱纳米结构脂质载体处方工艺及体外药效评价
苏晓丹1,麦琬婷1,钟华帅1,曾勇珠1,陆建媚1,覃裕翠1,黄秋洁2*,叶 勇1, 3*
1. 广西医科大学药学院,广西 南宁 530021 2. 广西中医药大学药学院,广西 南宁 530001 3. 广西生物活性分子研究与评价重点实验室,广西 南宁 530021
Box-Behnken设计-效应面法优化岩黄连碱纳米结构脂质载体(dehydrocavidine nanostructured lipid carriers,DC-NLCs)处方,并进行体外药效研究。采用溶剂蒸发法制备DC-NLCs。以包封率、载药量和ζ电位为考察指标,采用单因素考察和Box-Behnken设计-效应面法优化DC-NLCs的处方。对DC-NLCs进行表征,并考察体外药效作用。最佳处方为投药量为10.0 mg、固-液脂质比为1∶8、卵磷脂用量为85.0 mg、表面活性剂为1%聚山梨酯-80。DC-NLCs测得包封率为(85.29±0.01)%,载药量为(6.27±0.00)%,ζ电位为(−17.90±1.09)mV、粒径为(188.50±11.77)nm,体外释药具有明显的缓释特征。体外药效学实验表明,DC-NLCs体外抑制肝纤维化的效果显著。Box-Behnken设计-效应面法所建立的模型能较好地用于DC-NLCs处方优化,准确度高,预测效果较好,且优化制备的DC-NLCs具有显著的抑制肝纤维化作用。
岩黄连碱;纳米结构脂质载体;Box-Behnken设计-效应面法;缓释;MTT法;药效评价;溶剂蒸发法;肝纤维化
岩黄连又名石生黄堇、岩胡、土黄连,为罂粟科紫堇属多年生草本植物岩黄连Bunting的全草[1],主要分布于广西、贵州、云南等我国西南部地区。岩黄连作为广西壮族传统特色护肝药物,常用于疮疔肿毒、肝炎、肝硬化、肝癌[2-3]等疾病治疗。
岩黄连碱是从岩黄连[4]中提取分离出来的1种季铵类生物碱。研究表明,岩黄连碱具有促进胶原溶解[5]、调节纤维化相关基因[5]、减少氧化应激[6]、减少肝脏丙二醛的形成[7]、提高超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)和过氧化氢酶(catalase,CAT)活性[5]等药理作用。目前以岩黄连碱作为主要质量控制指标的制剂有岩黄连注射液、岩黄连片剂[8]、岩黄连直肠栓[9]、岩黄连总碱胶囊[10]等,用于肝炎、肝硬化、肝癌等疾病的治疗。然而,由于岩黄连碱存在溶解度差[11]、体外抗氧化活性能力低[12]药物递送率低等缺点,从而限制了其相关制剂的研发及临床应用。因此,通过现代药物制剂技术改善岩黄连碱溶解度及体外活性问题具有重要的现实意义。
据文献报道,纳米结构脂质载体(nanostructured lipid carriers,NLCs)是新一代脂质纳米粒,也称纳米脂质载体[13]。NLCs存在液态油或混合基质打乱了固体脂质规整的晶型结构,以结晶缺陷型、无定形、液脂/固脂/水3者复合态等结构存在,可装载更多药物分子,提高包封率和载药量[14],且具有改善药物溶解度和缓控释作用[15],能有效提高难溶性药物在体内病灶的靶向性、吸收程度并延长药效作用时间[16]。
基于此本研究利用单因素考察结合Box- Behnken设计-效应面法[17-18]进行实验设计,以包封率、载药量、ζ电位为考察指标,选择岩黄连碱用量、固态与液态(固-液)脂质比、卵磷脂用量为主要影响因素,优化岩黄连碱-NLCs(dehydrocavidine- NLCs,DC-NLCs)的处方,并进行质量表征与体外药效评价,以期为岩黄连碱新制剂的研发和临床应用提供实验依据和有价值的参考。
1 仪器与材料
1.1 仪器
Agilent 1200型高效液相色谱仪器,二极管阵列检测器,美国Agilent公司;XS205DU型分析天平,梅特勒-托利多集团;KQ-500DB型数控超声波清洗器,昆明市超声仪器有限公司;HH-2型数显电子恒温水浴锅,常州国华电器有限公司;Nano-ZS90型粒度分析仪,英国马尔文公司;TG16-MS型高速离心机,赛默飞世尔有限公司;THZ-92C型台式恒温振荡器,上海龙跃仪器设备有限公司;H-7650型透射电子显微镜(TEM),日本Htachi公司;Smart Lab-9kW型转靶X-射线粉末衍射仪(XRD),瑞士梅特勒托利多公司;Nicolet IS20型傅里叶变换红外光谱(FT-IR)仪,赛默飞世尔科技公司;超滤离心管,截留相对分子质量10 000,美国Millipore公司;Aynergy H1型酶标仪,美国伯腾仪器有限公司。
1.2 试药
岩黄连碱原料药,批号RP20201009,质量分数98.0%,购自成都麦德生科技有限公司;岩黄连碱对照品,批号111667-200401,质量分数99.6%,购自中国食品药品检定研究院;单硬脂酸甘油酯,批号L28N10S104297,购自源叶生物科技有限公司;油酸,批号k1929018,购自阿拉丁医药科技有限公司;聚山梨酯-80,批号70090050,购自Biosharp药用辅料有限公司;磷酸,批号20201001,购自重庆川东华东有限公司;三乙胺,批号20210217,购自天津市大茂化学试剂厂;15-羟基硬脂酸聚乙二醇酯HS,批号73059868E0,购自德国巴斯夫化工有限公司;PBS缓冲液(批号20211210)、5-甲巯基-1-四氮唑(批号917Q054)、胰酶(批号20220221),购自北京索莱宝科技有限公司;MEM基础培养基,批号WH0022X191,购自普诺赛生命科技有限公司;泊洛沙姆,批号GNC33221B,德国BASF有限公司;转化生长因子-β1(transforming growth factor-β1,TGF-β1),批号P01137,派普泰克技术有限公司;LX-2细胞,广西医科大学药学院林兴课题组赠送。
2 方法与结果
2.1 DC-NLCs的制备工艺
称取处方量的岩黄连碱原料药、单硬脂酸甘油酯、油酸和卵磷脂置于烧杯中,加入无水乙醇4 mL,水浴加热溶解得到澄清透明的有机相。将有机相缓慢滴入于70 ℃水浴的1%聚山梨酯-80中,以转速为850 r/min磁力搅拌50 min后经0.45 µm微孔滤膜滤过,得DC-NLCs混悬液。
空白NLCs制备方法同DC-NLCs一致,但不加入岩黄连碱原料药。
2.2 HPLC法测定岩黄连碱含量
2.2.1 色谱条件 色谱柱为6L Sciences ODS2 C18柱(250 mm×4.6 mm,5 µm);流动相为乙腈-0.2%磷酸三乙胺水溶液(30∶70);检测波长为346 nm;体积流量为1.0 mL/min;柱温为25 ℃。进样后,岩黄连碱出峰位置在6.8 min左右(图1),专属性较高,理论塔板数以岩黄连碱计不低于12 000。
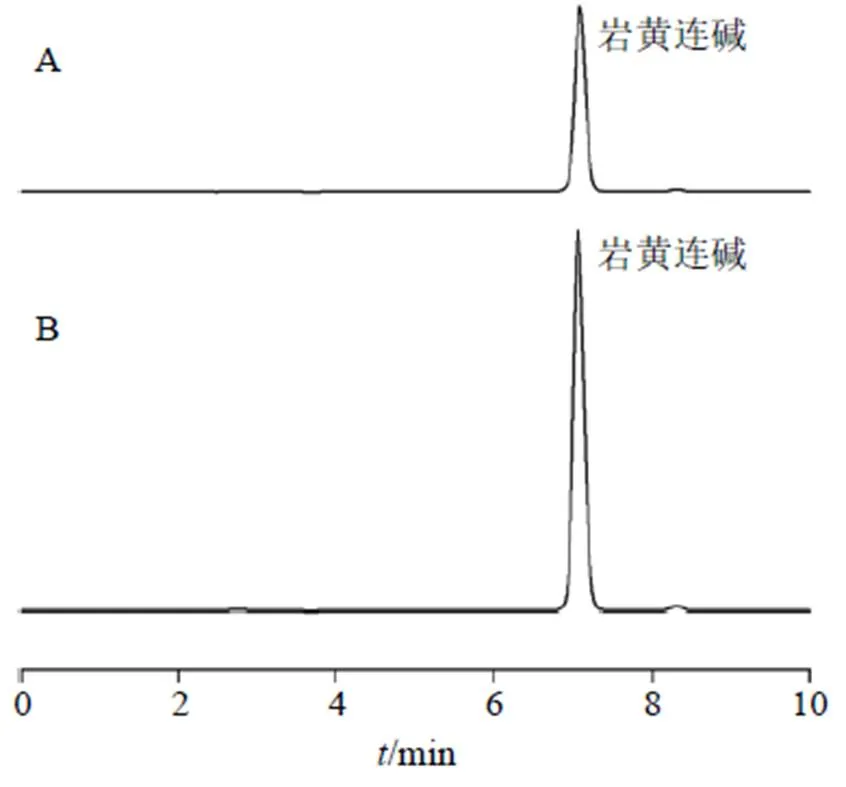
图1 岩黄连碱对照品(A)和DC-NLCs (B)
2.2.2 线性关系考察 称取岩黄连碱对照品2.5 mg至5 mL量瓶中,加入甲醇定容至刻度得500 µg/mL的岩黄连碱为母液。用岩黄连碱母液配制1、2、5、10、50、100、500 µg/mL系列质量浓度对照品溶液,进样分析。以岩黄连碱的峰面积为纵坐标(),质量浓度为横坐标(),进行线性回归,得回归方程=37.816+31.496,=0.999 8,可见,岩黄连碱在1~500 µg/mL线性关系良好。
2.2.3 供试品溶液制备 取DC-NLCs混悬液100 µL至5 mL量瓶中,加入甲醇定容至刻度后超声(功率600 W)15 min,0.22 µm微孔滤膜滤过,即得DC-NLCs供试品溶液。
2.2.4 精密度考察 取低、中、高质量浓度(50、200、350 µg/mL)岩黄连碱溶液,连续进样6次,记录岩黄连碱色谱峰的峰面积,计算得岩黄连碱峰面积的RSD分别为0.22%、0.41%、0.09%,表明仪器精密度良好。
2.2.5 稳定性考察 取DC-NLCs供试品溶液,分别于制备后0、4、8、16、24 h进样,记录岩黄连碱色谱峰的峰面积,计算得岩黄连碱峰面积RSD为1.23%,表明供试品溶液在24 h内稳定性良好。
2.2.6 重复性考察 取DC-NLCs混悬液,按“2.2.3”项下方法处理,制备6份DC-NLCs供试品溶液,进样,记录岩黄连碱色谱峰的峰面积,计算得岩黄连碱质量浓度的RSD为1.15%,表明重复性良好。
2.2.7 加样回收率考察 取DC-NLCs混悬液100 µL至10 mL量瓶中,分别加入500 µL岩黄连碱低、中、高质量浓度3组,每组3份。甲醇定容至刻度线后,取400 µL至超滤管中,以10 000 r/min离心(离心半径7.5 cm)30 min。取续滤液,0.22 µm微孔滤膜滤过,进样测定,计算得岩黄连碱的平均加样回收率为105.18%,RSD分别为1.33%,表明该方法加样回收率较高。
2.3 包封率、载药量、粒径及ζ电位的测定
取DC-NLCs混悬液100 µL至5 mL量瓶中,加入甲醇定容至刻度后超声15 min,0.22 µm微孔滤膜滤过,进样测定岩黄连碱总量(2)。另取DC-NLCs混悬液400 µL至超滤管中(截留相对分子质量10 000),10 000 r/min离心(离心半径7.5 cm)30 min,取续滤液于10 mL量瓶中,甲醇定容至刻度线,进HPLC测定岩黄连碱游离药量(1)。按照文献方法分别计算包封率和载药量。
包封率=(2-1)/2(1)
载药量=(2-1)/(2+3) (2)
1为游离药物的量,2为系统中药物的总量,3为系统中辅料的量
取DC-NLCs混悬液0.4 mL,蒸馏水稀释35倍后,置于粒度分析仪中,分别测定粒径、多分散指数(polydispersity index,PDI)及ζ电位。
2.4 单因素考察DC-NLCs处方及制备工艺
2.4.1 岩黄连碱用量的考察 取处方量的单硬脂酸甘油酯、油酸、卵磷脂、岩黄连碱,在固-液脂质比为1∶8,聚山梨酯-80用量为1.0%,水浴温度为70℃的条件下,考察岩黄连碱用量对DC-NLCs包封率、载药量、粒径等指标的影响,结果见表1。随着岩黄连碱用量的增加,包封率总体呈现减小趋势,这可能是在固-液脂质用量不变的情况下,其包载药物的能力有限造成的。粒径及PDI值均呈现先增加后减小趋势,而载药量呈增加趋势,但ζ电位绝对值均大于20 mV。可见岩黄连碱用量对DC-NLCs的指标影响较大,当岩黄连碱用量为8 mg时包封率和载药量相对较高,粒径、PDI和ζ电位绝对值大小也相对理想。
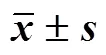
表1 岩黄连碱用量对DC-NLCs指标影响的考察(, n = 3)
2.4.2 固-液脂质比的考察 固定岩黄连碱用量为2 mg,取单硬脂酸甘油酯8 mg、油酸64 mg和处方量的卵磷脂置于烧杯,聚山梨酯-80用量为1.0%,水浴温度为70 ℃,以转速为850 r/min磁力搅拌50 min。考察不同固-液脂质比对DC-NLCs包封率、载药量、粒径等指标的影响,结果见表2。当固-液脂质比分别为1∶1、1∶4、1∶8、4∶1、8∶1时,包封率、载药量和ζ电位绝对值先上升后下降,而粒径和PDI值先下降后再上升。可见,固-液脂质比对DC-NLCs的影响较大,当固-液脂质比为1∶8时各指标相对较好。
2.4.3 卵磷脂用量的考察 固定岩黄连碱用量为2 mg,取单硬脂酸甘油酯8 mg、油酸64 mg和25、45、65、85、105、125 mg的卵磷脂置于烧杯,聚山梨酯-80用量为1.0%,水浴温度为70 ℃,以转速为850 r/min磁力搅拌50 min。考察不同卵磷脂用量对DC-NLCs包封率、载药量、粒径等指标的影响,结果见表3。当卵磷脂用量逐渐增加时,包封率和载药量先上升后下降。当卵磷脂用量为65 mg时,包封率、载药量和ζ电位较好。
2.4.4 搅拌时间的考察 固定岩黄连碱用量为2 mg,取单硬脂酸甘油酯8 mg、油酸64 mg和处方量的卵磷脂置于烧杯,聚山梨酯-80用量为1.0%,水浴温度为70 ℃,以转速为850 r/min,考察搅拌时间为10、30、50、70 min对DC-NLCs包封率、载药量、粒径等指标的影响,结果见表4。当搅拌时间逐渐增加时,载药量先上升后下降的趋势,包封率呈现增大趋势。当搅拌时间为50 min时,包封率、载药量和ζ电位较好。
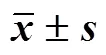
表2 固-液脂质比对DC-NLCs指标影响的考察(, n = 3)
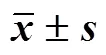
表3 卵磷脂用量对DC-NLCs指标影响的考察(, n = 3)
2.4.5 水浴温度的考察 固定岩黄连碱用量为2 mg,取单硬脂酸甘油酯8 mg、油酸64 mg和处方量的卵磷脂置于烧杯,聚山梨酯-80用量为1.0%,考察水浴温度为50、60、65、70、85 ℃,以转速为850 r/min磁力搅拌50 min。考察不同搅拌温度对DC-NLCs包封率、载药量、粒径等指标的影响,结果见表5。当水浴温度逐渐增加时,包封率和载药量大致先上升后下降的趋势。当水浴温度为70 ℃时,包封率、载药量和ζ电位较好。
2.4.6 表面活性剂种类的考察 固定岩黄连碱用量为2 mg,取单硬脂酸甘油酯8 mg、油酸64 mg和处方量的卵磷脂置于烧杯,分别加入1%聚山梨酯-80、1%泊洛沙姆、1% 15-羟基硬脂酸聚乙二醇酯HS,以转速为850 r/min磁力搅拌50 min。考察不同表面活性剂对DC-NLCs包封率、载药量、粒径等指标的影响,结果见表6。当表面活性剂为1%聚山梨酯-80时包封率、载药量、粒径、ζ电位、PDI较好。
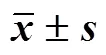
表4 搅拌时间对DC-NLCs指标影响的考察(, n = 3)
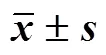
表5 水浴温度对DC-NLCs指标影响的考察(, n = 3)
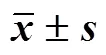
表6 表面活性剂种类对DC-NLCs指标影响的考察(, n = 3)
2.5 Box-Behnken响应面法优化处方
2.5.1 优化方案设计 包封率、载药量、PDI、ζ电位是NLCs的重要指标,故选择该4个指标进行Box-Behnken设计-响应面实验。根据前期单因素考察,发现投药量(1)、固-液脂质比(2)和卵磷脂用量(3)对DC-NLCs包封率(1)、载药量(2)和ζ电位(3)的影响较大,各个因素的水平见表7。将包封率、载药量和ζ电位归一化为OD(overall desirability)值[19],作为Box-Behnken响应面设计的响应指标。
2.5.2 模型及方差分析 采用Design-Expert V 8.0.6软件以综合指标OD值对1、2、3进行拟 合,综合考虑模型的拟合度及简洁性,采用2次多项式进行拟合,得OD的2次多元回归方程为1=0.47-0.301-0.0112+0.0123+0.1412-0.1213+0.26923+0.02212-0.08622-0.09532(2=0.929 0,<0.000 1)。
由2与值和可知,该预测模型拟合情况较好;且方程的失拟项值均大于0.05,差异不具有统计学意义,因此方程预测结果可靠性较高,可反映实际情况。对方程中各项系数进行了统计检验,OD值方差分析见表8,其中1、12、23有显著或极显著差异(<0.05、0.01)。
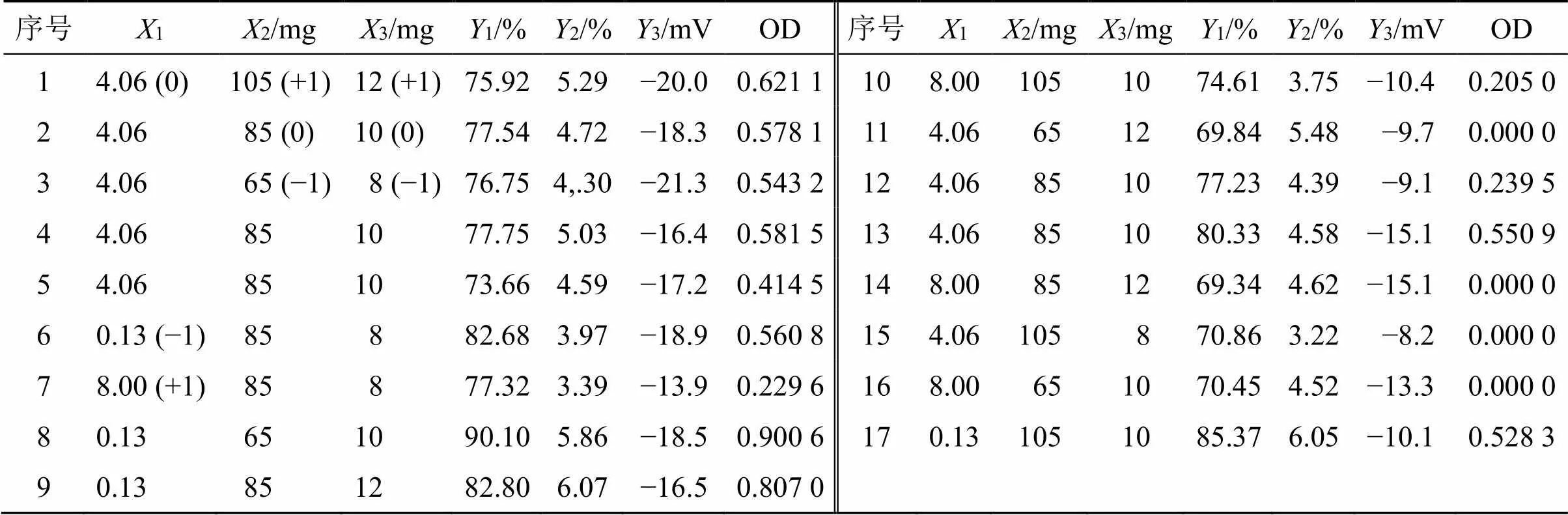
表7 Box-Behnken设计-响应面设计实验因素水平及试验结果
2.5.3 效应面评估与预测 采用Design Expert V 8.0.6绘制因变量对自变量的三维曲面图。分别固定投药量(1)、固-液脂质比(2)和卵磷脂用量(3)因素中之一,得到另外2个因素的交互作用对综合指标OD值影响的结果见图2。得出DC-NLCs最佳处方为投药量为10.00 mg,固-液脂质比为1∶8,卵磷脂用量为65 mg,OD值为0.929 0,模型预测该处方的包封率为87.24%,载药量为5.53%,ζ电位−16.50 mV。按照此处方平行制备3批DC-NLCs,结果见表9。测得其包封率为(85.29±0.01)%,载药量为(6.27±0.00)%,ζ电位为(−17.90±1.09)mV分别与预测值较为接近,结果表明该方程预测结果较好。另测得DC-NLCs的粒径为(188.50±11.77)nm,见图3,结果表明DC-NLCs的粒径较小;由图4可见,DC-NLCs和空白NLCs溶液有明显的丁达尔效应,但原料药岩黄连碱溶液则没有,进一步表明纳米脂质载体的成功制备;由图5可见,DC-NLCs的外观形态圆整。

表8 方差分析结果

图2 X2、X3对OD值的效应面图
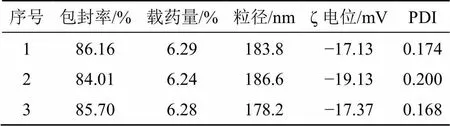
表9 DC-NLCs的包封率、载药量、粒径、ζ电位、PDI
2.6 体外释放
取适量纯化后的DC-NLCs至透析袋中扎紧两端,释放介质分别为30 mL的pH值为5.0、6.8、7.4的磷酸盐缓冲液,温度和转速分别为(37±1)℃和100 r/min。分别在0.5、1.0、2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0、12.0、24.0、48.0 h分别取样1 mL,并分别补液1 mL。各样品均过0.22 µm微孔滤膜,进HPLC测定,结果见图6。可见,岩黄连碱原料药在2.0 h内释药较快,累积释放率为97.52%,基本释放完全。而DC-NLCs在前3 h释放相较快,在4.0~48.0 h则表现出明显的缓释作用。
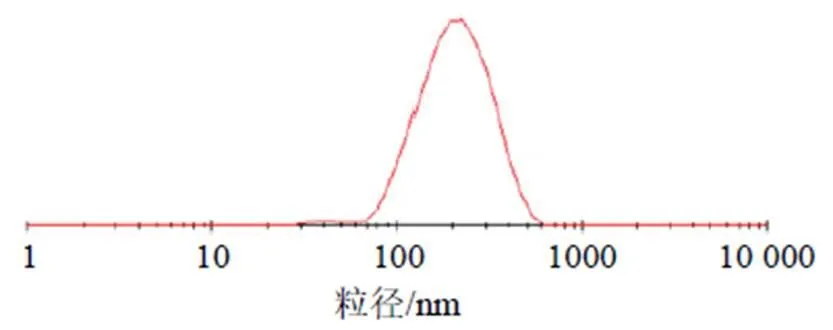
图3 DC-NLCs的粒径分布

图4 岩黄连碱、DC-NLCs、空白NLCs溶液的外观
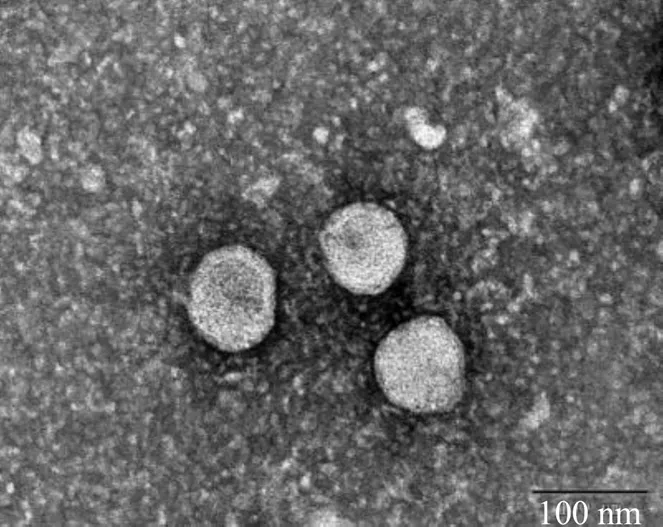
图5 DC-NLCs的TEM图
2.7 DC-NLCs的质量评价
2.7.1 FT-IR分析 分别取适量纯化的DC-NLCs冻干粉(所有样品纯化后均使用冷冻干燥机进行冻干成粉末)、空白NLCs冻干粉、岩黄连碱原料药、空白NLCs冻干粉和岩黄连碱原料药置于研钵中,加入适量溴化钾研磨均匀后倒入模具中压片。压片完毕后分别进行FT-IR测定,结果见图7。岩黄连碱、岩黄连碱原料药和空白NLCs冻干粉的物理混合物在1650 cm−1都有C-N的特征吸收峰,而空白NLCs、DC-NLCs在1650 cm−1没有IR吸收,2700~3100 cm−1是甲基、亚甲基及次甲基的伸缩振动,1650~1750 cm−1是羰基的特征吸收。结果表明,DC-NLCs成功制备。
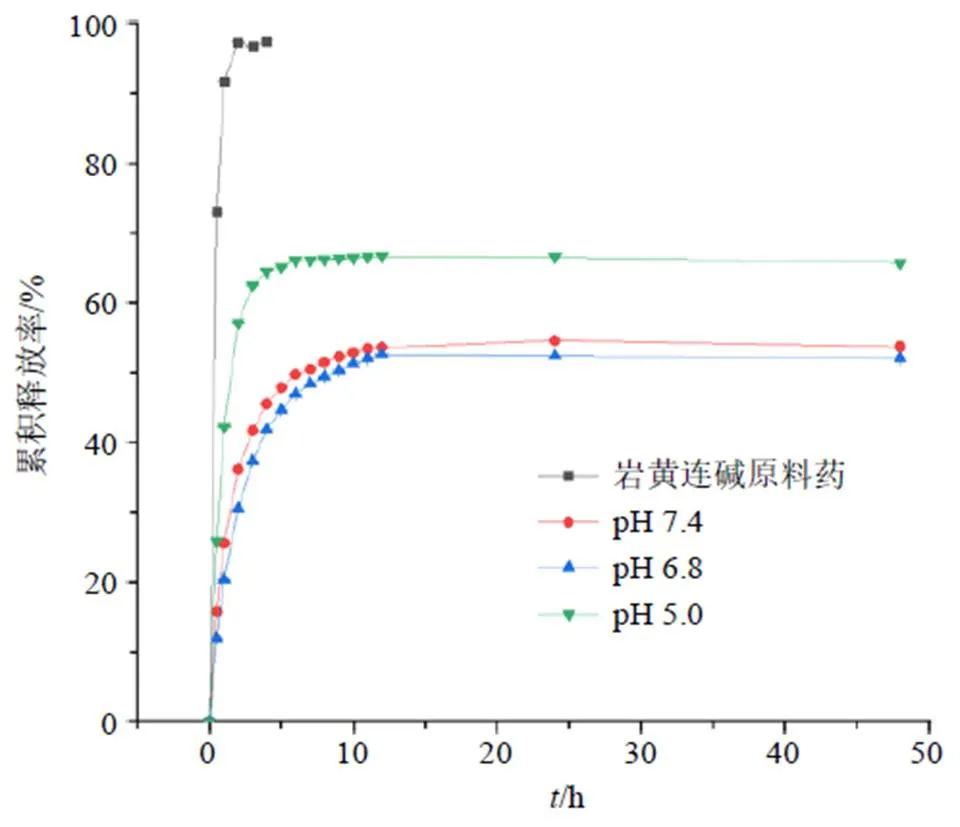
图6 DC-NLCs和岩黄连碱在不同溶液中的累积释放率(, n = 3)
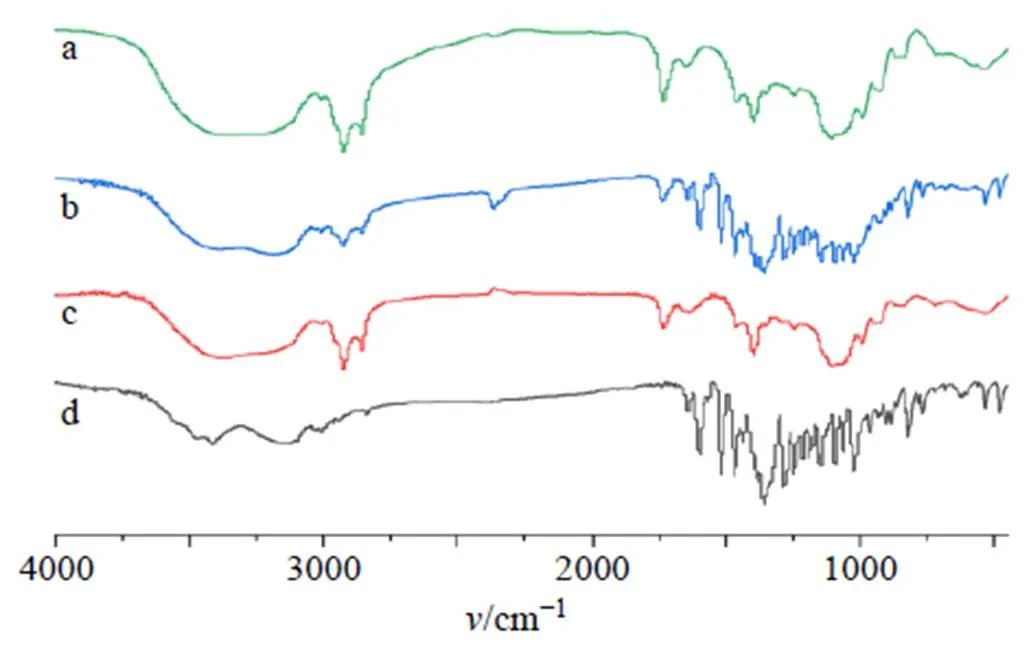
图7 空白NLCs (a)、岩黄连碱+空白NLCs (b)、DC-NLCs (c)、岩黄连碱(d)的FT-IR图谱
2.7.2 差示扫描量热(DSC)分析 分别称取适量岩黄连碱原料药、空白NLCs冻干粉、DC-NLCs冻干粉、DC-NLCs冻干粉和岩黄连碱原料药物理混合物置于铝制样品盘中压制后,在DSC的样品室中,以空铝钵为参比进行测试。设置仪器参数为加热速率10 ℃/min,扫描范围30~300 ℃,结果见图8。DC-NLCs和空白NLCs在175 ℃中有明显的放热峰,而没有出现岩黄连碱在275 ℃的吸热峰,这表明DC-NLCs成功制备。
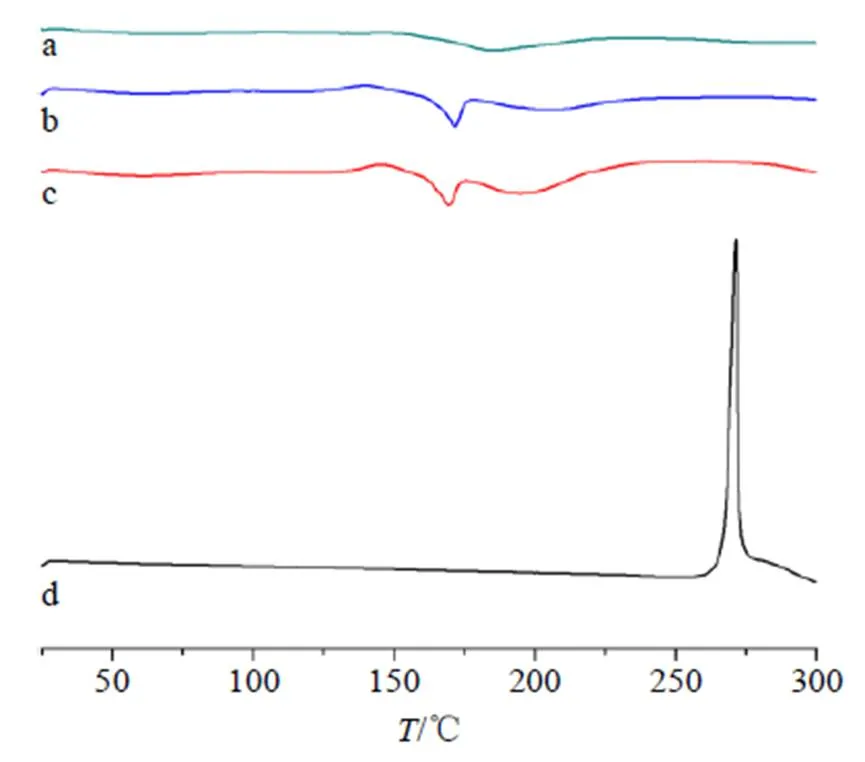
图8 岩黄连碱+空白NLCs (a)、空白NLCs (b)、DC-NLCs (c)、岩黄连碱(d) 的DSC图
2.7.3 X射线衍射(XRD)分析 分别称取适量岩黄连碱原料药、空白NLCs冻干粉、DC-NLCs冻干粉、DC-NLCs冻干粉和岩黄连碱原料药物理混合物,将样品粉末制成平整的试片,进行XRD测定。测定条件:Ni-滤液器,Cu-K α射线,辐射波长为0.154 056 nm,扫描范围5°~45°,扫描速度5°/min、采样时间l s,步长0.05°进行扫描,分别绘制XRD图,结果见图9。岩黄连碱自身有很多衍射峰,而制备成DC-NLCs后,所有的衍射峰都减弱了,且与空白NLCs具有相同的衍射的情况;由岩黄连碱与+空白NLCs冻干粉的物理混合物比较可见,在相同位置中都出现了相同的衍射峰。结果表明,DC- NLCs制备成功。
2.8 DC-NLCs对肝纤维化细胞体外药效研究
2.8.1 MTT实验检测细胞增殖抑制活性 将LX-2细胞接种于96孔板内,并使每孔含有细胞悬液100 µL。将96孔板放入细胞培养箱内培养24 h,至细胞单层平铺孔底,弃去原培养基。再加入100 µL制备好5 ng/mL的TGF-β1继续刺激24 h后,弃去培养基,分别加入质量浓度为1.2、2.4、4.8、9.6、19.2 µg/mL的岩黄连碱或DC-NLCs,选取未加入药物作为对照组,每组设3个复孔。置于条件为37 ℃、5% CO2培养箱内培养24 h,结果见图10和表10。由图10可见,未活化的LX-2细胞成梭形,经过TGF-β1活化后,明显出现星状化;表10结果表明,与岩黄连碱相比,DC-NLCs在1.2、2.4、4.8、9.6、19.2 µg/mL对LX-2细胞的抑制率具有显著性差异(<0.01),且4.8 µg/mL的DC-NLCs在24 h后对细胞的抑制率达到50.57%。
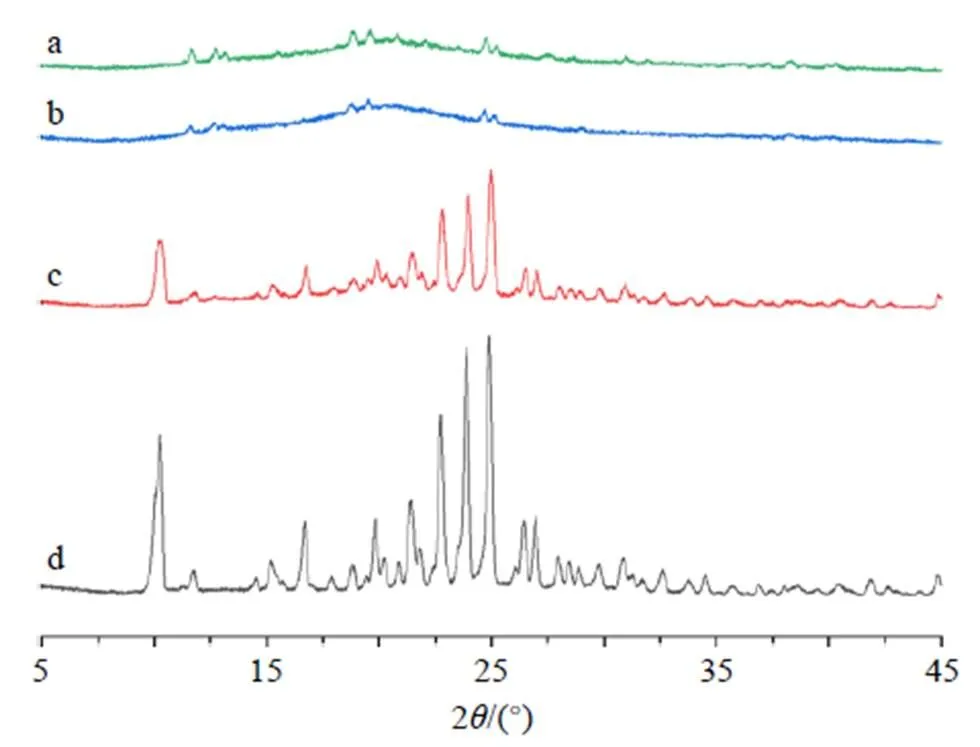
图9 空白NLCs (a)、DC-NLCs (b)、岩黄连碱+空白NLCs (c)、岩黄连碱(d)的XRD图

图10 未活化(A) 和活化(B)的LX-2细胞
表10 岩黄连碱和DC-NLCs对LX-2细胞的抑制率
与岩黄连碱组比较:**<0.01
**< 0.01dehydrocavidine group
2.8.2 划痕实验检测细胞迁移能力 将30%~40%密度的LX-2细胞接种于96孔细胞培养板中,每个样品3个复孔,每孔100 µL完全培养基细胞培养箱内静置培养。再加入100 µL制备好5 ng/mL TGF-β1继续刺激24 h后,弃去培养基24 h后,用10 µL无菌枪头在每孔培养板底划线条粗细均匀的竖线后,吸去培养基,200 µL PBS洗2次,再加入100 µL质量浓度为4.8 µg/mL的岩黄连碱或DC-NLCs。在倒置显微镜下拍照,拍照结束后,置于培养箱,继续培养48 h后,继续拍照。计算迁移率,结果见图11和表11。结果表明,DC-NLCs可明显抑制LX-2细胞的迁移。
迁移率=(0 h划痕宽度-48 h划痕宽度)/0 h划痕宽度
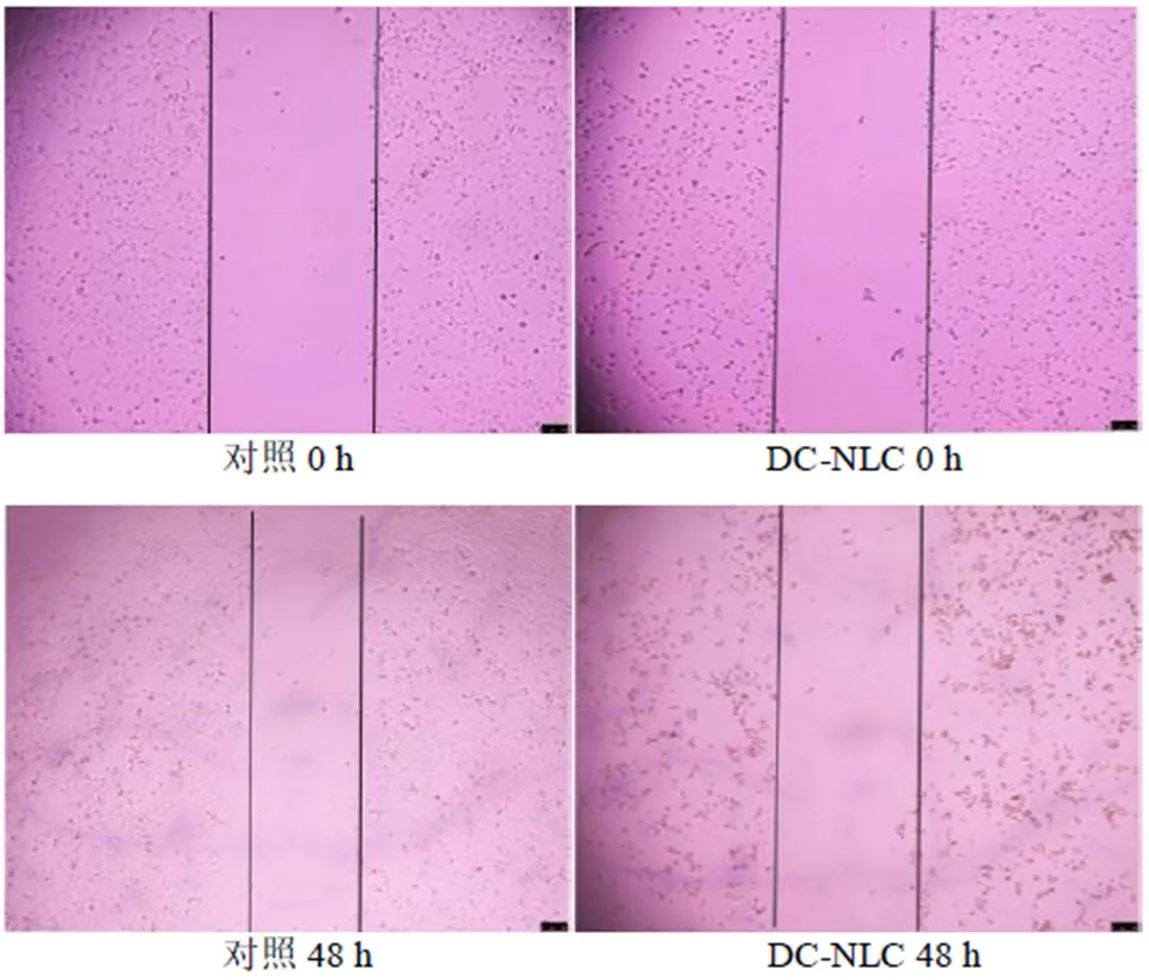
图11 DC-NLCs对LX-2细胞的迁移影响

表11 DC-NLCs对LX-2细胞的迁移率
3 讨论
岩黄连碱作为一种具有药理活性的季铵碱化合物,越来越多研究表明岩黄连碱具有较好的肝纤维化治疗潜力。然而岩黄连碱的水溶性差、半衰期短、生物利用度低等缺点严重限制了其临床应用。NLCs是将固体脂质与液体脂质混合,并加入含有表面活性剂或表面活性剂混合物的水相,以形成与药物结合的第二代脂质纳米颗粒[20]。由于固体和液体脂类的分子大小和构象形状不同,使载药基质不能形成完美晶格,产生了空隙。这增加了溶解性、渗透性、降低了代谢、p-糖蛋白外排,从而增加了溶性差药物的生物利用度[21]。因此,在本研究中,利用单因素考察结合Box-Behnken设计-效应面法成功优化了DC-NLCs处方,并评估了其在提高药物成药性能以及对体外细胞药效作用的影响。
在确定处方选用液态脂质油酸,固态脂质单硬脂酸甘油酯的前期,分别固定液态和固态脂质,以包封率、粒径等为评价指标进行了大量的处方筛选。结果发现,单硬脂酸甘油酯和油酸制得的纳米结构脂质载体包封率相对较高,且粒径相对较小。因此,处方辅料选用单硬脂酸甘油酯和油酸。同时,研究油酸总量对DC-NLCs中药物包封效率的影响。结果表明,DC-NLCs包封率从69.32%增加到86.75%,油酸质量从20 mg增加到100 mg。这可能是由于液体脂质掺入固体脂质,导致了大量的晶体顺序干扰,晶格中较大的缺陷留下了足够空间来容纳药物分子,这最终提高了载药能力和包封率[22]。在含有100 mg的油酸配方中,包封率最高,但粒径、PDI较大,因此,综合各因素处方选用油酸为64 mg的配比。单因素中考察了不同表面活性剂对包封率、载药量、粒径、ζ电位、PDI的影响,发现聚山梨酯-80所制备得到的DC-NLCs载药量、包封率更高,可能由于聚山梨酯-80增溶及乳化效果更好,因此选用聚山梨酯-80作为表面活性剂。由于聚山梨酯-80的用量过大,会对红细胞造成溶血现象[23],对后续的大鼠尾静脉注射实验造成影响,故选用1%聚山梨酯- 80进行单因素实验。
有研究发现,肿瘤环境中由于癌细胞的有氧糖酵解增加导致癌细胞外pH值6.5~7.2低于正常组织[24],DC-NLCs在释放度实验中,药物在pH值5.0中释放最快,在pH值6.8中释放最慢。这可能表明DC-NLCs在肿瘤环境中更适合缓慢释放从而达到长效作用。此外,有文献报道[25],加入冻干保护剂形成的NLCs呈无定型状态,而不含冻干保护剂的NLCs冻干后有一定的结晶结构存在。在进行DSC实验中,空白NLCs、DC-NLCs只出现1个较弱的放热峰,而岩黄连碱出现了1个较强的吸热峰,可能是冷冻干燥时加入少量的蔗糖造成的。此外,岩黄连碱与空白NLCs的物理混合物没有呈现任何的放热、吸热峰,有可能是物理混合物加大了两者的不定型状态造成的。
本研究所制备的DC-NLCs大小在150~200 nm,适合细胞摄取。在体外药效研究发现,DC-NLCs对LX-2细胞在24、48 h都具有明显的抑制作用,且与游离岩黄连碱抑制率的比较具有显著性差异(<0.01),这表明DC-NLCs对肝纤维化疾病治疗有巨大的应用前景。这些结果与纳米结构脂质载体在给药方面的优势相一致[19,26]。考虑到肿瘤组织和肿瘤微环境之间的联系,需要通过更准确和有效的药物传递来解决日益增长的癌症负担。在过去的20年里,纳米技术在癌症的诊断和靶向治疗领域中做出了巨大贡献[27]。然而,纳米技术药物传递相关的效率和毒性问题仍需要解决[28]。因此,后续研究将进行DC-NLCs的体内药效学、药动学评价,并进一步完善质量表征,为DC-NLCs的开发应用提供更为全面的研究资料。
利益冲突 所有作者均声明不存在利益冲突
[1] 张晓, 李保宏, 张永康, 等. 岩黄连的化学成分及生物活性研究进展 [J]. 中草药, 2022, 53(9): 2861-2871.
[2] 金书屹, 李红婷, 汪万利, 等. 紫堇属岩黄连的化学成分及药理作用研究进展 [J]. 中成药, 2022, 44(5): 1545-1552.
[3] 陈萍, 鞠霖杰, 成俊, 等. 岩黄连总碱对代谢相关脂肪性肝病小鼠的治疗作用及分子机制研究 [J]. 药物评价研究, 2021, 44(3): 468-477.
[4] 广西科学院广西植物研究所. 广西植物志 [M]. 南宁: 广西科学技术出版社, 1991: 410.
[5] Wang T, Sun N L, Zhang W D,. Protective effects of dehydrocavidine on carbon tetrachloride-induced acute hepatotoxicity in rats [J]., 2008, 117(2): 300-308.
[6] 石永辉, 黄光业, 薛照芸, 等. 脱氢卡维丁对H2O2处理成骨前体细胞MC3T3-E1增殖及凋亡的影响 [J]. 中药材, 2020, 43(2): 457-463.
[7] Fu P, Zhang Q, Yi D Y,. Dehydrocavidine attenuates d-galactose induced learning and memory impairment in rats [J]., 2018, 665: 200-205.
[8] 黄雪梅, 黄兴振, 刘雪萍, 等. 岩黄连片质量标准研究 [J]. 中国药房, 2007, 18(12): 916-918.
[9] 诸葛明丽, 农慧亮, 黄兴振, 等. 岩黄连直肠栓质量标准研究 [J]. 中国药业, 2013, 22(12): 87-89.
[10] 戴国梁, 欧阳冰琛, 王一清, 等. 岩黄连总碱胶囊在健康受试者体内的药动学研究 [J]. 中国医院药学杂志, 2022, 42(7): 702-706.
[11] 薛斐倩, 王绩英. 脱氢卡维丁的药理作用及其相关机制研究进展 [J]. 世界最新医学信息文摘, 2017, 17(95): 58-60.
[12] 何志超, 王冬梅, 李国成, 等. 岩黄连生物碱类成分及其抗氧化活性研究 [J]. 中草药, 2014, 45(11): 1526- 1531.
[13] Patel D, Dasgupta S, Dey S,. Nanostructured lipid carriers (NLC)-Based gel for the topical delivery of aceclofenac: Preparation, characterization, andevaluation [J]., 2012, 80(3): 749-764.
[14] Mishra N, Yadav N P, Rai V K,. Efficient hepatic delivery of drugs: Novel strategies and their significance [J]., 2013, 2013: 382184.
[15] 周剑雄, 吴送姑, 龚俊波, 等. 小檗碱的药理活性以及提升其口服生物利用度的策略 [J]. 药学学报, 2022, 57(5): 1263-1272.
[16] 董丹丹, 焦红军, 郝海军, 等. 吴茱萸碱纳米结构脂质载体处方优化和SD大鼠体内口服药动学研究 [J]. 中草药, 2022, 53(1): 60-70.
[17] 尹元元, 耿燕娜, 范明松. Box-Behnken设计-效应面法优化延胡索乙素聚乳酸-羟基乙酸共聚物纳米粒处方和体外释药行为研究 [J]. 中草药, 2021, 52(22): 6806- 6815.
[18] 杨金枝, 赵兴业, 周开, 等. Box-Behnken设计-效应面法优化根皮素纳米结构脂质载体处方研究 [J]. 中国医院药学杂志, 2021, 41(20): 2076-2081.
[19] 麦琬婷, 钟华帅, 苏晓丹, 等. Box-Behnken响应面优化蛇葡萄素纳米结构脂质载体处方工艺及体外评价 [J]. 中草药, 2022, 53(16): 4982-4991.
[20] Patel P, Patel M. Nanostructured lipid carriers-A versatile carrier for oral delivery of lipophilic drugs [J]., 2021, 15(2): 154-164.
[21] Harde H, Das M, Jain S. Solid lipid nanoparticles: An oral bioavailability enhancer vehicle [J]., 2011, 8(11): 1407-1424.
[22] Patel D, Dasgupta S, Dey S,. Nanostructured lipid carriers (NLC)-Based gel for the topical delivery of aceclofenac: Preparation, characterization, andevaluation [J]., 2012, 80(3): 749-64.
[23] 魏寒梅. Angiopep-2修饰吐温80包裹环维黄杨星D脂质体的制备及评价[D]. 广州: 广州中医药大学, 2018.
[24] Guo X, Shi C L, Wang J,. pH-triggered intracellular release from actively targeting polymer micelles [J]., 2013, 34(18): 4544-4554.
[25] Hisaka T, Sakai H, Sato T,. Quercetin suppresses proliferation of liver cancer cell lines[J]., 2020, 40(8): 4695-4700.
[26] Yin J, Hou Y, Yin Y,. Selenium-coated nanostructured lipid carriers used for oral delivery of berberine to accomplish a synergic hypoglycemic effect [J]., 2017, 12: 8671-8680.
[27] 杨冰, 陆洋, 杜守颖, 等. 基于“鼻-脑”通路细胞模型组探索相对分子质量及粒径因素对药物制剂经鼻入脑的影响 [J]. 中草药, 2020, 51(22): 5748-5753.
[28] Ashdaq U A, Riaz M, Yasmeen E,. Recent advances in nanoparticle-based targeted drug-delivery systems against cancer and role of tumor microenvironment [J]., 2017, 34(4): 317-53.
Formulation optimization of dehydrocavidine nanostructured lipid carriers by Box-Behnken design response surface method and pharmacodynamic studies
SU Xiao-dan1, MAI Wan-ting1, ZHONG Hua-shuai1, ZENG Yong-zhu1, LU Jian-mei1, QIN Yu-cui1, HUANG Qiu-jie2, YE Yong1, 3
1. School of Pharmacy, Guangxi Medical University, Nanning 530021, China 2. School of Pharmacy, Guangxi University of Traditional Chinese Medicine, Nanning 530001, China 3. Guangxi Key Laboratory of Bioactive Molecules Research and Evaluation, Nanning 530021, China
To optimize the formulation of dehydrocavidine nanostructured lipid carriers (DC-NLCs) by Box-Behnken design response surface method, and studypharmacodynamics.Preparation of DC-NLCs by solvent evaporation. Encapsulation efficiency, drug loading and potential were used as evaluation index, single factor investigation method and Box-Behnken response surface method (BBD-RSM) were used to investigate the optimal prescriptions of DC-NLCs. The DC-NLCs were characterized andefficacy results were compared.The optimal formulation: dehydrocavidine dosage was 10.0 mg, solid-liquid lipid ratio was 1∶8, lecithin dosage was 85.0 mg, surfactant was 1% polysorbate-80. Envelopment efficiency, drug loading, potential and particle size of DC-NLCs were (85.29 ± 0.01)%, (6.27 ± 0.00)%, (−17.90 ± 1.09) mV and (188.50 ± 11.77) nm, respectively.drug release has obvious sustained-release characteristics.pharmacodynamic experiments showed that DC-NLCs had significant inhibitory effect on liver fibrosis.It is feasible to apply BBD-RSM for the formulation optimization of DC-NLCs, and DC-NLCs had significant inhibitory effect on liver fibrosis.
dehydrocavidine; nanostructured lipid carriers; Box-Behnken design-response surface method; sustained release; MTT colorimetric method; pharmacodynamic evaluation; solvent evaporation method; liver fibrosis
R283.6
A
0253 - 2670(2022)22 - 7019 - 10
10.7501/j.issn.0253-2670.2022.22.005
国家自然科学基金资助项目(81960756);国家自然科学基金资助项目(81360689);广西自然科学基金资助项目(2022GXNSFDA 035063);广西自然科学基金资助项目(2018GXNSFAA050078);广西自然科学基金资助项目(2015GXNSFAA139173);广西高校中青年教师科研基础能力提升基金资助项目(2019KY0148);广西高校中青年教师科研基础能力提升基金资助项目(2019KY0315)
苏晓丹(1996—),女,硕士研究生,研究方向为中药新剂型与新技术。
黄秋洁(1979—),女,副教授,主要从事中药新剂型与新技术研究。Tel: 13737172226 E-mail: hqj8@163.com
叶 勇(1979—),男,博士,副教授,主要从事民族药药效物质及其新制剂研究。Tel: 13978679458 E-mail: yong-ye@163.com
[责任编辑 郑礼胜]

