黄芪趁鲜切制饮片与传统饮片化学成分及体外抗氧化活性比较研究
吴红伟,李东辉,宋沁洁,李国峰,李咸慰,杨新荣,李越峰, 3*
黄芪趁鲜切制饮片与传统饮片化学成分及体外抗氧化活性比较研究
吴红伟1, 2,李东辉1, 2,宋沁洁1, 2,李国峰1, 2,李咸慰1, 2,杨新荣1, 2,李越峰1, 2, 3*
1. 甘肃中医药大学,甘肃 兰州 730000 2. 甘肃省中药质量与标准研究重点实验室,甘肃 兰州 730000 3. 甘肃省中药制药工艺工程研究中心,甘肃 兰州 730000
采用HPLC、UV等方法测定并比较黄芪趁鲜切制饮片与黄芪传统饮片的指标性成分及体外抗氧化活性,为不同加工方式的黄芪饮片质量控制提供科学依据。采用HPLC、UV等方法对黄芪趁鲜切制饮片与黄芪传统饮片的7种指标性成分(黄芪甲苷、毛蕊异黄酮葡萄糖苷、芒柄花苷、毛蕊异黄酮、总黄酮、总多糖、水溶性浸出物)进行含量测定,采用熵权法结合逼近理想解排序法(technique for order preference by similarity to ideal solution,TOPSIS)评价不同产地加工方式对黄芪药材质量的影响,并结合主成分分析(principal component analysis,PCA)和偏最小二乘判别分析(partial least squares discriminant analysis,PLS-DA)等化学计量学方法对黄芪趁鲜切制饮片与黄芪传统饮片进行区分和比较,同时以DPPH自由基、羟基自由基和ABTS自由基清除能力为评价指标对黄芪趁鲜切制饮片与黄芪传统饮片的体外抗氧化活性进行比较。通过熵权综合评分法比较2种不同加工方式对黄芪饮片质量的影响,结果发现黄芪趁鲜切制饮片综合评分均高于黄芪传统饮片;同时,黄芪趁鲜切制饮片组与黄芪传统饮片组在体外抗氧化活性方面,DPPH自由基清除能力的半抑制浓度(half maximal inhibitory concentration,IC50)分别为5.560、8.168 mg/mL,羟基自由基清除能力的IC50分别为10.994、15.045 mg/mL,ABTS自由基清除能力的IC50分别为8.126、14.546 mg/mL,表明黄芪趁鲜切制饮片体外抗氧化活性强于黄芪传统饮片。通过熵权TOPSIS综合评分法结合化学计量学分析方法及体外抗氧化活性对黄芪趁鲜切制饮片与黄芪传统饮片进行分析,为不同加工方式的黄芪饮片质量控制提供参考。
黄芪;产地加工;体外抗氧化;化学模式识别分析;质量控制;黄芪甲苷;毛蕊异黄酮葡萄糖苷;芒柄花苷;毛蕊异黄酮;总黄酮;总多糖;水溶性浸出物
黄芪为豆科黄芪属植物蒙古黄芪(Fisch.) Bge. var.(Bge.) Hsiao或膜荚黄芪(Fisch.) Bge.的干燥根。具有补气升阳、固表止汗、利水消肿、生津养血、行滞通痹、托毒排脓、敛疮生肌等功效[1]。现代研究表明,黄芪具有增强机体免疫力[2]、抗氧化[3]、利尿[4]、保护肝肾[5]及抗肿瘤[6]等药理作用。中药材产地加工是指将采收到的中药材经过初步加工和干燥处理等过程后形成商品药材的过程,是影响中药材品质的重要环节[7],课题组前期研究发现,产地加工方式对黄芪品质的形成具有重要影响[8-9]。现代研究表明黄芪主要化学成分包括黄酮类、多糖类、皂苷类及氨基酸类[10],而《中国药典》2020年版以黄芪甲苷、毛蕊异黄酮葡萄糖苷为含测指标性成分对黄芪进行质量评价,对黄芪药材及饮片质量控制具有一定指导意义,但黄芪除含有以上化学成分外,还含有黄芪多糖、毛蕊异黄酮等成分,这些成分也为黄芪增强免疫、抗肿瘤、抗氧化作用的活性成分,在黄芪的质量评价中不宜忽视。因此,本研究在《中国药典》2020年版的基础上将芒柄花苷、毛蕊异黄酮、总黄酮、总多糖、水溶性浸出物作为考察指标,对黄芪趁鲜切制饮片与传统饮片的化学成分进行比较。同时,基于黄芪甲苷、黄芪多糖、毛蕊异黄酮葡萄糖苷、毛蕊异黄酮、芒柄花苷均具有较强的抗氧化活性,故本研究对黄芪趁鲜切制饮片与传统饮片的体外抗氧化活性加以比较,进一步阐明黄芪趁鲜切制工艺的可行性,为黄芪产地加工工艺提供科学指导,为不同加工方法所得黄芪饮片质量控制提供参考。
1 仪器与试药
1.1 仪器
Agilent 1260型系列高效液相色谱仪、ELSD蒸发光散射检测器,美国Agilent公司;KQ-500DE型数控超声波清洗器,昆山市超声仪器有限公司;HH-S28s型数显恒温水浴锅,金坛市大地自动化仪器厂;HX502T型电子分析天平,慈溪市天东衡器厂;766-6型远红外辐射干燥箱,上海锦屏仪器仪表有限公司;LFP-500A型粉碎机,上海菲力博实业公司;3SHB-3型循环水多用真空泵,郑州杜甫仪器厂;L2-5K型离心机,湖南可成仪器设备有限公司;UV-power型紫外分光光度计,北京莱伯泰科仪器股份有限公司;A1111型旋转蒸发仪,上海亚荣生化仪器厂;SW22型恒温水浴振荡器,上海巴玖实业有限公司。
1.2 试药
3批黄芪药材采自甘肃岷县,经甘肃中医药大学中药鉴定教研室王明伟副教授鉴定为蒙古黄芪(Fisch.) Bge. var.(Bge.) Hsiao的新鲜根,将黄芪药材按不同产地加工方式处理,干燥、粉碎后过4号筛,置于干燥器中,备用。
对照品黄芪甲苷(批号PS010428,质量分数≥98%)、毛蕊异黄酮葡萄糖苷(批号PS000687,质量分数≥98%)、芒柄花苷(批号PS000674,质量分数≥98%)、毛蕊异黄酮(批号PS010251,质量分数≥98%)、-葡萄糖(批号PS020418,质量分数>98%)均购自成都普思生物科技有限公司;甲醇(批号20200302)、甲酸(批号20171201);正丁醇(批号20190801)、氨水(批号20200706)均购自天津大茂化学试剂厂;1,1-二苯基-2-三硝基苯肼(批号S21J11M116469)、2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(批号A02GS143434)均购自上海源叶生物科技有限公司;FeSO4,批号20191101,购自烟台市双双化工有限公司;水杨酸,批号20210212,购自天津市风船化学试剂科技有限公司;过硫酸钾,批号20201120,购自天津市凯通化学试剂有限公司;水为娃哈哈纯水。
2 方法与结果
2.1 不同加工处理方式制备黄芪饮片
2.1.1 黄芪趁鲜切制饮片的制备 黄芪趁鲜切制饮片工艺制备方法采用课题组前期优选出来的工艺进行制备[8]。将刚采挖的黄芪药材除去杂质及非药用部位,晾晒至含水量为50%,进行发汗和揉搓处理,发汗时长3 d(普通发汗法),揉搓次数2次,每次时长5 min,2项操作交替进行,清洗、切制,将切制所得饮片置于远红外辐射干燥箱中,饮片铺设厚度约为1.0~1.5 cm,51 ℃条件下干燥,最终得到黄芪趁鲜切制饮片。
2.1.2 黄芪传统饮片的制备 将黄芪药材晾晒至一定程度(含水量约为40%),揉搓2次(每次揉搓完成后晾晒1 d),洗去表面杂质,切制、晒干,得到黄芪传统饮片。
2.2 黄芪趁鲜切制饮片与传统饮片外观性状的比较
中药饮片外观性状在一定程度上能反映其内在质量,本研究发现,黄芪趁鲜切制饮片与黄芪传统饮片性状均符合《中国药典》2020年版规定,呈类圆形或椭圆形的厚片(2~4 mm),外表皮黄白色至淡棕褐色,可见纵皱纹或纵沟。切面皮部黄白色,木部淡黄色,有放射状纹理及裂隙,但黄芪趁鲜切制饮片较黄芪传统饮片外表皮及切面颜色均加深,其原因可能与黄芪趁鲜切制饮片发汗过程有密切关系。
2.3 HPLC-蒸发光散射检测(ELSD)法测定黄芪甲苷含量
2.3.1 色谱条件 色谱柱为HC-C18柱(250 mm×4.6 mm,5 μm);以乙腈-水(40∶60)为流动相,等度洗脱;柱温30 ℃;体积流量1 mL/min;进样体积10 μL;蒸发光检测器:漂移管温40 ℃,载气体积流量1.5 mL/min。黄芪甲苷对照品及黄芪样品的HPLC图见图1。
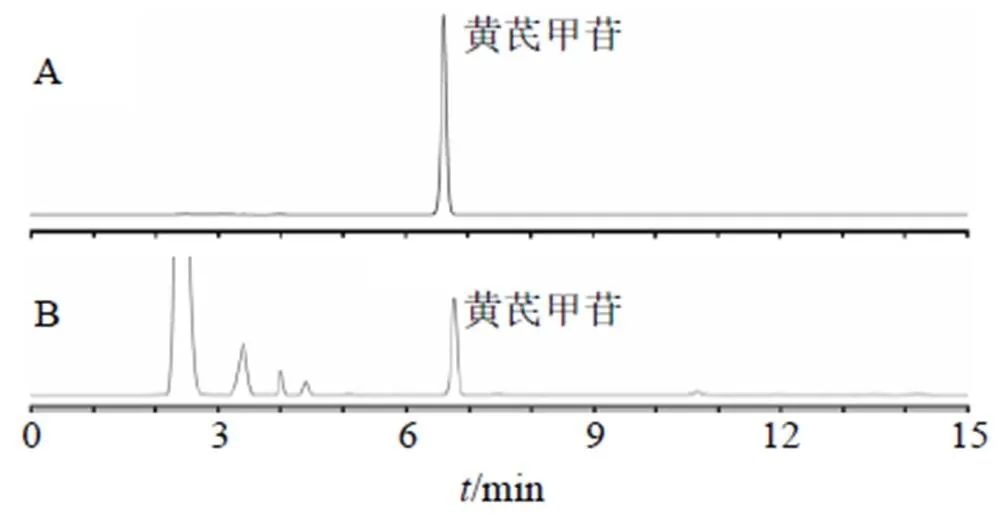
图1 黄芪甲苷对照品 (A) 和黄芪样品 (B) 的HPLC- ELSD图
2.3.2 对照品溶液的制备 精密称取黄芪甲苷对照品25.00 mg于10 mL量瓶中,加甲醇超声使其完全溶解,制成质量浓度为2.5 mg/mL的对照品溶液。
2.3.3 供试品溶液的制备 取各样品粉末约4 g,精密称定,加甲醇40 mL,回流提取1 h,抽滤,重复以上操作2次,合并滤液,减压浓缩后加10 mL水溶解,加40 mL水饱和的正丁醇萃取,重复操作2次,合并萃取液并加入40 mL氨试液萃取,重复操作2次;将萃取液转移至圆底烧瓶中,减压浓缩,加甲醇定容至5 mL量瓶中,0.45 μm微孔滤膜滤过,备用。
2.3.4 线性关系考察 精密吸取黄芪甲苷对照品储备液0.3、0.4、0.5、0.6、0.7、0.9 mL至2 mL量瓶中并用色谱甲醇定容至刻度。每个不同质量浓度的对照品溶液按“2.3.1”项下色谱条件进样10 μL测定峰面积,对不同质量浓度的对照品溶液和峰面积求自然对数,以进样量的对数为横坐标(),峰面积对数为纵坐标()进行线性回归,绘制标准曲线,求得线性方程为=1.680 7+2.166 1,2=0.999 5,表明黄芪甲苷在3.771~11.313 μg线性关系良好。
2.3.5 方法学考察 按照《中国药典》2020年版[1]方法对实验稳定性、重复性、精密度、加样回收率进行考察,其RSD值均分别为1.77%、1.35%、1.68%、1.17%,平均加样回收率为97.00%。
2.3.6 样品含量测定 精密称取各黄芪样品粉末(过4号筛)4 g,分别按“2.3.3”项下方法制备供试品溶液,并按照“2.3.1”项下色谱条件测定,计算黄芪甲苷含量。
2.4 HPLC-二极管阵列检测器(DAD)法测定毛蕊异黄酮葡萄糖苷、毛蕊异黄酮、芒柄花苷含量
2.4.1 色谱条件 色谱柱为HC-C18柱(250 mm×4.6 mm,5 μm);检测波长260 nm;柱温30 ℃;体积流量1 mL/min;进样体积5 μL;流动相为乙 腈-0.2%甲酸水溶液,梯度洗脱程序:0~20 min,20%~40%乙腈;20~30 min,40%乙腈。混合对照品及黄芪样品HPLC图见图2。

图2 混合对照品 (A) 和黄芪样品(B) 的HPLC-DAD图
2.4.2 混合对照品溶液的制备 分别精密称取毛蕊异黄酮葡萄糖苷对照品10.11 mg、毛蕊异黄酮对照品4.98 mg、芒柄花苷对照品3.30 mg分别定容至10 、5 、10 mL量瓶中并用色谱甲醇定容至刻度,制成质量浓度分别为1.011、0.996、0.330 mg/mL的对照品溶液。分别吸取上述对照品溶液0.08、0.07、0.15 mL至10 mL量瓶中并用色谱甲醇定容至刻度,摇匀,制成混合对照品溶液。
2.4.3 供试品溶液的制备 取黄芪样品粉末约2 g,精密称定,置100 mL圆底烧瓶中,精密加入甲醇40 mL,加热回流1 h,抽滤,滤渣加40 mL甲醇回流提取1 h,合并2次所得滤液,于旋转蒸发仪减压浓缩并用色谱甲醇定容至5 mL,0.45 μm微孔滤膜滤过,备用。
2.4.4 线性关系考察 分别取“2.4.2”项下各对照品溶液,体积为0.05、0.20、0.30、0.40、0.50、0.60 mL的毛蕊异黄酮葡萄糖苷对照品溶液于2 mL量瓶中并用色谱纯甲醇定容至刻度;体积为0.03、0.10、0.15、0.20、0.25、0.30 mL的毛蕊异黄酮对照品溶液于2 mL量瓶中并用色谱纯甲醇定容至刻度;体积为0.1、0.3、0.7、0.9、1.3、1.7 mL的芒柄花苷对照品溶液于2 mL量瓶中并用色谱纯甲醇定容至刻度。按照“2.4.1”项下色谱条件进行检测,进样量5 µL。以峰面积为纵坐标(),进样质量浓度为横坐标(),绘制标准曲线,计算回归方程,结果分别为毛蕊异黄酮葡萄糖苷=19 079-26.369,2=0.999 7,线性范围25.28~303.30 μg/mL;毛蕊异黄酮=26 723-38.364,2=0.999 7,线性范围14.94~149.40 μg/mL;芒柄花苷=14 485-12.39,2=0.999 8,线性范围16.50~280.50 μg/mL;结果表明,毛蕊异黄酮葡萄糖苷、毛蕊异黄酮、芒柄花苷在相应质量浓度间线性关系良好。
2.4.5 方法学考察 按照《中国药典》2020年版[1]方法对实验进行方法学考察,得到毛蕊异黄酮葡萄糖苷、毛蕊异黄酮、芒柄花苷稳定性的RSD在0.97%~1.13%,重复性的RSD在1.15%~2.38%,精密度的RSD在0.97%~2.16%。平均加样回收率分别为98.00%、97.00%、97.00%,RSD分别为0.79%、1.89%、1.15%。
2.4.6 样品含量测定 精密称取各黄芪样品粉末(过4号筛)2 g,分别按“2.4.3”项下方法制备供试品溶液,并按照“2.4.1”项下色谱条件测定,计算毛蕊异黄酮葡萄糖苷、毛蕊异黄酮、芒柄花苷含量。
2.5 总多糖含量测定[11]
2.5.1 对照品溶液的制备 精密称取-葡萄糖对照品0.042 g,加纯水定容至100 mL,摇匀,制得含-葡萄糖0.42 mg/mL的对照品溶液。分别取3、4、5、6、7、8 mL上述对照品溶液定容至50 mL,得到不同质量浓度的对照品溶液,待测。
2.5.2 供试品溶液的制备 取各样品粉末约1 g,精密称定,置圆底烧瓶中,加水100 mL回流提取1 h,离心,取沉淀重复上述操作1次,合并上清液,浓缩至适量,转移至100 mL量瓶中,加水至刻度,摇匀。精密量取5 mL,加乙醇26 mL,涡旋使混匀,离心,取沉淀加水溶解并置于250 mL量瓶中,稀释至刻度,摇匀,待测。
2.5.3 显色及测定 取不同质量浓度对照品溶液及供试品溶液各2 mL置于具塞试管中,加入5%苯酚溶液1 mL,充分混匀,再加入5 mL浓硫酸,混匀,于40 ℃水浴锅加热15 min后取出,冷却,采用紫外分光光度计于490 nm测定吸光度()值。
2.5.4 线性关系考察 精密吸取“2.5.1”项下不同浓度的对照品溶液各2 mL置于具塞试管中,加入5%苯酚溶液1 mL,充分混匀,再加入5 mL浓硫酸,混匀,于40 ℃水浴锅加热15 min后取出,水浴冷却,采用紫外分光光度计于490 nm测定值。以质量浓度为横坐标(),值为纵坐标(),绘制葡萄糖标准曲线,进行线性回归,得回归方程=0.014 8-0.045 9,2=0.999 5,结果表明,在25.2~67.2 µg/mL内,葡萄糖对照品的检测质量浓度与值呈良好的线性关系。
2.5.5 方法学考察 按照《中国药典》2020年版[1]方法对实验稳定性、重复性、精密度、加样回收率进行考察,RSD分别为2.93%、2.63%、0.94%、1.60%,平均加样回收率为95.90%。
2.5.6 样品含量测定 精密称取各黄芪样品粉末(过4号筛)2 g,分别按“2.5.2”项下方法制备供试品溶液,并按照“2.5.3”项下方法处理,测定值并计算总多糖含量。
2.6 总黄酮含量测定
2.6.1 对照品溶液的制备 精密称取毛蕊异黄酮葡萄糖苷2.50 mg,加70%乙醇定容至100 mL量瓶中,制成含0.025 mg/mL毛蕊异黄酮葡糖糖苷的对照品溶液;分别吸取上述对照品溶液1、2、3、4、5 mL至10 mL量瓶中并定容至刻度,采用紫外分光光度计于260 nm下测定值。
2.6.2 供试品溶液的制备 取黄芪粉末约0.3 g,精密称定,置于锥形瓶中,加70%乙醇50 mL,称定总质量后超声提取(500 W、50 Hz)30 min,称定质量,用70%乙醇补足减失的质量,抽滤,取续滤液2 mL定容至10 mL量瓶中,于260 nm下测定值。
2.6.3 线性关系考察 精密吸取“2.6.1”项下不同质量浓度的对照品溶液,采用紫外分光光度计于260 nm测定值。以质量浓度为横坐标(),值为纵坐标(),绘制毛蕊异黄酮葡萄糖苷标准曲线,进行线性回归,得回归方程=0.051 3+0.031 3,2=0.999 8,结果表明,在2.5~15.0 µg/mL葡萄糖对照品的检测质量浓度与值呈良好的线性关系。
2.6.4 方法学考察 按照《中国药典》2020年版[1]方法对实验稳定性、重复性、精密度、加样回收率进行考察,RSD分别为2.84%、0.95%、0.12%、0.73%,平均加样回收率为98.10%。
2.6.5 样品含量测定 精密称取各黄芪样品粉末(过4号筛)2 g,按“2.6.2”项下方法制备供试品溶液,测定值并计算总黄酮含量。
2.7 浸出物含量测定
依据《中国药典》2020年版第四部水溶性浸出物测定法(通则2201)项下冷浸法测定。
2.8 综合评分计算[12-13]
熵权法是一种根据多项指标所提供的信息来确定各指标权重的客观赋权法。信息熵作为体系混乱程度的度量,指标熵值越小,则它所蕴涵的信息量越大,在综合评价中所起作用也越大,其权重也应越高,具体计算方法如下。
①利用公式(1)进行数据归一化处理。
X′=(X-min)/(max-min) (1)
为第个指标下第组的含量,max为每个指标下测得的含量最大值,min为每个指标下测得的含量最小值
②采用公式(2)、(3)定义信息熵(E)。
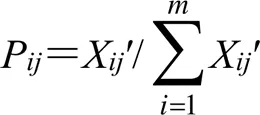

P为第个指标下第组的概率,且0≤P≤1;E为各指标的信息熵,当P=0时,lnP无意义,故当P=0时,将lnP修正为0
③利用公式(4)计算指标的熵权系数(w)。
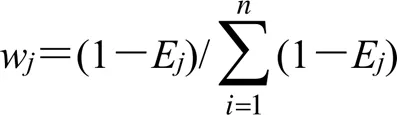
w为熵权系数,且0≤w≤1
课题组在前期预试验中[8-9],应用熵权法计算得到黄芪甲苷质量分数(1)、毛蕊异黄酮葡萄糖苷质量分数(2)、芒柄花苷质量分数(3)、毛蕊异黄酮质量分数(4)、总黄酮质量分数(5)、总多糖质量分数(6)、水溶性浸出物质量分数(7)的w分别为0.157、0.138、0.234、0.117、0.163、0.121、0.069,则综合评分()=1×0.157+2×0.138+3×0.234+4×0.117+5×0.163+6×0.121+7×0.069。
2.9 基于化学计量学方法的黄芪趁鲜切制饮片与传统饮片的比较
将“1.2”项下的3批黄芪药材采用传统加工工艺和趁鲜切制加工工艺进行产地加工,得到传统组1~3(T1~T3)和趁鲜切制1~3(Q1~Q3)共6组黄芪饮片,分别按照“2.3”~“2.7”项方法测定6组黄芪饮片中各指标成分含量并计算其质量分数(1~7),按照“2.8”项方法计算不同试验组别中各指标成分的综合评分(),结果见表1。
为进一步比较黄芪趁鲜切制饮片与传统饮片间的差异,寻找不同加工方式对黄芪化学成分的影响,本研究采用化学计量学方法,以7个指标性成分的含量为变量,对黄芪趁鲜切制饮片与传统饮片进行分析。

表1 黄芪趁鲜切制饮片与传统饮片指标性成分的综合评分比较
2.9.1 主成分分析(principal component analysis,PCA) 采用SIMCA 14.1统计学软件对3批黄芪趁鲜切制饮片Q1~Q3与3批传统饮片T1~T3进行PCA,得分矩阵图见图3,模型参数2值及预测能力参数2值分别为0.704、0.731。结果显示6批黄芪样品可被分为2组,其中黄芪趁鲜切制饮片(Q1~Q3)为1组,黄芪传统饮片(T1~T3)为1组,结果表明黄芪趁鲜切制饮片加工工艺与黄芪传统加工工艺具有一定差异。
2.9.2 偏最小二乘判别分析(partial least squares discriminant analysis,PLS-DA) 为了进一步区分不同加工方式对黄芪饮片及寻找差异成分,在经过PCA基础上,本研究进一步采用PLS-DA对黄芪趁鲜切制饮片Q1~Q3与传统饮片T1~T3进行分析。以7个指标性成分的含量作为输入变量得到相应模型,结果见图4、5。建立的PLS-DA模型中,累积解释能力参数2和2分别为0.817和0.984,预测能力参数2为0.956,2和2均大于0.5,表明所建模型具有一定的稳定性及可靠性,可用于评价和区分不同加工方式所得黄芪趁鲜切制饮片与传统饮片。同时,研究结果发现PLS-DA得分图与PCA结果相似,不同加工方式所得黄芪趁鲜切制饮片与传统饮片被很好地分为2类。

图3 黄芪不同加工方式饮片PCA图

图4 黄芪不同加工方式饮片PLS-DA图

图5 黄芪不同加工方式饮片PLS-DAVIP值
根据模型中变量权重要性排序(VIP)预测值来筛选出具有统计学意义的差异成分,在95%的置信区间,选出VIP>1.0的变量作为差异化合物,芒柄花苷、总多糖、毛蕊异黄酮、毛蕊异黄酮葡萄糖苷的VIP值分别为1.168、1.162、1.158、1.072,因此确定芒柄花苷、总多糖、毛蕊异黄酮、毛蕊异黄酮葡萄糖苷为不同加工方式所得黄芪趁鲜切制饮片与传统饮片的差异性化合物,可以作为区分和评价黄芪趁鲜切制饮片与传统饮片的指标性成分。
2.10 黄芪趁鲜切制饮片与传统饮片体外抗氧化活性比较
2.10.1 溶液的制备 精密称定黄芪传统饮片组T1、趁鲜切制饮片组Q1样品粉末1 g,置于圆底烧瓶中,加水100 mL,提取1 h,重复上述操作1次,合并上清液,浓缩至适量,转移至10 mL量瓶中,加水至刻度,摇匀,制得质量浓度为100 mg/mL的母液,4 ℃保存。
使用维生素C(VC)作为阳性对照组,其系列质量浓度分别为0.625、1.250、2.500、5.000、10.000、20.000、30.000、40.000、50.000 mg/mL。
2.10.2 DPPH自由基清除能力的测定 DPPH自由基清除实验常用于评价植物中化合物的自由基清除力[14]。本实验参考薛志远[3]研究方法并在其基础上稍作修改。精密称取20 mg DPPH,加甲醇使其溶解并定容至250 mL量瓶中,使其成为0.2 mmol/L反应溶液,避光,4 ℃保存,备用。将“2.10.1”项下取提前配制好的母液加水稀释成相当于原生药材的系列质量浓度溶液(0.625、1.250、2.500、5.000、10.000、20.000、30.000、40.000、50.000 mg/mL),将不同质量浓度的药材溶液及DPPH反应溶液各取2 mL并加入同一试管中混匀,于避光处反应30 min,测其在517 nm波长的值,记录为A,测定0.2 mmol/L DPPH溶液2 mL与2 mL甲醇试剂混合后的值,记为c;2 mL提取物与2 mL甲醇溶液混合后的值,记为A;重复3次[15]。
DPPH自由基清除率=1-(A-A)/c
如图6所示,黄芪原生药材质量浓度为0.625 mg/mL时,黄芪趁鲜切制组与传统组对DPPH自由基的清除能力较低,而随着黄芪原生药材质量浓度的不断升高,其提取物对DPPH自由基的清除率具有剂量依赖性,当黄芪趁鲜切制组与黄芪传统组原生药材质量浓度从0.625 mg/mL上升到10.000 mg/mL时,对DPPH自由基的清除能力分别迅速上升到77.18%和70.25%。此后,随着黄芪原生药材质量浓度的增加,对DPPH自由基的清除率增加缓慢,黄芪趁鲜切制组与黄芪传统组别的IC50分别为5.560、8.168 mg/mL,表明黄芪趁鲜切制组较黄芪传统组DPPH自由基清除力强。而阳性对照组质量浓度为0.625 mg/mL时,对DPPH自由基的清除率已经达到93.81%。此后,随着质量浓度的增加,其对DPPH自由基的清除率无明显变化。

图6 黄芪总提取物对DPPH自由基的清除能力
2.10.3 羟基自由基清除能力的测定 羟基自由基对生物体有较强的毒性,也常用于评价植物提取物体外抗氧化活性研究[16],羟基自由基所致损害引起广泛关注[17]。本实验参考Chen等[18]的研究方法并稍作修改。羟基自由基反应液:1 mL FeSO4溶液(9 mmol/L)+2 mL水杨酸-无水乙醇溶液(9 mmol/L)。将“2.10.1”项下提前配置的母液加水稀释成相当于原生药材的系列质量浓度溶液(0.625、1.250、2.500、5.000、10.000、20.000、30.000、40.000、50.000 mg/mL),取不同质量浓度的药材溶液2 mL、9 mmol/L H2O2反应液1 mL及羟基自由基3 mL加入同一试管中混合均匀后37 ℃反应30 min,测其在510 nm波长的值,记录为A;测羟基自由基3 mL、9 mmol/L H2O2反应液1 mL及2 mL双蒸馏水混合后的值,记为c;2 mL提取液、羟基自由基3 mL及双蒸馏水1 mL混合后的值,记为A;重复3次。
羟自由基清除率=1-(A-A)/A
如图7所示,当黄芪原生药材质量浓度为0.625~5.000 mg/mL,黄芪趁鲜切制组与传统组对羟基自由基的清除能力较低,而随着黄芪原生药材质量浓度的逐渐增加,其提取物对羟基自由基的清除率也随之增加,并呈上升趋势,当黄芪趁鲜切制组与黄芪传统组原生药材质量浓度上升到10.000 mg/mL时,对羟基自由基的清除能力迅速上升到46.242%和40.494%。此后,随着黄芪原生药材质量浓度的增加,对羟基自由基的清除率增加缓慢,黄芪趁鲜切制组与黄芪传统组的IC50分别为10.994、15.045 mg/mL,表明黄芪趁鲜切制组较黄芪传统组羟基自由基清除力强。而阳性对照组质量浓度从0.625 mg/mL开始,对羟基自由基的清除率迅速升高,当其质量浓度为10.000 mg/mL时,对羟基自由基的清除率达到97.244%。此后,随着质量浓度的增加,其对羟基自由基的清除率无明显变化,其IC50=3.572 mg/mL。
2.10.4 ABTS自由基清除能力的测定 Miller等[19]于1993年首次介绍了通过清除ABTS来评价物质的抗氧化能力的方法,根据待测物对ABTS自由基的清除能力,采用传统分光光度法进行测定,进而对其抗氧化活性大小进行评价,本实验参考Souza等[20]的方法并稍作修改。将5 mL质量浓度为2.5 mmol/L过硫酸钾溶液与7 mmol/L ABTS溶液充分混匀,在4 ℃、避光条件下静置12~16 h,3~4 d内使用,使用前取1 mL混合液,加入超纯水稀释,使得溶液在734 nm下值为0.7±0.2。将“2.10.1”项下母液加水稀释成相当于原生药材的系列质量浓度溶液(0.625、1.250、2.500、5.000、10.000、20.000、30.000、40.000、50.000 mg/mL),取不同质量浓度的药材溶液0.1 mL,加入3.9 mL ABTS反应液,摇匀,室温下避光反应7 min,在734 nm处测定值,记为1;以3.9 mL水代替3.9 mL ABTS反应液测定值,记作2;空白对照中的样品溶液用水代替,记为0;VC作阳性对照[21]。

图7 黄芪总提取物对羟基自由基的清除能力
ABTS自由基清除率=1-(1-2)/0
如图8所示,黄芪原生药材质量浓度为0.625 mg/mL时,黄芪趁鲜切制组与传统组对ABTS自由基的清除能力较低。随着黄芪原生药材质量浓度的不断升高,其提取物对ABTS自由基的清除率具有剂量依赖性,黄芪趁鲜切制组与黄芪传统组原生药材质量浓度在0.625~20.000 mg/mL,对ABTS自由基的清除能力上升较快,当黄芪趁鲜切制组与黄芪传统组原生药材质量浓度大于20.000 mg/mL后,分别迅速上升到77.18%和70.25%。此后,随着黄芪原生药材质量浓度的增加,对ABTS自由基的清除率增加缓慢;黄芪趁鲜切制组与黄芪传统组别的IC50分别为8.126、14.546 mg/mL,表明黄芪趁鲜切制组较黄芪传统组ABTS自由基的清除力强。而阳性对照组质量浓度为0.065 mg/mL时,对ABTS自由基的清除率已经达到95.188%。此后随着质量浓度的增加,其对ABTS自由基的清除率无明显变化。
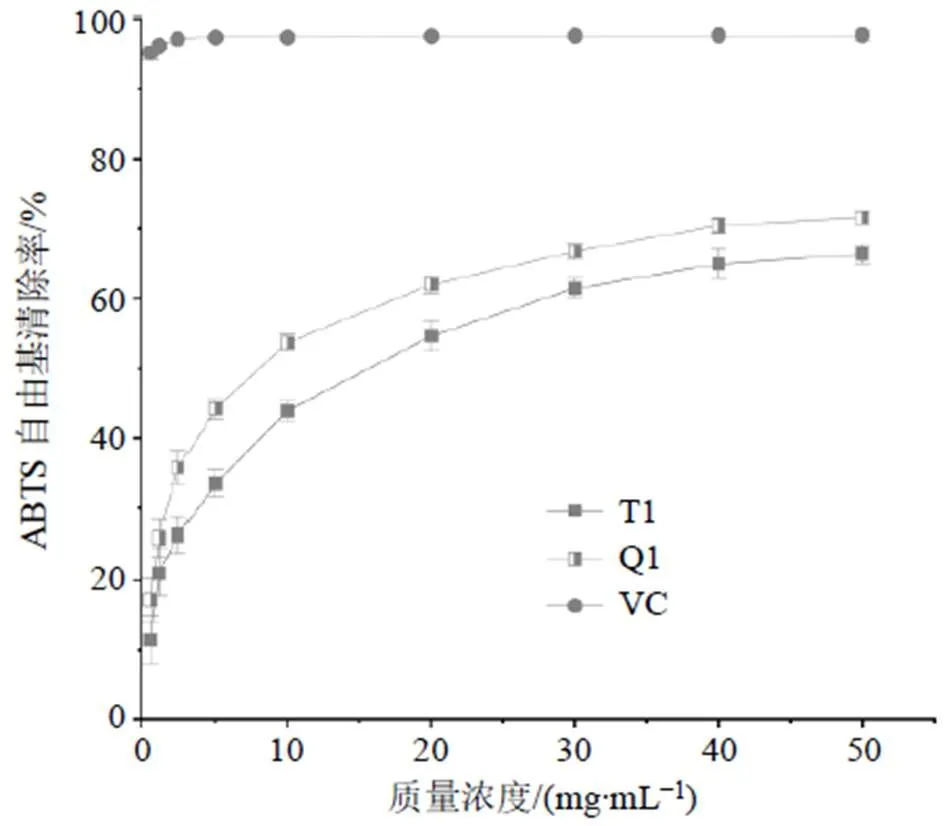
图8 黄芪总提取物对ABTS自由基的清除能力
3 讨论
黄芪药材产地加工在其品质形成过程中发挥重要作用,本研究以黄芪甲苷、毛蕊异黄酮葡萄糖苷、芒柄花苷、毛蕊异黄酮、总黄酮、总多糖、水溶性浸出物为指标,通过熵权综合评分法比较2种不同加工方式对黄芪饮片质量的影响,发现黄芪趁鲜切制饮片及传统饮片在化学成分上具有一定差异,整体表现为黄芪趁鲜切制饮片质量优于传统饮片。但在黄芪趁鲜切制饮片与传统饮片的化学成分比较结果中,黄芪趁鲜切制组与传统组组内同一指标出现较大差异,其主要原因在于不同产地黄芪药材质量具有一定差异;此外,由于本研究仅在实验室中进行,切制过程手工完成,切片厚度也可能是组内同一指标出现较大差异的另一重要原因。同时,本研究为了更好地辨识不同加工方式对黄芪饮片质量的影响,采用PCA和PLS-DA,将黄芪趁鲜切制饮片与传统饮片分为2类,筛选出了4个差异化合物,分别是芒柄花苷、总多糖、毛蕊异黄酮、毛蕊异黄酮葡萄糖苷,可作为区分和鉴别不同加工方式的黄芪饮片质量的控制指标。同时,黄芪趁鲜切制饮片与黄芪传统饮片体外抗氧化结果表明:DPPH自由基清除能力的IC50分别为5.560、8.168 mg/mL;羟基自由基清除能力的IC50分别为10.994、15.045 mg/mL;ABTS自由基清除能力的IC50分别为8.126、14.546 mg/mL。上述实验数据表明,黄芪趁鲜切制工艺能在一定程度上避免其化学成分的损失,保证黄芪饮片质量。
此外,本课题组前期研究中发现,黄芪趁鲜切制工艺与传统工艺加工所得饮片质量存在差异,并优选出最佳加工工艺参数。在此基础上,本研究从化学成分和体外抗氧化活性角度对2种不同加工方法所得饮片质量比较,结果表明黄芪趁鲜切制饮片综合质量优于黄芪传统饮片。因此,黄芪趁鲜切制饮片质量标准应在黄芪传统饮片的基础上加以完善,为推广黄芪趁鲜切制饮片加工工艺及其质量控制提供参考。
利益冲突 所有作者均声明不存在利益冲突
[1] 中国药典 [S]. 一部. 2020: 315-316.
[2] 牛江涛, 曹瑞, 司昕蕾, 等. 红芪与黄芪免疫调节和抗氧化作用对比研究进展 [J]. 中华中医药学刊, 2021, 39(4): 21-23.
[3] 薛志远. 红芪和黄芪抗骨质疏松、抗氧化及抗肝损伤作用比较研究 [D].兰州: 兰州大学, 2018.
[4] 高丽, 白赟, 冯学斌, 等. 黄芪及其药对对气虚盐水负荷模型大鼠利尿作用的影响 [J]. 世界中西医结合杂志, 2018, 13(10): 1344-1347.
[5] 刘晔, 车念聪, 杜宇琼, 等. 芪水煎对糖尿病肾病小鼠肝、肾组织细胞外基质调节因子表达的影响 [J]. 环球中医药, 2017, 10(10): 1170-1174.
[6] 曲晓宇, 翟婧卉, 高欢, 等. OCT2/MRP2在黄芪甲苷联合顺铂的减毒增效作用中的机制研究 [J]. 药学学报, 2021, 56(9): 2536-2543.
[7] 吴红伟, 王临艳, 李东辉, 等. 黄芪药材产地加工方法探析 [J]. 中华中医药杂志, 2021, 36(8): 4543-4546.
[8] 吴红伟, 李东辉, 边甜甜, 等. 基于响应面法结合熵权法多指标优选黄芪药材产地加工炮制一体化工艺 [J]. 中草药, 2021, 52(19): 5854-5861.
[9] 吴红伟, 李东辉, 张育贵, 等. 基于熵权TOPSIS模型对不同加工方式黄芪药材质量的综合评价 [J]. 中国药学杂志, 2021, 56(16): 1325-1331.
[10] 马艳春, 胡建辉, 吴文轩, 等. 黄芪化学成分及药理作用研究进展 [J]. 中医药学报, 2022, 50(4): 92-95.
[11] 杜国军. 恒山黄芪道地药材质量标准研究 [D].太原:山西大学, 2013.
[12] 崔曰新, 张景珍, 王思雨, 等. 基于熵权法和灰色关联度法的羌活饮片质量评价研究 [J]. 中草药, 2019, 50(23): 5724-5730.
[13] 王智群, 于亚田, 冯建安, 等. G1-熵权法结合Box- Behnken响应面法优化黄虎胶囊的醇提工艺 [J]. 时珍国医国药, 2020, 31(5): 1110-1113.
[14] 龚敏, 王燕, 张玉. DPPH法评价分析海南曼陀罗果叶抗氧化活性 [J]. 北京农业, 2013(30): 7-8.
[15] 段琦梅, 梁宗锁, 聂小妮, 等. 黄芪和党参提取物的抗氧化活性研究 [J]. 西北植物学报, 2010, 30(10): 2123-2127.
[16] 肖怀秋, 李玉珍. 羟基自由基定量检测技术的研究进展 [J]. 食品与药品, 2010, 12(1): 69-71.
[17] Pei F, Shi Y, Gao X Y,. Changes in non-volatile taste components of button mushroom () during different stages of freeze drying and freeze drying combined with microwave vacuum drying [J]., 2014, 165: 547-554.
[18] Chen L, Zhang Y P, Jin L X,. Preparation, characterization and antioxidant activity of polysaccharide from(Thunb.) Harald [J]., 2018, 108: 259-262.
[19] Miller N J, Rice-Evans C, Davies M J,. A novel method for measuring antioxidant capacity and its application to monitoring the antioxidant status in premature neonates [J]., 1993, 84(4): 407-412.
[20] de Souza D R, Willems J L, Low N H. Phenolic composition and antioxidant activities of saskatoon berry fruit and pomace [J]., 2019, 290: 168-177.
[21] 高海立, 郁吉锋, 黄路瑶, 等. 铁皮石斛叶总黄酮的大孔树脂纯化工艺及抗氧化活性 [J]. 浙江理工大学学报: 自然科学版, 2019, 41(3): 380-386.
Comparative study on chemical composition andanti-oxidant activity offresh-cut pieces and traditional pieces
WU Hong-wei1, 2, LI Dong-hui1, 2, SONG Qin-jie1, 2, LI Guo-feng1, 2, LI Xian-wei1, 2, YANG Xin-rong1, 2, LI Yue-feng1, 2, 3
1. Gansu University of Chinese Medicine, Lanzhou 730000, China 2. Key Laboratory of Standard and Quality of Chinese Medicine Research of Gansu, Lanzhou 730000, China 3. Gansu Engineering Research Center for Chinese Medicine Pharmaceutical Technology, Lanzhou 730000, China
HPLC, UV and other methods were used to determine and compare the index components andantioxidant activities of fresh-cut pieces and traditional pieces of Huangqi (), providing scientific basis for quality control ofpieces with different processing methods.HPLC, UV and other methods were used to determine the contents of 7 index components (astragaloside IV, calycosin-7-glucoside, ononin, calycosin, total flavonoids, total polysaccharides, water-soluble extract) in fresh-cut and traditional pieces of. The effect of different processing methods on the quality ofwas evaluated by the entropy weight method combined with technique for order preference by similarity to an ideal solution (TOPSIS). In addition, chemometric methods such as principal component analysis (PCA) and partial least squares- discriminant analysis (PLS-DA) were used to differentiate and compare the fresh-cut pieces ofwith the traditional pieces of. At the same time, DPPH free radical, hydroxyl free radical and ABTS radical scavenging ability were used as evaluation indexes to compare theantioxidant activity of fresh-cut pieces ofand traditional pieces of.The entropy weight comprehensive score method was used to compare the effects of two different processing methods on the quality ofdecoction pieces. The results showed that the comprehensive score of fresh-cutdecoction pieces was higher than that of traditionaldecoction pieces.antioxidant activities ofin the fresh-cut group and the traditional group were 5.560, 8.168 mg/mL for IC50of DPPH radical scavenging capacity, the IC50of hydroxyl radical scavenging capacity was 10.994, 15.045 mg/mL, and the IC50of ABTS radical scavenging capacity was 8.126, 14.546 mg/mL, respectively. The above results showed that theantioxidant activity of fresh-cut pieces ofwas stronger than that of traditional slices of.In this study, the entropy weight TOPSIS comprehensive scoring method combined with chemometrics analysis method andantioxidant activity were used to analyze the fresh-cut slices and traditional slices of, so as to provide reference for the quality control ofslices with different processing methods.
; producing area processing;antioxidant; chemical pattern recognition analysis; quality control;astragaloside IV; calycosin-7-glucoside; ononin; calycosin; total flavonoids; total polysaccharides; water-soluble extract
R283.6
A
0253 - 2670(2022)22 - 7039 - 09
10.7501/j.issn.0253-2670.2022.22.007
2022-05-23
国家自然科学基金资助项目(81960713);国家自然科学基金资助项目(82160750);基础研究创新群体项目(21JR7RA569);甘肃省教育厅产业支撑计划项目(2021CYZC-21);甘肃省中药制药工艺工程研究中心开放课题(ZYGY202003);国家药品监督管理局中药材及饮片质量控制重点实验室项目(2020GSMPA-KL15);甘肃省高等学校产业支撑计划项目——四种道地陇药绿色规范化产业发展示范推广(2020C-09);民生科技专项(科技特派员专题)——中药材引种驯化与道地药材产业化扶贫示范推广(20CX9 NA070);甘肃省科学技术厅——科技计划(创新基地与人才计划)双一流科研重点项目(GSSYLXM-05);甘肃省中药炮制技术传承基地项目
吴红伟,男,硕士研究生,研究方向为中药及复方加工炮制机制及活性成分研究。Tel: 13519317036 E-mail: 2419161734@qq.com
李越峰,女,教授,博士生导师,研究方向为中药及复方加工炮制机制及活性成分研究。E-mail: lyfyxk@126.com
[责任编辑 郑礼胜]

