细胞角质蛋白19片段抗原21-1、神经元特异性烯醇化酶和鳞状细胞癌抗原在非小细胞肺癌合并恶性胸腔积液患者中的表达及临床意义
赵明娟,刑双丽,高宇
焦作煤业(集团)有限责任公司中央医院呼吸与危重症医学二区,河南 焦作 454000
非小细胞肺癌(non-small cell lung cancer,NSCLC)是肺癌常见的病理类型,占全部肺癌的85%以上,严重威胁患者的生命健康[1]。研究发现,恶性胸腔积液多是由于胸膜受到恶性肿瘤的侵犯所致,而NSCLC常累及胸膜,易引发大量胸腔积液,不仅会影响患者的呼吸、循环功能,还会危及患者的生命安全[2]。因此,如何及时有效地检查NSCLC患者是否合并恶性胸腔积液,提高患者的诊疗效果,改善患者预后是目前研究的热点。细胞角质蛋白19片段抗原21-1(cyto-keratin 19 fragment antigen 21-1,CYFRA21-1)主要分布于支气管、肺泡等上皮细胞中,在良性疾病患者中呈低表达,而在鳞状细胞癌、腺癌等上皮细胞肿瘤中表达水平明显升高[3]。研究发现,神经元特异性烯醇化酶(neuron specific enolase,NSE)是糖酵解的关键酶,由于NSCLC是神经内分泌起源的肿瘤,因此NSE诊断NSCLC具有较高的敏感性[4]。鳞状细胞癌抗原(squamous cell carcinoma antigen,SCC-Ag)是临床中常用的肿瘤标志物,研究指出,SCC-Ag对鳞状上皮细胞癌具有重要的诊断价值[5]。本研究分析CYFRA21-1、NSE和SCC-Ag在NSCLC合并恶性胸腔积液患者中的表达及临床意义,现报道如下。
1 资料与方法
1.1 一般资料
选取2017年3月至2020年3月焦作煤业(集团)有限责任公司中央医院收治的NSCLC患者。纳入标准:①经病理检查确诊为NSCLC[6];②接受影像学检查,经胸腔穿刺明确是否有胸腔积液;③年龄﹥20岁,无意识障碍。排除标准:①合并其他恶性肿瘤;②合并肝肾等重要器官功能障碍;③临床资料不全。依据纳入和排除标准,本研究共纳入107例NSCLC患者作为研究组。其中,男56例,女51例;平均年龄为(65.53±6.32)岁;平均体重指数为(23.21±2.34)kg/m2;合并疾病:高血压27例,糖尿病30例;肺癌类型:腺癌84例,鳞状细胞癌23例;临床分期:Ⅰ期48例,Ⅱ期37例,Ⅲ期22例。根据是否合并恶性胸腔积液将107例NSCLC患者分为合并组和未合并组。另选取同期进行健康体检者130例作为对照组。其中,男68例,女62例;平均年龄为(65.13±6.06)岁;平均体重指数为(24.06±3.14)kg/m2;合并疾病:高血压35例,糖尿病38例。研究组和对照组的性别、年龄、体重指数、合并疾病比较,差异均无统计学意义(P﹥0.05),具有可比性。本研究经医院伦理委员会审批通过,所有患者均知情同意并签署知情同意书。
1.2 检测方法及判定标准
抽取所有受检者的空腹静脉血3 ml,研究组于入院次日清晨抽取,对照组于体检当日清晨抽取,使用乙二胺四乙酸抗凝处理后,3000 r/min离心10 min后取上清液备用。采用化学发光免疫法检测血清CYFRA21-1、NSE和SCC-Ag水平,严格按照说明书进行操作。CYFRA21-1正常参考值为1~3 ng/ml,CYFRA21-1﹥3 ng/ml提示异常升高;NSE正常参考值为4~12 ng/ml,NSE﹥12 ng/ml提示异常升高;SCC-Ag 正常参考值为 0.2~0.9 ng/ml,SCC-Ag﹥0.9 ng/ml提示异常升高。3项指标联合应用时,以三者均在正常参考值范围内为阴性,任意一项不在正常参考值范围内即为阳性。
1.3 观察指标
比较研究组和对照组的CYFRA21-1、NSE和SCC-Ag水平,比较合并组和未合并组的CYFRA21-1、NSE和SCC-Ag水平,分析NSCLC患者合并恶性胸腔积液的影响因素,分析CYFRA21-1、NSE、SCC-Ag单独及三者联合检测对NSCLC患者合并恶性胸腔积液的预测价值。
1.4 统计学方法
采用SPSS 22.0软件对数据进行统计分析,计数资料以例数表示,组间比较采用χ2检验;计量资料以均数±标准差(±s)表示,组间比较采用t检验;采用多元Logistic回归模型分析NSCLC患者合并恶性胸腔积液的影响因素;绘制受试者工作特征(receiver operating characteristic,ROC)曲线,计算曲线下面积(area under the curve,AUC),分析CYFRA21-1、NSE、SCC-Ag单独及三者联合检测对NSCLC患者合并恶性胸腔积液的预测价值;以P﹤0.05为差异有统计学意义。
2 结果
2.1 研究组和对照组CYFRA21-1、NSE和SCC-Ag水平的比较
研究组患者的CYFRA21-1、NSE和SCC-Ag水平均明显高于对照组,差异均有统计学意义(P﹤0.01)。(表1)
表1 研究组和对照组CYFRA21-1、NSE和SCC-Ag水平的比较(ng/ml,±s)
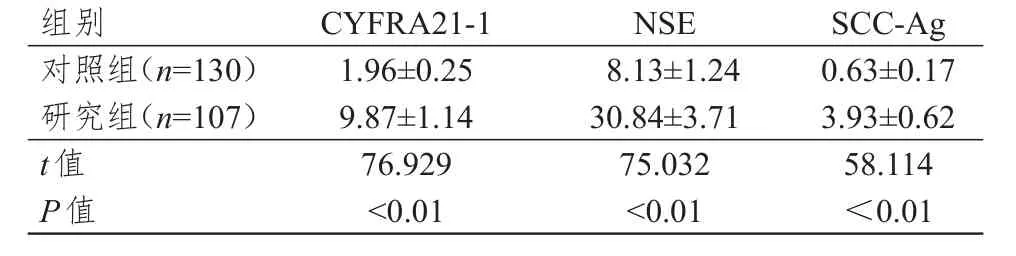
表1 研究组和对照组CYFRA21-1、NSE和SCC-Ag水平的比较(ng/ml,±s)
组别对照组(n=1 3 0)研究组(n=1 0 7)t值P值1.9 6±0.2 5 9.8 7±1.1 4 7 6.9 2 9<0.0 1 8.1 3±1.2 4 3 0.8 4±3.7 1 7 5.0 3 2<0.0 1 0.6 3±0.1 7 3.9 3±0.6 2 5 8.1 1 4<0.0 1 C Y F R A 2 1-1 N S E S C C-A g
2.2 合并组和未合并组CYFRA21-1、NSE和SCC-Ag 水平的比较
107例患者中,合并恶性胸腔积液69例(合并组),未合并恶性胸腔积液38例(未合并组)。合并组患者的CYFRA21-1、NSE和SCC-Ag水平均明显高于未合并组,差异均有统计学意义(P﹤0.01)。(表2)
表2 合并组和未合并组CYFRA21-1、NSE和SCC-Ag水平的比较(ng/ml,±s)

表2 合并组和未合并组CYFRA21-1、NSE和SCC-Ag水平的比较(ng/ml,±s)
组别合并组(n=6 9)未合并组(n=3 8)t值P值1 1.8 4±1.1 5 6.2 9±1.1 2 2 4.1 1 0<0.0 1 3 3.9 4±4.2 1 2 5.2 1±2.8 0 1 1.4 5 2<0.0 1 4.9 2±0.8 1 2.1 3±0.2 8 2 0.5 3 1<0.0 1 C Y F R A 2 1-1 N S E S C C-A g
2.3 NSCLC 患者合并恶性胸腔积液的影响因素
单因素及多因素分析结果显示,血性胸腔积液、临床分期为Ⅲ~Ⅳ期及CYFRA21-1、NSE、SCC-Ag水平异常升高均是NSCLC患者合并恶性胸腔积液的危险因素(P﹤0.05)。(表3)
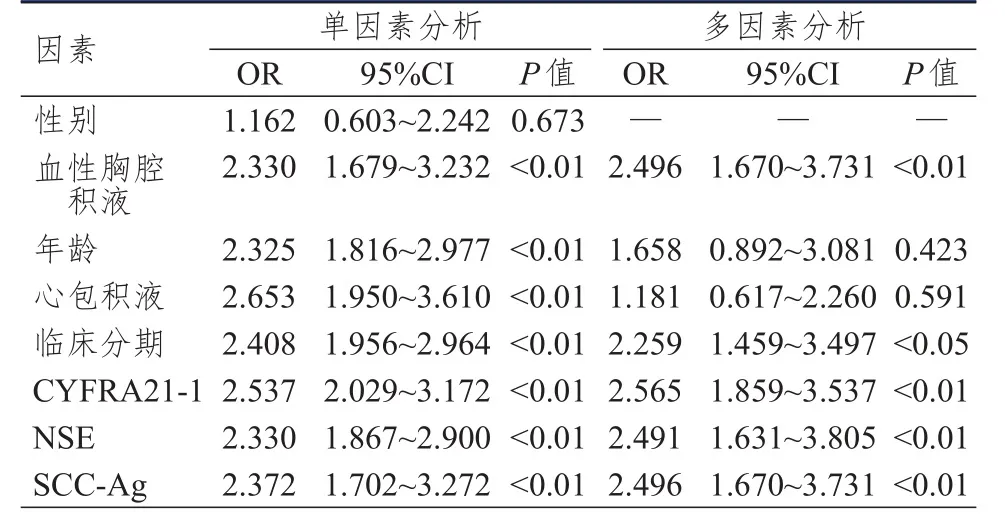
表3 NSCLC患者合并恶性胸腔积液影响因素的单因素及多因素分析
2.4 CYFRA21-1、NSE、SCC-Ag 单独及三者联合检测对NSCLC 患者合并恶性胸腔积液的预测价值
ROC曲线分析结果显示,CYFRA21-1、NSE、SCC-Ag单独及三者联合检测预测NSCLC患者合并恶性胸腔积液的AUC分别为0.948、0.803、0.834及0.976,其中三者联合的预测价值最佳。(表4、图1)
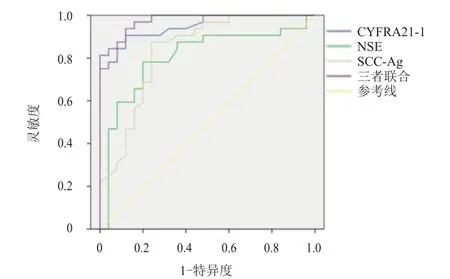
图1 CYFRA21-1、NSE、SCC-Ag 单独及三者联合检测预测NSCLC 患者合并恶性胸腔积液的ROC曲线
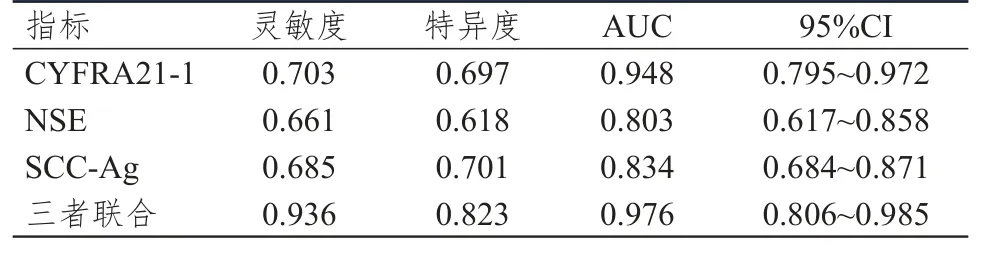
表4 CYFRA21-1、NSE、SCC-Ag单独及三者联合检测对NSCLC患者合并恶性胸腔积液的预测价值
3 讨论
研究表明,恶性胸腔积液是肿瘤晚期常见的并发症,而原发性肺癌的胸膜转移是引起恶性胸腔积液最常见的原因,如何早期干预以避免恶性胸腔积液的发生对肺癌患者具有重要意义[7-8]。
CYFRA21-1是位于上皮细胞内的角蛋白,是肿瘤细胞中蛋白激酶的降解产物[9]。研究表明,CYFRA21-1是诊断NSCLC的血清标志物,其与NSCLC的病理组织类型、临床分期等密切相关,对NSCLC的诊断及预后评估具有重要的临床价值[10]。NSE是神经元和神经内分泌细胞所特有的一种酸性蛋白酶,广泛存在于生物组织细胞内,性质稳定,在血清和脊髓中含量偏低,一旦神经细胞受损,NSE可通过血脑屏障进入血液及脑脊髓,对神经内分泌机制受损具有高度敏感性[11-12]。有研究者采用单克隆技术从肿瘤相关抗原TA4中提纯出一个糖蛋白片段SCC-Ag,其诊断鳞状细胞癌的特异度较高,可有效监测鳞状细胞癌的治疗效果及术后转移、复发情况[13]。本研究结果显示,NSCLC患者中CYFRA21-1、NSE、SCC-Ag水平均明显高于对照组,且合并恶性胸腔积液的NSCLC患者中CYFRA21-1、NSE、SCC-Ag水平更高。说明CYFRA21-1、NSE、SCC-Ag可能参与了NSCLC的病情进展,且与合并恶性胸腔积液有着密切联系。
研究表明,CYFRA21-1水平与胸腔积液患者病情危重程度及预后密切相关[14]。另有研究表明,当患者发生胸腔积液后,体内缺血缺氧,机体免疫功能降低,不仅会使患者出现咳嗽、呼吸困难等临床症状,还会对神经系统、心、肺功能造成影响,引发NSE、SCC-Ag水平升高[15-16]。本研究通过Logistic回归模型分析NSCLC患者合并恶性胸腔积液的影响因素,结果显示,血性胸腔积液、临床分期为Ⅲ~Ⅳ期及CYFRA21-1、NSE、SCC-Ag水平异常升高均是NSCLC患者合并恶性胸腔积液的危险因素(P﹤0.05)。鉴于此,本研究进一步分析CYFRA21-1、NSE、SCC-Ag单独及三者联合检测对NSCLC患者合并恶性胸腔积液的预测价值,结果显示,CYFRA21-1、NSE、SCC-Ag联合检测的预测价值最佳,证实三项指标联合检测可作为预测NSCLC患者合并恶性胸腔积液的有效手段。然而本研究存在一定的局限性:①纳入的病例数较少,可能影响结果;②患者发病至入院的时间不统一,造成血清样本采集时间点不平行。未来可扩大样本量,规范研究对象的入组时间开展进一步研究。
综上所述,NSCLC合并恶性胸腔积液患者中CYFRA21-1、NSE、SCC-Ag水平均异常升高,临床医师可通过加强监测这三项指标,有效预测恶性胸腔积液的发生。

