锑对镁空气电池阳极性能的影响
秦聪慧,马景灵,张 毅,马明生,王广欣
(河南科技大学 a.材料科学与工程学院;b.高纯材料研究中心,河南 洛阳 471023)
0 引言
化学能源的不可再生和稀缺使得新能源开发成为热点,镁空气电池由于理论放电电压高(3.09 V)、理论能量密度高(3 910 Wh·kg-1)等优点而引起了广泛关注[1-2]。而且镁元素储量在地球金属储量中排第6,成为新能源研究开发的助力。然而,镁空气电池缺乏合适的电解质和足够高效的空气阴极催化剂[3];同时,镁阳极在放电过程中存在析氢腐蚀,放电产物Mg(OH)2不容易脱落,这些都会导致镁空气电池的实际放电能力降低[4-5]。为了解决这些问题,文献[6]进行了镁阳极合金化、塑性变形、热处理,电解液中加入缓蚀剂,以及改善空气阴极催化剂等工作。在合金化中,Al、Zn属于可以提高镁阳极耐蚀性的元素[7-8];Pb、Sb属于可以提高镁阳极活性的元素,可促进腐蚀产物从阳极表面脱落。镁合金中既有缓蚀元素又有活化元素,最有利于提高合金的电化学性能。而且Pb、Sb是高析氢过电位元素,可以抑制镁合金在酸性、中性电解液中发生析氢腐蚀[9]。文献[10]研究了加入不同质量分数的Sb对AZ91合金组织的影响,发现Sb没有细化合金晶粒。文献[11]研究了Sb和Y对AZ91合金组织和力学性能的影响,研究结果表明:添加Sb并不会改变β-Mg17Al12相的数量,但显著地细化了β-Mg17Al12相。目前,关于添加Sb元素对镁空气电池阳极性能影响的研究鲜有报道。因此,本文主要分析添加Sb元素后镁合金显微组织和电化学性能的变化,以及这种变化对镁空气电池阳极性能的影响。
1 试验材料与方法
1.1 试验材料
将工业纯Mg (99.9%,质量分数,下同)、纯Al (99.9%)、纯Zn (99.9%)、纯Pb (>99.99%)、纯Sb (>99.99%)去除氧化皮,按Al 6% (质量分数,下同)、Pb 5%、Zn 1%、Sb 0.5%进行配置,依次熔炼Mg-6%Al-1%Zn,Mg-6%Al-5%Pb-1%Zn和Mg-6%Al-5%Pb-1%Zn-0.5%Sb 3种合金,分别简写为AZ61、APZ651、APZ651-0.5Sb,下同。使用真空感应熔炼炉(ZGJL0.01-4C-4型)熔炼,熔炼温度为 (740 ± 10) ℃,在1%SF6+ 99%CO2气体保护下保温5 min,710 ℃时浇铸于清洁后的铸铁模具中,然后自然冷却,使用线切割将合金加工成底面积为1 cm2的圆柱体试样。用扫描电镜(scanning electron microscope,SEM,型号为JSM-7800F)对抛光处理后的试样进行组织形貌及能谱分析,并结合X射线衍射仪(X-ray diffractometer,XRD,型号为D8AdvancedX)研究上述3种镁合金的微观结构。
1.2 电化学性能测试
采用三电极系统在电化学工作站(CHI660E)上进行电化学性能测试。测试电解液为质量分数3.5%的NaCl溶液。所用参比电极为饱和KCl甘汞电极,辅助电极为石墨片电极,工作电极即1.1节中所述的3种镁合金试样。在3.5%NaCl溶液中测试1 000 s的开路电位(open circuit potentical,OCP)后,测试电化学阻抗谱(electrochemical impedance spectroscopy,EIS),测量频率100 kHz~0.1 Hz,初始电位为开路电位。测试动电位极化,扫描速率为2 mV/s,扫描电位为-2~-1.1 V。
1.3 电池性能测试
用铜导电胶将导线连接在去除氧化层的阳极试样上,并用调配好的环氧树脂(m(环氧树脂)∶m(邻苯二甲酸二丁酯)∶m(乙二胺) = 20∶3∶2)将试样密封固定,只裸漏出1 cm2待测试面。测试电池性能前,先将待测试面研磨、抛光,然后使用无水乙醇清洗阳极试样并干燥,称取质量。将阳极与3.5% NaCl溶液、工业空气阴极(催化剂为MnO2,常州优特科新能源科技有限公司)组合成镁空气电池,通过蓝电测试系统(CT2001A)在电流密度分别为5 mA·cm-2、10 mA·cm-2和15 mA·cm-2的工作条件下放电300 min,得到恒流放电曲线。用扫描电镜观察阳极放电后的形貌。最后,用AgNO3/CrO3溶液清洗阳极上的放电产物,并将阳极干燥称质量。根据放电前后阳极的实际质量损失,可以由式(1)计算出该镁空气电池在一定电流密度下的阳极利用率:
(1)
其中:W为理论质量损失,g;W0为实际质量损失,g。W由式(2)[12]计算:
(2)
其中:t为电池测试时间,s;I为测试的电流密度,A·cm-2;F为法拉第常数,96 485 C/mol;fi、ai和ni分别为第i种合金元素的质量分数,原子质量和化合价。
2 试验结果与分析
2.1 微观组织
对3种镁合金进行研磨、抛光,然后进行XRD检测,测得图谱如图1所示。由图1可以看出:3种合金主要由α-Mg基体和β-Mg17Al12相组成,而APZ651-0.5Sb合金中存在Mg3Sb2相。根据Mg-Sb二元相图及文献[13]可知:Sb在Mg中固溶度极小,550 ℃时质量分数小于0.04%,500 ℃时质量分数小于0.02%。另外,所有图谱中均没有发现含Zn和Pb的相。这是由于Pb在镁基体中的固溶度很大(195 ℃时质量分数约为45%)[14],没有与其他元素形成金属化合物。Zn在镁基体中的最大固溶度为6.2%,因此试验合金中1%的Zn也固溶于镁合金中[15]。
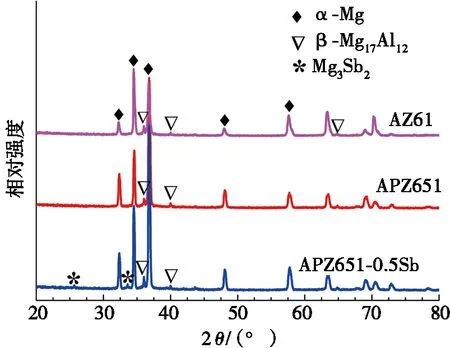
图1 镁合金的XRD图谱
镁合金的背散射图如图2所示。由图2a可观察到AZ61合金中的β-Mg17Al12相主要呈网状,少数岛状沿晶界分布。图2b中APZ651合金中的β-Mg17Al12相主要是沿晶界分布的不连续岛状,晶粒尺寸明显减小。β-Mg17Al12相由粗大的网状变成岛状,这是由于Pb会阻碍Mg和Al原子的扩散,使β相的持续生成受到限制[16],导致合金的耐蚀性降低,活性提高。图2c为APZ651-0.5Sb合金的背散射图。由图2c可以看出:添加Sb元素后,合金中的β-Mg17Al12相变得更加细小。而且相比于AZ61,添加Pb和Sb元素后,合金枝晶也明显变得细小、弥散。由图2c可知:晶界附近除了β-Mg17Al12相外,还存在一些白色短棒状颗粒相。
对图2b和图2c中的1、2和3号点所在位置进行能谱分析,结果如表1所示。晶界附近的白色物质为富Al的α-Mg固溶体(1号点),这种相的存在可能会影响镁合金的耐蚀性。图2b中被白色区域包围的灰色相主要为β-Mg17Al12和部分α-Mg相(2号点)。结合图1的XRD图谱和图2c中3号点能谱分析,可以推测APZ651-0.5Sb合金晶界处的白色短棒状颗粒为Mg3Sb2相。另外,合金中的Mg、Al、Pb、Zn、Sb元素的电负性常数分别为1.31、1.61、2.33、1.65和2.05,在这4种元素中,Mg与Sb之间的电负性差值最大,因此最有可能形成Mg-Sb金属间化合物。而且Mg3Sb2熔点较高(tm= 1 228 ℃),铸造合金时凝固更快,其结晶析出后可以阻碍合金中的枝晶组织长大,这进一步促使沿晶界析出的β-Mg17Al12相变得细小,弥散分布,有利于合金表面的腐蚀变得更均匀。

(a) AZ61

表1 镁合金的能谱分析 %
2.2 动电位极化曲线
在质量分数3.5%的NaCl溶液中,测试了3种合金的动电位极化(Tafel)曲线,结果如图3所示。Tafel曲线由阴极支和阳极支两部分组成,阳极支主要与镁阳极的溶解有关,阴极支主要与镁阳极表面的析氢还原反应有关。根据Tafel外推法[17],对极化曲线阴极支进行拟合,数据见表2。忽略Tafel曲线的阳极支是因为阳极的腐蚀行为较为复杂,而且阳极支Tafel曲线在强极化时受浓差极化控制,阴极支仅受活化控制,且在较宽的电压范围内具有线性关系较好的Tafel区域。由表2可以看出:腐蚀电流密度Icorr从小到大的合金依次为APZ651-0.5Sb、APZ651和AZ61,说明高析氢过电位的Pb和Sb元素抑制了极化过程中镁合金表面的析氢反应。而且APZ651-0.5Sb合金的腐蚀电位Ecorr最负(-1.513 V),极化电阻最小(91.1 Ω·cm2)。说明0.5%Sb提高了镁合金活性,当APZ651-0.5Sb合金作为阳极材料时,在相同的电流密度条件下可能具有更高的放电电压[18]。

图3 镁合金在 3.5% NaCl 溶液中的Tafel曲线

表2 镁合金在 3.5% NaCl 溶液中的Tafel曲线拟合数据
2.3 电池性能
图4为3种合金作为电池阳极在3.5%NaCl溶液中的恒流放电曲线,电流密度分别为5 mA·cm-2(见图4a)、10 mA·cm-2(见图4b)和15 mA·cm-2(见图4c)。表3为不同电流密度下镁合金阳极的恒流放电参数。由表3可知:与AZ61合金相比,APZ651和APZ651-0.5Sb合金的平均放电电压明显提高,而且APZ651-0.5Sb阳极的放电曲线比APZ651更加平稳。当合金中的β-Mg17Al12相数量较多或分布连续时,可以和腐蚀产物一起形成壁垒,阻碍腐蚀行为,降低阳极活性。Sb元素的添加导致镁合金阳极晶粒细化,β-Mg17Al12相弥散分布,使阳极更容易发生连续稳定的放电行为。另外,由表3可知:Pb和Sb元素没有提升镁合金的阳极利用率。可能是因为第二相粒子周围的镁基体被放电消耗后,细小的第二相粒子及少量镁颗粒更容易快速脱落[19]。电流密度为15 mA·cm-2时,APZ651和APZ651-0.5Sb的放电曲线并不十分平稳,这是因为电流密度较大时,大量的放电产物快速在阳极表面堆积,使电解液不能与阳极有效接触,导致电压下降,随后累积的放电产物自然脱落,使阳极暴露在电解液中,电荷传递恢复顺畅,放电电压上升,故而导致放电曲线出现起伏。APZ651-0.5Sb阳极的电压在放电时间约220 min时迅速提升(见图4c),APZ651阳极的放电电压在约240 min时开始上升,表明放电时APZ651-0.5Sb阳极的放电产物可以更快脱落。

(a) 5 mA·cm-2
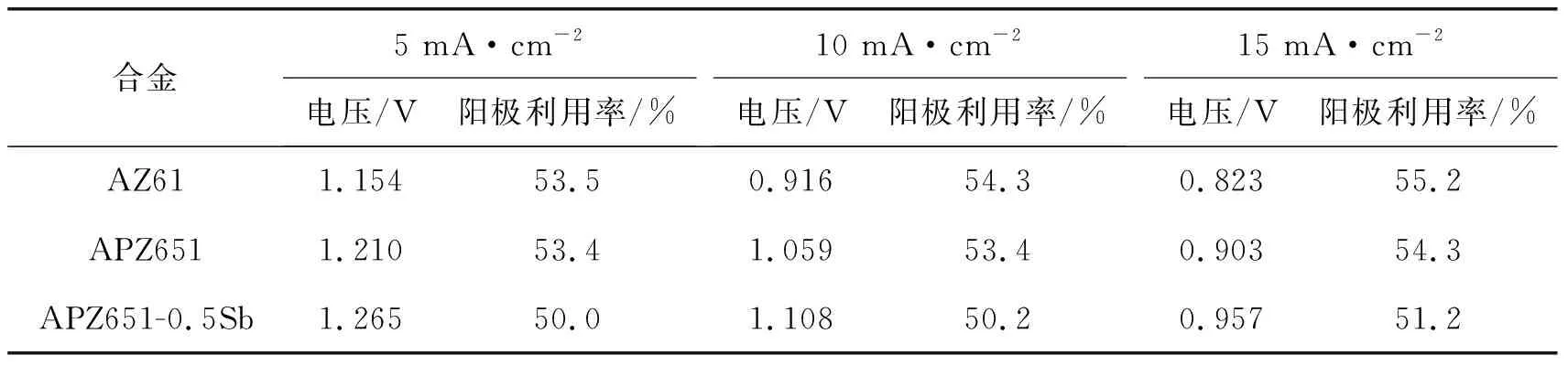
表3 不同电流密度下镁合金阳极的恒流放电参数
图5为3种镁合金在3.5% NaCl溶液中电流密度为10 mA·cm-2时放电后的形貌。AZ61合金(见图5a)表面仍然存在少量抛光产生的划痕,说明AZ61合金的耐蚀性较好。因为该合金中的β-Mg17Al12相粗大且分布连续,可以减缓腐蚀行为的持续发生。APZ651阳极(见图5b)表面有较多密实的腐蚀产物,这些腐蚀产物可以减少电解液中Cl-与阳极的接触,使APZ651合金表现出较好的耐蚀性,但会影响放电反应的持续进行,降低APZ651阳极的放电电压。APZ651-0.5Sb阳极(见图5c)表面也有较多腐蚀产物,表明APZ651-0.5Sb合金活性高,而且腐蚀产物中有很多裂纹,这可以保证合金在放电过程中能够与电解液持续接触,使放电行为顺利进行,放电电压更稳定[20]。

(a) AZ61
2.4 电化学阻抗谱
3种镁合金在3.5% NaCl溶液中的电化学阻抗谱如图6所示。所有合金都在高频和中频出现两个电容环,在中频和低频出现两个电感环。容抗弧分别归功于发生了Mg→Mg2+反应和Mg2+→Mg(OH)2反应[21],感抗弧归功于合金表面的局部腐蚀或氧化膜、腐蚀产物的局部破裂、脱落[22]。使用ZSimpwin软件模拟3种镁合金的电化学阻抗谱的等效电路,结果如图7所示。

图6 不同镁合金的电化学阻抗谱图

图7 EIS的等效电路图
表4为根据等效电路得到的拟合数据。Chsq为弥散常数,其值越小,表示拟合效果越好。表4中Chsq均接近10-4,表明拟合效果较好。Rs为溶液电阻,由于测试使用的溶液都是3.5% NaCl溶液,因此Rs没有明显变化。高频容抗弧(Mg→Mg2+)的等效元件是由电荷传递电阻Rt及双电层界面电容CPE1组成。电荷传递过程是该反应的控制步骤,Rt越大,阻抗谱的半径越大[23]。在3.5%NaCl溶液中Rt从大到小的镁合金依次为AZ61、APZ651和APZ651-0.5Sb(见图6和表4)。Rt的大小反映电极的活性,一般来说电荷转移电阻较小的镁合金有较强的活性,在电解液中将更容易发生活化溶解。由此可知,Pb和Sb都提高了镁合金的活性,APZ651-0.5Sb的活性最高。L为电感,RL1和RL2为电感回路的反应电阻,它们与没有氧化膜或腐蚀产物覆盖的阳极表面的离子交换有关。L表示腐蚀产物脱落的能力[24]。电感L2越大,说明腐蚀产物未覆盖的区域越多,即腐蚀产物越容易脱落。由表4可知:APZ651-0.5Sb合金的L2值更大,说明0.5%Sb可以促进合金表面的腐蚀产物脱落。

表4 不同镁合金的等效电路图拟合数据
3 结论
(1)3种镁合金主要由α-Mg基体和β-Mg17Al12相组成。APZ651-0.5Sb合金中存在棒状Mg3Sb2相。Sb的加入使合金晶粒尺寸明显减小,沿晶界分布的β-Mg17Al12相由粗大的连续网状变成不连续岛状,且趋向于弥散分布。
(2)APZ651-0.5Sb合金的腐蚀电流密度Icorr最小,腐蚀电位Ecorr最负,电荷传递电阻Rt最小,说明Sb抑制了镁合金表面的析氢反应,提高了合金活性。
(3)APZ651-0.5Sb合金的平均放电电压明显更高,放电产物更容易脱落且有很多裂纹,使放电反应能持续稳定进行。

