基于网络药理学和分子对接探讨肉苁蓉苯乙醇总苷对肝细胞癌的潜在分子机制
张嘉伟 文丽梅 胡君萍 杨建华
(1 新疆医科大学药学院,乌鲁木齐,830054;2 新疆医科大学第一附属医院药学部,乌鲁木齐,830011)
原发性肝癌是全球高发病率和致死率的恶性肿瘤之一,5年内的生存率仅为7%[1]。肝细胞癌(Hepatocellular Carcinoma,HCC)是其中最主要的病理类型,占85%以上[2]。最新数据表明,我国HCC的病死率和发病率分别排在所有恶性肿瘤的第3位和第4位,具有发展较快、易复发的特点[3-4]。肝癌的病因和发病机制尚不清楚,其发生可能与宿主基因多态性、环境因素(包括代谢综合征和黄曲霉毒素B1)、饮酒和病毒因素(包括乙型肝炎病毒和丙型肝炎病毒感染)的相互作用有关[5]。中药可用于晚期HCC患者,具有抗肿瘤、减少放疗化疗的不良反应、提高肿瘤患者免疫力、改善生命质量等作用[6]。
肉苁蓉为列当科植物肉苁蓉CistanchedeserticolaY.C.Ma或管花肉苁蓉Cistanchetubulosa(Schenk)Wight的干燥带鳞叶的肉质茎[7],具有补肾、益精、润燥、通便的功效,是我国西北干旱地区特有的名贵补益类药材,应用历史悠久。肉苁蓉始载于东汉《神农本草经》:“味甘、微温。主五劳七伤,补中,除茎中寒热痛,养五脏,强阴,益精气,多子,妇人癥瘕,久服轻身”,被列为上品[8]。肉苁蓉苯乙醇总苷(Phenylethanoid Glycosides from Cistanche,CPhGs)作为肉苁蓉中的主要有效成分,包括毛蕊花糖苷、松果菊苷、红景天苷、2′-乙酰基毛蕊花糖苷、管花苷B等[9],具有肝脏保护、抗痴呆、抗疲劳、缺血保护、抗骨质疏松、润肠通便、免疫调节、抗衰老及改善生殖等作用[10]。已有研究证明,CPhGs具有良好的防治肝癌作用。Yuan等[11]的研究表明CPhGs通过外源性和内源性凋亡途径抑制H22细胞的生长。胡琼等[12]发现CPhGs能够抑制肝癌细胞的生长,这可能与CPhGs降低荷瘤小鼠血清中AFP的含量,提高荷瘤小鼠的免疫力有关。目前,尚未发现针对CPhGs防治HCC作用及其分子作用机制的深入研究,其活性成分、作用靶点及分子机制尚未完全阐明。
网络药理学将现有的“一靶一药”方式更新为“网络靶点-多成分”的研究方式,即在此基础上对中药的疗效进行综合分析,从系统视角和分子水平探索中医药,构建中医药网络药理学新思路[13-14]。本研究通过网络药理学策略,基于中医药整体观,对CPhGs防治HCC的作用机制进行系统探讨,结合“中药-活性成分-靶点-信号通路”的多层次网络模式,预测CPhGs防治HCC作用的关键靶点及作用机制,并利用分子对接技术进行验证,阐述CPhGs多成分、多靶点、多通路的协同作用机制,为显著提升CPhGs的药用资源开发领域,为后续研究提供参考。
1 资料与方法
1.1 CPhGs类成分的收集 通过检索中药系统药理学数据库与分析平台(Traditional Chinese Medicine Systems Pharmacology Database and Analysis Platform,TCMSP)、中医药百科全书数据库(Encyclopaedia of Traditional Chinese Medicine,ETCM)、中医药综合数据库(Traditional Chinese Medicine Integrated Database,TCMID)等数据库并结合国家知识基础设施数据库(China National Knowledge Infrastructure,CNKI)、PubMed数据库中的相关文献,收集CPhGs类的化学成分及靶点信息。通过在TCMSP、ETCM、TCMID数据库及文献内检索,最终确定29个化合物作为候选化合物[15-16]。
1.2 药物潜在治疗靶点的预测及“中药-活性成分-靶标”网络图的构建 将检索得到成分的SDF格式文件导入PharmMapper数据库,进行潜在靶点的预测分析,并采用UniProt KB搜索功能对靶点名称进行校正。运用Cytoscape 3.8.0软件构建“中药-活性成分-靶点”网络图。
1.3 HCC相关基因的筛选 将“Hepatocellular Carcinoma”“HCC”作为关键词在以下4个数据库中进行检索,获得HCC靶点的信息:1)OMIM数据库;2)DrugBank数据库;3)GeneCards数据库;4)治疗靶点数据库(Therapeutic Target Database,TTD,http://db.idrblab.net/ttd)。筛选后将靶点信息进行汇总整理。
1.4 CPhGs治疗HCC的靶点映射 通过在线绘图软件制作韦恩图,将CPhGs类成分作用靶点与HCC靶标进行映射,交集靶点即为CPhGs类成分治疗HCC潜在作用靶点,通过韦恩图确定CPhGs类成分与HCC的药物-疾病交集靶点。
1.5 蛋白质-蛋白质相互作用(Protein-protein Interaction,PPI)网络的构建 利用STRING数据库(https://string-db.org/)进行共有靶点的PPI分析,设置Combined Score>0.4,并将结果利用Cytoscape 3.8.0进行拓扑分析,以度值大于中位数的2倍筛选出关键共有靶点。
1.6 基因本体(Gene Ontology,GO)富集分析和京都基因和基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)富集分析 利用DAVID数据库对CPhGs和HCC共同作用靶点蛋白进行GO分析和KEGG通路富集分析,设定阈值P≤0.05,筛选出具有显著性差异的生物过程和通路,并通过Cytoscape 3.8.0软件构建“中药-活性成分-靶点-通路”网络。
1.7 核心靶点的分子对接验证 选择关键靶点蛋白用于分子对接,从RCSBPDB数据库获取这些靶点蛋白的晶体结构文件,从PubChem数据库获取这些靶点的活性成分的结构文件,利用Autodock_vina软件计算靶点蛋白与活性成分间的最低结合能并将分子对接模拟验证结果进行可视化。
2 结果
2.1 肉苁蓉苯乙醇总苷的活性成分及其预测靶点 最终确定29个化合物作为候选化合物,包括Echinacoside、Acteoside、Isoacteoside、2′-Acetylacteoside、Tubuloside A等基本信息。见表1。通过数据库及PharmMapper预测出成分的靶标并去重后,获得410个可能的靶标。
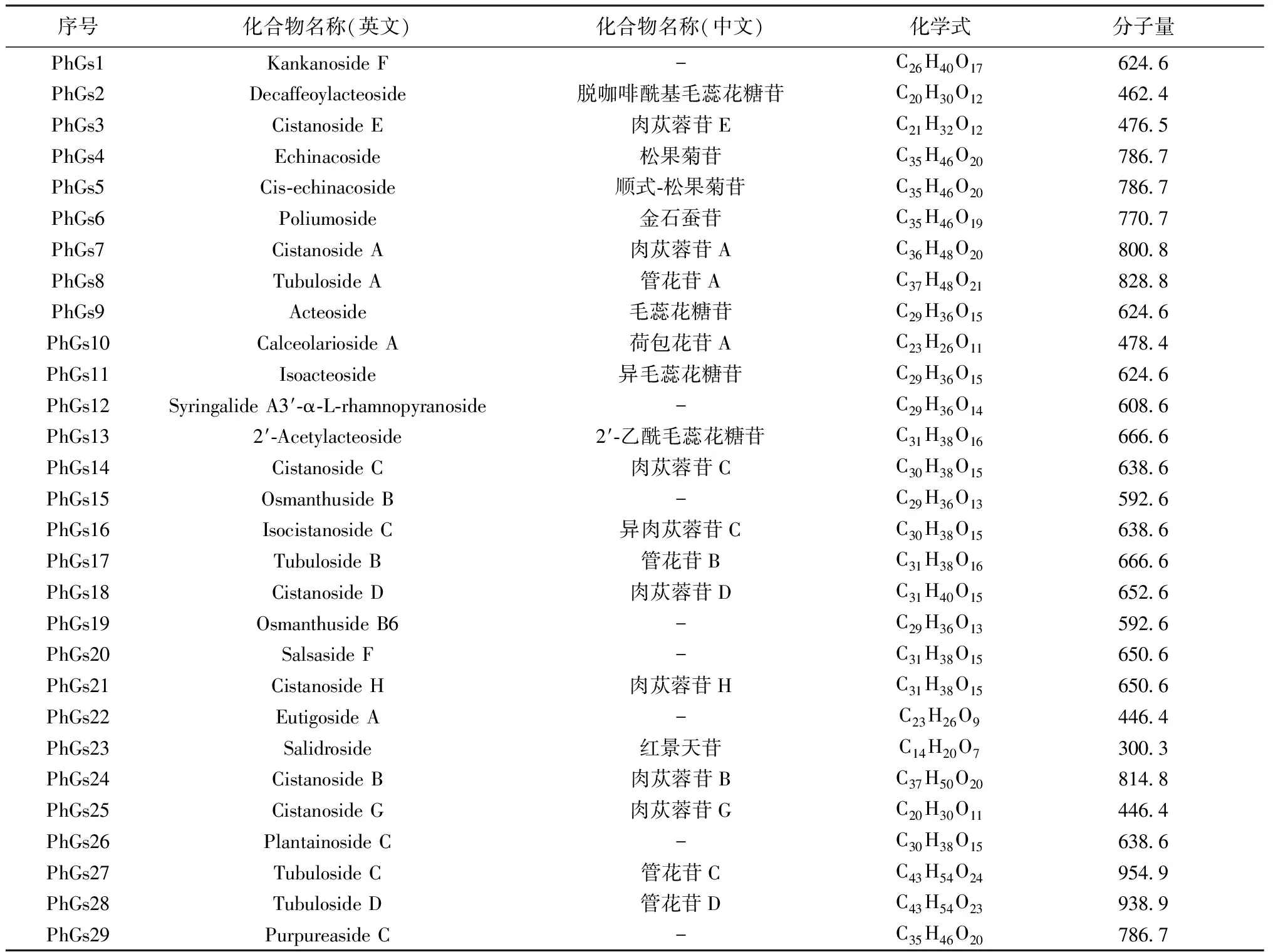
表1 肉苁蓉苯乙醇苷类成分基本信息
2.2 “中药-活性成分-靶标”网络构建与分析 “中药-活性成分-靶标”网络涉及439个节点,7 515条边。图中白色节点为中药;图中黄色节点中的缩写为成分名称,如PhGs9为Acteoside,其余略;图中蓝色节点为靶标名称,如CASP3为Caspase-3蛋白。见图1。

图1 CPhGs类成分“中药-活性成分-靶标”网络
2.3 HCC疾病靶点的获取及CPhGs类成分靶点映射 共获得HCC相关靶点1 944个。通过韦恩图将CPhGs成分预测的靶点与HCC的靶点进行映射,发现共有173个交集靶点,即CPhGs治疗HCC的作用靶点。见图2。
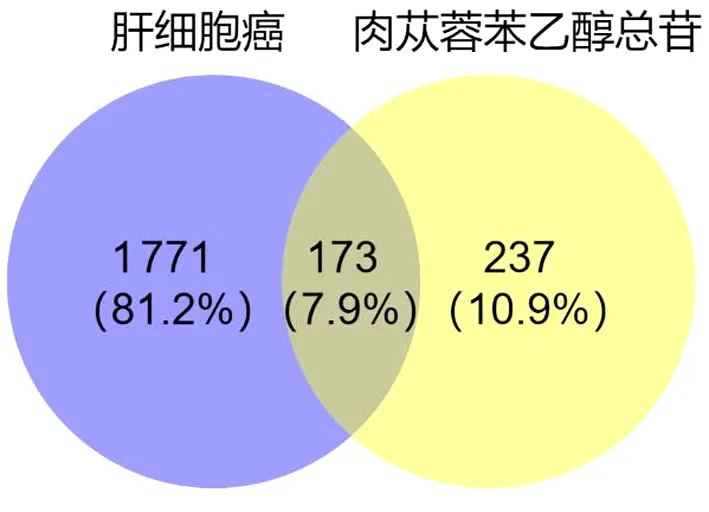
图2 CPhGs-HCC共同靶点数
2.4 PPI网络构建及分析 CPhGs治疗HCC的靶点蛋白PPI网络涉及173个节点,2 202条边。见图3。度值中位数为20,根据度值大于中位数2倍筛选出核心网络蛋白29个,包括ALB、AKT1、EGFR、MAPK1、IGF1、SRC、CASP3、MMP9、HRAS、HSP90AA1、MAPK8、ESR1、MMP2、RHOA、MAPK14、ANXA5、CAT、MDM2、KDR、PIK3R1、CDC42、MAP2K1、STAT1、GRB2、AR、IL-2、NOS3、IGF1R、JAK2。以上靶点在PPI网络中的位置,表明其在CPhGs治疗HCC中可能发挥重要作用。见图4。

图3 CPhGs治疗HCC潜在作用靶点之间的相互作用网络
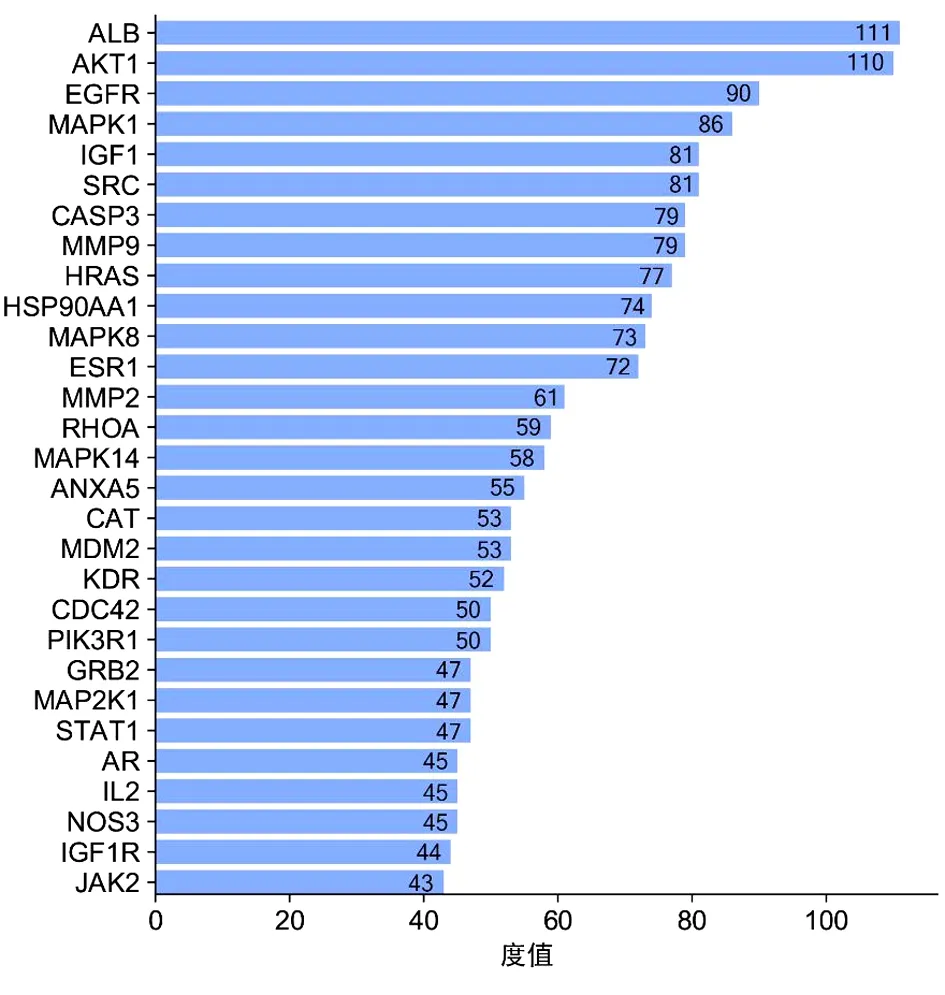
图4 PPI核心基因柱状图
2.5 GO分类富集分析和KEGG通路富集分析 将筛选出的29个关键靶点进行GO和KEGG富集分析,得到生物过程(Biological Process,BP)65条,主要包括蛋白质磷酸化,细胞增殖、迁移、凋亡,肾上腺素信号通路等;细胞组分(Cellular Components,CC)18条,主要与细胞质,细胞间连接,细胞内外基质等有关;分子功能(Molecular Function,MF)23条,主要与蛋白激酶活性、蛋白质结合、酶结合等有关。见图5。以上数据P值均小于0.05。通过KEGG富集得到92条信号通路(P<0.05),主要涵盖癌症信号通路(hsa05200:Pathways in Cancer)、癌症蛋白聚糖通路(hsa05205:Proteoglycans in Cancer)、PI3K-AKT信号通路(hsa04151:PI3K-AKT Signaling Pathway)、RAS信号通路(hsa04014:Ras Signaling Pathway)、FoxO信号通路(hsa04068:FoxO Signaling Pathway)、血管内皮生长因子信号通路(hsa04370:VEGF Signaling Pathway)等,排名前20的通路。见图6。

图5 CPhGs潜在靶标的GO富集分析

图6 CPhGs潜在靶标的KEGG通路富集分析
2.6 “中药-活性成分-靶点-信号通路”网络构建 CPhGs治疗HCC的“中药-活性成分-靶点-通路”网络共有79个节点和901条边,涉及29种活性成分、29个关键靶点、20条KEGG通路,体现了CPhGs可能通过多成分、多靶点、多途径发挥多效应的特点。见图7。
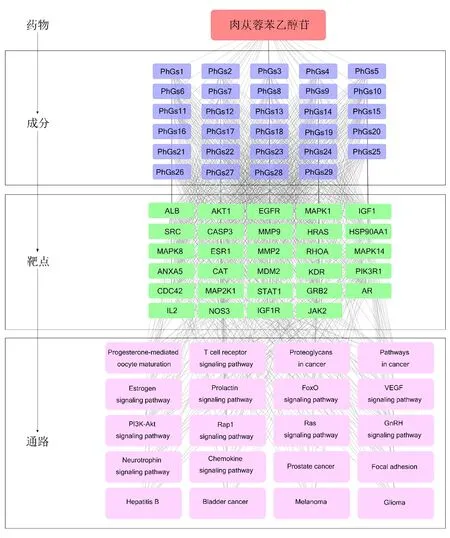
图7 CPhGs成分治疗HCC的“中药-活性成分-靶点-信号通路”网络图
2.7 分子对接验证 根据“中药-活性成分-靶点”网络中靶点的度值选择CPhGs活性成分5个(毛蕊花糖苷、松果菊苷、2-乙酰毛蕊花糖苷、肉苁蓉苷A、管花苷A)与PPI分析中度值排名前10的靶点蛋白(ALB、AKT1、EGFR、MAPK1、IGF1、SRC、CASP3、MMP9、HRAS、HSP90AA1)进行分子对接,筛选对接结果中结合能低的分子构象即为最优对接结果,其中活性成分与蛋白间的结合能等信息。见表2。具体对接过程见图8。结果显示,50个对接结果均有较优的(Total Score≤-5.0)对接活性,其中,43个对接结果有强烈的匹配活性(Total Score≤-7.0)。以上对接结果充分表明,CPhGs活性组分与HCC关键核心靶基因的结合作用良好。
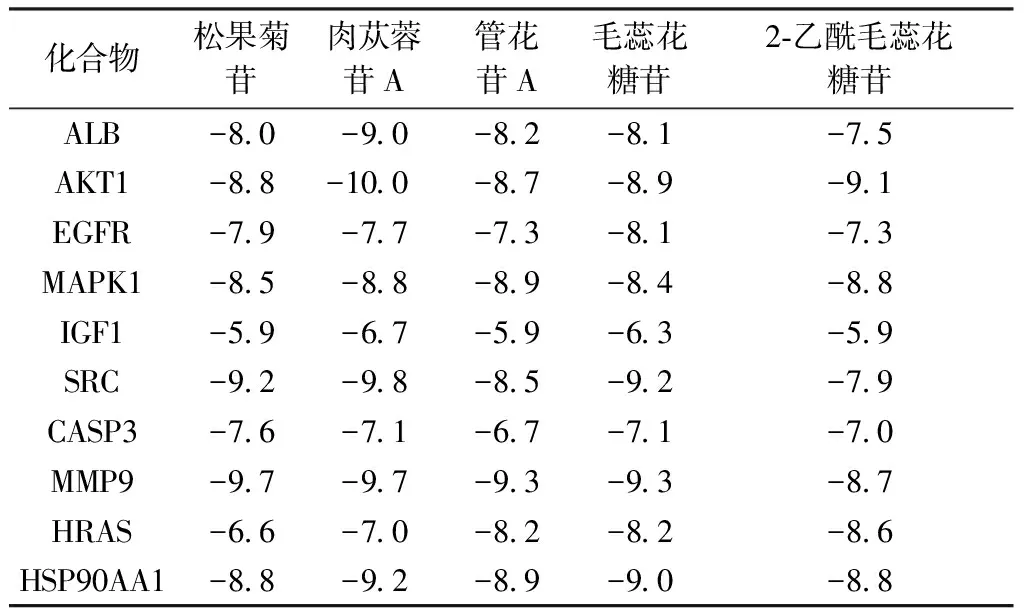
表2 活性成分与靶点蛋白结合能(kcal/mol,1 cal=4.184 J)
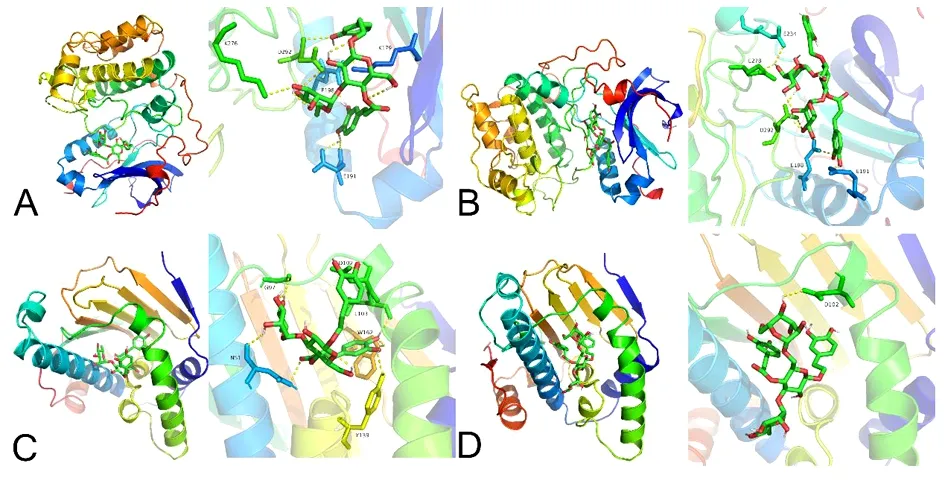
图8 靶点受体蛋白与活性成分的分子对接模式
3 讨论
HCC是严重威胁人类健康的十大恶性肿瘤之一,具有发病隐匿,进展迅速,治疗困难、转移概率高的特点[17]。HCC是各种信号通路及细胞因子共同参与的病理生理过程,因此单靶点、单通路治疗很难起效。中药具有多成分、多作用靶点和作用途径复杂等特点,并以“人”为核心,将整体与局部相关联,通过中药有效成分在体内的代谢过程,进而从系统上实现药物对机体的调控。
通过“中药-活性成分-靶点”的网络结果显示,CPhGs类成分毛蕊花糖苷、松果菊苷、红景天等均具有较高的防治肝癌活性,在治疗过程中可能发挥重要作用。毛蕊花糖苷对环境、饮食及二乙基亚硝胺诱导的大鼠肝癌具有预防作用,其发挥作用可能是由信号转导及转录激活因子(Signal Transduction and Activator of Transcription,STAT)3依赖性的氧化应激和凋亡调控介导的[18]。另外,毛蕊花糖苷可通过干扰JNK信号通路的激活和调控自噬蛋白的表达来抑制肝癌细胞的增殖[19]。研究表明,松果菊苷(ECH)能抑制二乙基亚硝胺诱导的小鼠肝癌,并对HepG2肝癌细胞株具有抗增殖和促凋亡作用,其作用机制可能是通过降低骨髓细胞触发受体2(Triggering Receptors Expressed on Myeloid Cells 2,TREM2)的表达和PI3K/AKT信号通路发挥其抗肿瘤活性[20]。红景天苷联合奥沙利铂给药可以提高HCC患者的化疗疗效,通过抑制HIF-1α信号通路,显著提高HCC患者对铂类药物的敏感性,抑制缺氧诱导的上皮-间充质转化(Epithelial Mesenchymal Transformation,EMT)[21]。
综上所述,目前针对CPhGs类成分防治HCC的作用机制研究较少,尚未见有关CPhGs防治HCC作用机制的报道。基于此,本课题应用网络药理学及分子对接技术对CPhGs防治HCC的作用机制进行系统研究,丰富和完善中药、天然药物治疗HCC的研究资料,拓展新疆地产药材肉苁蓉的开发应用价值。
本研究的PPI网络拓扑学分析显示,CPhGs治疗HCC的核心靶点有29个,其中包括AKT1,PIK3R1,STAT1,SRC,MAPK1,CASP3,MAPK8,MAPK14,IGF1R等,均涉及细胞凋亡和细胞增殖过程。采用DAVID数据库对上述29个关键靶点进行GO功能和KEGG富集分析。GO功能富集分析结果显示CPhGs可以对细胞信号转导、细胞迁移、细胞增殖、细胞免疫等生物过程起调控作用,涉及细胞膜、核、质、细胞器膜及细胞空间等细胞组成过程,并通过与蛋白、酶各类受体结合等分子功能产生活性。KEGG功能富集分析结果显示,CPhGs防治HCC可能是通过调控癌症信号通路、癌症蛋白聚糖通路、PI3K/AKT信号通路、GnRH信号通路等多条信号转导通路,其中均涉及PI3K/AKT信号通路,其作用尤为关键。
PI3K/AKT信号通路在肝癌的起始过程中起着至关重要的作用,涉及多种生物学过程,如增殖、转移、耐药、抗辐射、能量代谢和自噬等[22-23]。磷脂酰肌醇-3-激酶(Phosphatidylinositol-3-kinase,PI3K)是由调节亚单位p85和催化亚单位p110组成的异源性二聚体。根据底物和序列同源性,将PI3K分为3个亚型,都能磷酸化磷脂酰肌醇第3位羟基,从而产生特定的磷酸肌醇形式而发挥作用[24]。蛋白激酶B是位于PI3K下游的靶蛋白,是细胞增殖和存活的重要调节因子。目前,已经鉴定出3种AKT基因,分别称为AKT1、AKT2和AKT3。抑制AKT活性可诱导一系列哺乳动物的细胞凋亡,因此,将蛋白激酶B抑制剂与抗癌药物联合治疗具有突变的肿瘤有一定的疗效[25]。
本研究将“中药-活性成分--靶点”网络中排名前5的核心活性化合物与PPI分析中度值排名前10的蛋白靶点进行分子对接,进一步明确其发挥效用的治疗机制。采用Autodock vina进行对接,选取亲和力最佳的构象,其中最低结合能≤-5.0 kcal/mol即表明药效分子与蛋白对接效果良好,结合能越低,表明分子与蛋白结合能力越佳。本研究结果提示肉苁蓉中的苯乙醇苷类活性化合物与蛋白激酶B1、HSP90AA1等靶标结合后最低结合能均≤-5.0 kcal/mol,表明其具有较强的结合能力,充分验证了网络药理学的预测结果。蛋白激酶B是一种人类丝氨酸-苏氨酸激酶,是AGC蛋白激酶家族的成员[26]。蛋白激酶B在大多数癌症类型中都高度表达,包括HCC、肺癌、乳腺癌和以及结肠癌,其中蛋白激酶B1是治疗癌症的主要药物靶点,在细胞增殖和抗凋亡的过程中发挥作用。有研究表明沉默蛋白激酶B1能够抑制肿瘤生长和诱导细胞凋亡,并可有效上调肿瘤抑制人第10号染色体缺失的磷酸酶及张力蛋白同源基因的表达、减少Notch1的表达,靶向蛋白激酶B1可以抑制HCC的发展[27]。热激蛋白90α(Heat Shock Protein 90α,Hsp90α)由HSP90AA1基因编码,是分子伴侣Hsp90的诱导亚型,是真核生物中高度保守且必不可少的伴侣蛋白[28]。HSP90已成为治疗癌症中的关键目标,Hsp90与多种促进肿瘤发生的蛋白相互作用,因此,Hsp90是一个重要的致癌因子。研究表明,HCC患者血清HSP90AA1水平明显高于健康对照组[29],分泌型HSP90AA1可能是HCC良好的生物标志物,被批准用于中国HCC的临床诊断[30]。
综上所述,本文以CPhGs主要活性成分为研究对象,通过网络药理学技术分析其潜在的防治HCC靶点及信号通路,并结合分子对接方法初步验证了CPhGs主要活性成分能与HCC靶点发生相互作用,为进一步深入探讨其作用机制奠定了基础。

