卷丹百合远缘杂交及杂种后代的鉴定
舒珂,李建红,陈璐,傅海燕,蔡维,刘李晨,李玉帆,4*
卷丹百合远缘杂交及杂种后代的鉴定
舒珂1,2,李建红3,陈璐1,4,傅海燕1,蔡维1,刘李晨1,李玉帆1,2,4*
(1.湖南农业大学园艺学院,湖南 长沙 410128;2.湖南省中亚热带优质花木繁育与利用工程研究中心,湖南 长沙 410128;3.江西省崇义县林业局阳明山省级自然保护区管理站,江西 崇义 341300;4.园艺作物种质创新与新品种选育教育部工程研究中心,湖南 长沙 410128)
为培育抗性强、观赏性优良的卷丹百合新种质,采用液体培养基悬滴法测定3个观赏百合品种‘Black stone’‘Tresor’‘Sorbonne’ 的花粉生活力;用蕾期授粉、正常授粉、延迟授粉、切割柱头授粉方式分别与母本卷丹百合进行杂交,对获得的杂交后代进行胚珠培养及增殖扩繁,采用SSR分子标记的方法鉴定杂种的真实性。结果表明:‘Sorbonne’的花粉萌发率总体高于‘Black stone’和‘Tresor’;蕾期授粉的结实率最高,为14.44%;卷丹בBlack stone’ 组合获得蒴果数量最多,共得到了17个蒴果;对杂交蒴果进行胚珠培养,得到9株F1代杂种苗;筛选杂种苗增殖扩繁的较适培养基为MS+30 g/L蔗糖+0. 1 mg/L NAA+1 mg/L 6–BA+8 g/L琼脂;鳞茎膨大生根较适培养基为MS+80 g/L蔗糖+0.1 mg/L NAA+ 0. 05 mg/L 6–BA+0.75 g/L活性炭+6.5 g/L琼脂,最适培养环境为黑暗培养;通过4对引物鉴定证实卷丹בTresor’的2个杂种株系为真实杂种。
卷丹百合;远缘杂交;胚珠培养;增殖培养;微卫星分子标记
卷丹百合(Thunb.)别名虎皮百合、宜兴百合、天盖百合,广泛分布于江苏、浙江、安徽、江西、湖南、湖北等地[1],兼具药用、食用和观赏多种功能[2],具有较高的开发价值。
卷丹百合作为一种原生百合,对土传病害枯萎病的抗性极弱,从而造成严重的连作障碍,面临品种退化、品质下降等问题[3]。而大部分观赏百合栽培品种尤其是亚洲百合杂种系品种的抗性都较强,对尖孢镰刀菌引起的枯萎病的抗性极强[4]。百合种间的远缘杂交有受精前障碍和受精后胚的发育不良等障碍[5]。克服受精前障碍主要采用切割柱头、花粉蒙导、化学处理、柱头嫁接等方法;受精后障碍主要通过胚拯救来克服。罗建让等[6]、樊金平等[7]以卷丹百合为亲本,与野百合、宜昌百合和东北百合进行杂交育种,未能获得有胚种子;雷家军等[8]以野生百合及亚洲百合为父本,采用5种授粉方法与卷丹百合杂交,筛选卷丹百合杂交种后代胚珠培养的最佳培养基配方,获得卷丹杂交后代,但并没有进行杂种后代的培育及鉴定。笔者采用蕾期授粉、正常授粉、延迟授粉、切割柱头授粉等4种授粉方法,将食用卷丹百合与‘Black stone’ ‘Tresor’ ‘Sorbonne’这3种抗性强、观赏性状优良的亚洲百合杂种系及东方百合杂种系品种进行杂交,筛选适于克服卷丹百合远缘杂交障碍的方法,建立杂种后代增殖扩繁培育体系,以期为培育观赏兼食用百合新品种提供支持及材料。
1 材料与方法
1.1 材料
供试百合母本为卷丹百合,父本分别为 ‘Black stone’ ‘Tresor’‘Sorbonne’,如图1所示。供试亲本与杂种后代均种植于湖南农业大学花卉基地。

1 卷丹百合;2 ‘Black stone’;3 ‘Tresor’;4 ‘Sorbonne’。
1.2 方法
1.2.1百合父本花粉生活力测定及杂交授粉方式的选择
采用三因素三水平正交试验设计,配制了9组百合花粉萌发液体培养基[9],其配方列于表1,运用液体培养基悬滴法检测百合父本花粉的萌发情况,计算花粉萌发率。
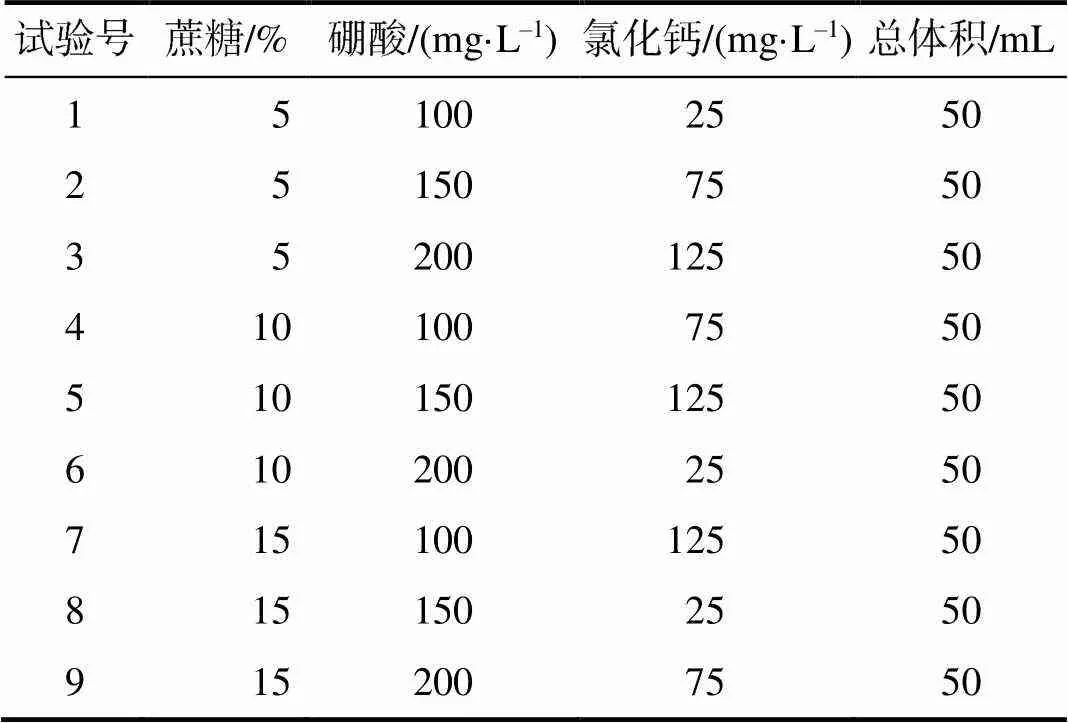
表1 百合花粉萌发液体培养基配方
采用蕾期授粉(开花前2~3 d,花蕾显色期)、正常授粉(开花1~2 d)、延迟授粉(开花后4~5 d,花瓣萎蔫状态)和切割柱头授粉(开花1~2 d)4种方式,每个组合、每种处理各杂交30朵。为避免自交的影响,对蕾期百合花朵去雄后套袋,杂交前取袋,授粉完成后再次套袋。
1.2.2百合杂种苗增殖与膨大生根培养基的筛选
授粉2个月后,摘取成熟膨大蒴果洗净,依次用75%乙醇和 2%次氯酸钠消毒,取胚珠,置于培养基上培养。胚珠培养基为MS+30 g/L蔗糖+0.01 mg/L NAA+6.5 g/L琼脂,pH 5.7。以培养基MS+30 g/L蔗糖+1 mg/L 6–BA+8 g/L琼脂,pH 5.8为基础,分别添加0.01、0.10、0.50 mg/L的NAA,培养卷丹בTresor’杂种苗的外层鳞片。每个处理接种10瓶,每瓶接种5个小鳞茎,重复3次。每周观察统计出芽情况,为期90 d。
将增殖的百合不定芽接种到鳞茎膨大生根培养基进行培养,以不同质量浓度的6–BA和是否加活性炭筛选较适培养基。每种培养基配方接种10瓶,每瓶接种4个百合不定芽,30 d后统计观察小鳞茎的直径及生根情况。
配方1:MS+80 g/L蔗糖+0.1 mg/L NAA+ 0. 05 mg/L 6–BA+0.75 g/L活性炭+6.5 g/L琼脂,pH=5.8。
配方2:MS+80 g/L蔗糖+0.1 mg/L NAA +0. 1 mg/L 6–BA +0.75 g/L活性炭+6.5 g/L琼脂,pH=5.8。
配方3:MS+80 g/L蔗糖+0.1 mg/L NAA +0. 2 mg/L 6–BA +0.75 g/L活性炭+6.5 g/L琼脂,pH=5.8。
配方4:MS+80 g/L蔗糖+0.1 mg/L NAA + 0. 2 mg/L 6–BA +6.5 g/L琼脂,pH=5.8。
将杂种苗置于较适鳞茎膨大生根培养基,分别置于光照和黑暗环境培养,40 d后观察杂种苗鳞茎膨大生根情况。
1.2.3百合杂种苗的鉴定
取卷丹בTresor’的2个杂种株系、卷丹和‘Tresor’的幼嫩无病虫害的新鲜叶片提取DNA(北京聚合美生物科技有限公司M5 Hiper Plus多糖多酚植物基因组DNA提取试剂盒),采用紫外分光光度计测定DNA浓度,用1%琼脂糖凝胶电泳检测DNA的质量,凝胶成像分析系统检测电泳条带。利用前期开发的23对百合SSR引物对亲本进行多态性分析,筛选出扩增条带清晰不拖带、多态性较好的引物。
采用25 μL反应体系:DNA模板(50 ng/μL)1 μL,2×RapidMaster Mix 12.5 μL,上、下游引物(10 μmol/L)各1 μL,无菌水9.5 μL。PCR扩增程序:95 ℃预变性3 min;95 ℃变性15 s,56~63 ℃退火15 s,72 ℃延伸15 s,35个循环;最后72 ℃延伸5 min。4 ℃保存。
将初步筛选获得的SSR引物序列的5端添加荧光标记,合成荧光引物,以亲本与子代的基因组DNA为模板,进行PCR扩增与毛细管电泳检测。
2 结果与分析
2.1 百合父本花粉的生活力和较优授粉方式
3个百合父本花粉的萌发情况如图2所示。由表2可知,3个百合父本的花粉均有一定的生活力,其中‘Sorbonne’的萌发率总体稍高于‘Black stone’和‘Tresor’。3个父本花粉在150 g/L蔗糖+100 mg/L硼酸+125 mg/L氯化钙萌发液中的萌发率最大,‘Sorbonne’的萌发率显著高于‘Black stone’ ‘Tresor’,‘Tresor’的萌发率显著低于‘Black stone’。3个父本的花粉在9种萌发液中均可萌发,说明父本花粉的适应性较好。
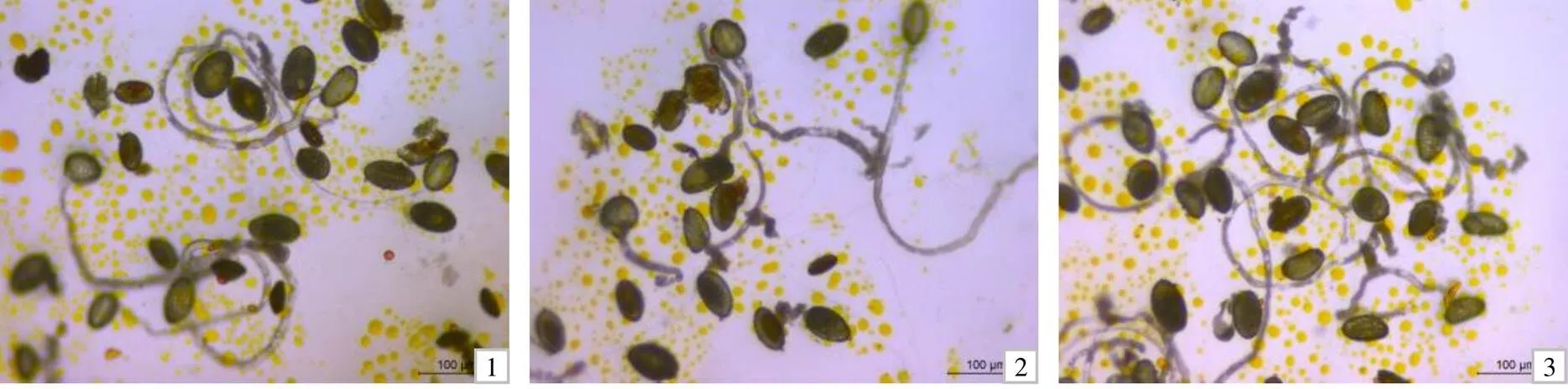
1 ‘Black stone’花粉;2 ‘Tresor’花粉;3 ‘Sorbonne’花粉。

表2 百合父本花粉的萌发率
同列不同字母表示处理间的差异有统计学意义(<0.05)。
3种杂交组合的结实率差异较大,其中卷丹בBlack stone’结实率最高,共授粉120朵,获得17个蒴果,结实率高达14.167%;卷丹בTresor’,获得7个蒴果,结实率为5.833%;卷丹בSorbonne’仅获得1个蒴果,结实率最低,为0.833%。由此可见,卷丹百合和亚洲百合(‘Black stone’)的亲缘关系较近,较易获得杂交果实。
在4种授粉方式中,蕾期授粉所得蒴果数量最多,共授粉90朵,获得了13个杂交蒴果,结实率达到了14.44%;其次为正常授粉,获得了11个杂交蒴果,结实率为12.20%;切割柱头授粉仅获得1个杂交蒴果,结实率为1.11%;延迟授粉没有获得果实。综上可知,蕾期授粉是克服卷丹远缘杂交受精前障碍的较优授粉方式。
2.2 杂种苗的增殖和膨大生根较适培养基
胚珠培养30 d后有出芽现象。其中卷丹בBlack stone’获得杂种苗1株,卷丹בTresor’获得杂种苗8株,卷丹בSorbonne’没有获得杂种后代。
杂种苗小鳞片接入增殖培养基14 d后,鳞片基部开始膨大;在21 d左右鳞片基部开始生长出不定芽,部分接种的小鳞片也可分生出新的小籽球;60 d后,NAA处理杂种苗后代的鳞片生长分化稳定(图3)。对分化出的不定芽和小籽球的数量进行统计分析,结果,0.10 mg/L NAA处理的平均增殖系数最高,为6.42;0.01 mg/L NAA和0.50 mg/L NAA处理的平均增殖系数分别为4.40和3.98,无显著差异,0.10 mg/L NAA处理的平均增殖系数显著高于0.01 mg/L NAA与0.50 mg/L NAA处理的,说明0.10 mg/L NAA处理对百合小鳞片的增殖效果最好。

1 胚珠培养获得的杂种苗;2 0. 01 mg/L NAA处理60 d后鳞片分化情况;3 0.10 mg/L NAA处理60 d后鳞片分化情况;4 0.50 mg/L NAA处理60 d后鳞片分化情况。
将增殖培养后的不定芽接种至鳞茎膨大生根培养基中,在配方1中的52个小鳞茎,得到26个生根小鳞茎,11个膨大鳞茎;在配方2中的55个小鳞茎,得到生根小鳞茎26个,膨大鳞茎7个;在配方3中的17个小鳞茎,得到生根的小鳞茎2个,膨大鳞茎仅1个;在配方4中的22个小鳞茎,仅得到2个生根小鳞茎,没有获得膨大的小鳞茎。结果表明,配方1中的小鳞茎膨大率与生根率最高,与配方2、配方3比较,0.05 mg/L 6–BA对百合小鳞茎膨大生根的效果最好;相比配方3及配方4的效果,说明活性炭可促进百合小鳞茎膨大生根。
由图4可看出,在同种培养基条件下,黑暗培养40 d后的杂种苗鳞茎比光照培养的大,所获1~2 cm大球的数量是光照培养的2倍,而且根系更为发达、粗壮。光照培养的34个小鳞茎中,得到膨大鳞茎8个,生根鳞茎20个;黑暗培养的38个小鳞茎中,得到膨大鳞茎17个,生根鳞茎25个。表明黑暗培养的小鳞茎的生根率和膨大率均高于光照培养的,暗培养环境更适宜百合杂种苗鳞茎的膨大生根。

1、2 光照培养的鳞茎膨大情况;3、4 黑暗培养的鳞茎膨大情况;5、6 光照培养的鳞茎生根情况;7、8 黑暗培养的鳞茎生根情况。
2.3 百合杂交后代的鉴定结果
对母本卷丹、父本‘Tresor’以及卷丹בTresor’2个杂种苗株系JA1、JA2各3株提取DNA,利用超微量核酸蛋白测定仪检测浓度。结果显示,其OD260/OD280值为 1.7~2.0;通过1%琼脂糖凝胶电泳检测其纯度,所提取DNA条带清晰无拖带,无蛋白质和RNA污染。
利用23对SSR引物对父母本进行PCR扩增和2%琼脂糖凝胶电泳检测,筛选出了其中扩增效果较好、条带较清晰、稳定的引物16对。将筛选出的SSR引物的5端添加荧光标记,合成荧光引物,进行PCR扩增与毛细管电泳检测与分析。
采用初步筛选出的16对SSR引物对父母本及杂交后代的PCR扩增产物进行毛细管电泳检测,获得数据在GeneMarker V2.2.0进行判读与分析,得出其中4对引物可以有效鉴定杂交后代的真实性(图5)。由图5可知,JA1的3个子代在引物JDZJ–11中同时扩增出了父母本的特异性片段,可以确定为真实杂种;而JA2的3个子代在引物JDZJ–13中扩增出了父母本的特异性片段,也可以确定JA2的3个子代均为真实杂种。

图5 引物JDZJ–11和JDZJ–13的扩增图谱
3 结论与讨论
将卷丹百合与抗性强、观赏性状优良的亚洲百合杂种系品种‘Black stone’‘Tresor’及东方百合杂种系品种‘Sorbonne’进行杂交,建立了一套适于克服卷丹百合远缘杂交障碍的方法以及杂种后代组培快繁体系。
运用4种授粉方式进行杂交,发现蕾期授粉的结实率最高,延迟授粉的最低,故在以卷丹为母本的杂交过程中采用蕾期授粉方式,能够较好地克服远缘杂交受精前障碍而得到更多膨大的杂交果实。为了克服卷丹远缘杂交的受精后障碍,还对所获胚珠进行了胚拯救,但最终只有卷丹בBlack stone’和卷丹בTresor’能够获得杂种苗,卷丹בSorbonne’的杂交组合没有获得萌发的杂种苗,这表明卷丹× ‘Sorbonne’远缘杂交的受精后障碍非常严重,杂种存在严重的难稔性,极难成活。卷丹和亚洲百合杂种系品种(‘Black stone’ ‘Tresor’)进行远缘杂交的杂种后代较容易成活,这与雷家军等[10]研究结果相一致。
在卷丹杂种苗增殖培养过程中,6–BA的质量浓度为1 mg/L时,适宜的NAA质量浓度可促进小鳞茎增殖,超过适宜浓度后,随着NAA浓度的增加,增殖系数下降,这与张睿婧等[11]、李卓忆[12]的试验结果相一致。在杂种苗膨大生根培养中发现,NAA质量浓度为0.10 mg/L时,0.05 mg/L 6–BA最能促进小鳞茎膨大生根,而当6–BA质量浓度超过0.05 mg/L时,出现抑制作用;对比配方3和配方4培养基可知,适宜的活性炭对卷丹בTresor’杂种苗的膨大生根有一定的促进作用。
由于组织培养过程中操作不当造成组培苗污染死亡,最终只获得了卷丹和‘Tresor’的2个杂种苗株系JA1、JA2。利用SSR分子标记技术对JA1、JA2株系的杂种后代进行真实性鉴定,其中从4对SSR引物的扩增结果中发现杂交后代中含有父母本双方或父本的特异性条带,确定2个株系的杂种后代均为真实性杂种。
百合杂种苗仍处于幼苗生长阶段,未能对其与亲本进行田间形态学观察比较,后续需对杂种后代的抗性、观赏性和食用价值等进行进一步评估,为培育出观赏兼食用百合新品种提供待选材料基础。
[1] 龙雅宜,张金政,张兰年.百合球根花卉之王[M].北京:金盾出版社,1999:1–34.
[2] 雷蒙蒙.卷丹百合的药理作用研究进展[J].职业与健康,2018,34(3):429–432.
[3] 林立浩,黄世霞,袁艺,等.卷丹百合连作障碍机制及治理措施研究进展[J].信阳农林学院学报,2021,31(1):107–110.
[4] 杨秀梅,瞿素萍,吴学尉,等.百合种质资源对枯萎病的抗性鉴定[J].西南大学学报(自然科学版),2010,32(6):31–34.
[5] TUYL J V,JEU M D.Methods for Overcoming Interspecific Crossing Barriers[M].Cambridge:Cambridge University Press,1997.
[6] 罗建让,牛立新,张延龙,等.百合野生种及品种交配亲和性的研究[J].西北农业学报,2006,15(2):112–116.
[7] 樊金萍,王洪亮,车代弟.百合远缘杂交胚胎发育情况的研究[J].中国林副特产,2005(2):5–7.
[8] 雷家军,庞兰,林翼飞,等.卷丹百合种间杂种胚培养研究[J].沈阳农业大学学报,2009,40(1):84–87.
[9] 张铭芳,吴磊磊,贾桂霞.百合不同杂交系品种花粉贮藏特性分析[J].西北植物学报,2013,33(7):1465–1472.
[10] 雷家军,林翼飞.卷丹与亚洲百合和东方百合种间杂交[J].东北林业大学学报,2009,37(12):37–38.
[11] 张睿婧,姜珊,席梦利,等.百合远缘杂交及其杂种鉴别研究[J].南京林业大学学报(自然科学版),2012,36(3):23–27.
[12] 李卓忆.观赏兼食用百合新品种的培育[D].北京:北京林业大学,2018.
Distant hybridization ofThunb.and identification of its hybrid progeny
SHU Ke1,2,LI Jianhong3,CHEN Lu1,4,FU Haiyan1,CAI Wei1,LIU Lichen1,LI Yufan1,2,4*
(1.College of Horticulture, Hunan Agricultural University, Changsha, Hunan 410128, China; 2.Hunan Engineering Research Center for the Breeding and Utilization of High-Quality Flowers and Trees in the Mid-Subtropics of Hunan Province, Changsha, Hunan 410128, China; 3.Yangmingshan Provincial Nature Reserve Management Station of Chongyi County Forestry Bureau of Jiangxi Province, Chongyi, Jiangxi 341300, China; 4.Engineering Research Center of Horticultural Crop Germplasm Innovation and New Variety Breeding Teaching Department, Changsha, Hunan 410128, China)
In order to cultivate new varieties ofwith strong resistance and excellent ornament, the pollen viability of three ornamental lily cultivars ‘Black stone’, ‘Tresor’ and ‘Sorbonne’ was measured by liquid medium hanging drop method, which were respectively used to conduct distant crosses with female parentThunb. using bud stage pollination, normal pollination, delayed pollination, and stigma-cutting pollination. Ovules of the obtained hybrid progeny were cultured and multiplied, and the authenticity of the hybrid was identified by the method of SSR molecular marker. The results showed that the pollen germination rate of ‘Sorbonne’ was generally higher than that of ‘Black stone’ and ‘Tresor’; the seed setting rate with pollination at the bud stage was the highest, which was 14.44%; the hybrid combination with the largest number of capsules isThunb. × ‘Black stone’, with 17 capsules. Ovules of the hybrid capsules were cultured, and 9 F1 generation hybrid seedlings were obtained. The optimum medium formula for hybrid seedling propagation is MS+30 g/L sucrose+0.1 mg/L NAA+1 mg/L 6-BA+8 g/L agar. The optimal medium formula for bulb expansion and rooting is MS+80 g/L sucrose+0.1 mg/L NAA+ 0.05 mg/L 6-BA+0.75 g/L activated carbon+6.5 g/L agar, and the optimal culture environment is dark nourish. Finally, the two hybrid lines ofThunb. × ‘Tresor’ were confirmed to be true hybrids through SSR molecular mark identification using four pairs of primers.
Thunb.; distant hybridization; ovule culture; propagation culture; SSR molecular mark
舒珂,李建红,陈璐,傅海燕,蔡维,刘李晨,李玉帆.卷丹百合远缘杂交及杂种后代的鉴定[J].湖南农业大学学报(自然科学版),2022,48(5):556–562.
SHU K,LI J H,CHEN L,FU H Y,CAI W,LIU L C,LI Y F.Distant hybridization ofThunb. and identification of its hybrid progeny[J].Journal of Hunan Agricultural University(Natural Sciences),2022,48(5):556–562.
http://xb.hunau.edu.cn

S644.103
A
1007-1032(2022)05-0556-07
10.13331/j.cnki.jhau.2022.05.008
2022–02–25
2022–05–10
湖南省科学技术厅项目(2021NK1005);湖南省教育厅优秀青年基金项目(19B262)
舒珂(1999—),男,湖南怀化人,硕士研究生,主要从事百合遗传育种研究,443895906@qq.com;*通信作者,李玉帆,博士,讲师,主要从事百合遗传育种研究,liyufan@hunau.edu.cn
责任编辑:罗慧敏
英文编辑:罗维

